2021 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
1. 다음은 H 원자와 F 원자의 바닥 상태의 전자 배치를 나타낸 것이다.
H: 1s2
F: 1s22s22p5
이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ③
ㄱ. s 오비탈은 구형의 전자 분포를 가지므로 오직 거리에만 의존하는 확률 밀도를 보여줌
ㄴ. 1s 오비탈의 에너지는 유효 핵전하의 제곱에 비례하는데, Slater's rule에 따르면 H의 1s 오비탈의 유효 핵전하는 1 - 0.3 = 0.7이고 F의 1s 오비탈의 유효 핵전하는 9 - 0.3 = 8.7임
ㄷ. Slater's rule에 따르면, F의 2s 오비탈의 유효 핵전하는 9 - (2 × 0.85 + 6 × 0.35) = 5.2이고 H의 1s 오비탈의 유효 핵전하는 1 - 0.3 = 0.7임
2. 그림은 2, 3주기 원소의 일부에 대해 원자 반지름(■)과 이온 반지름(○)을 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, A ~ E는 임의의 원소 기호이고, 이온은 옥텟 규칙을 만족한다.)
⑴ 문제
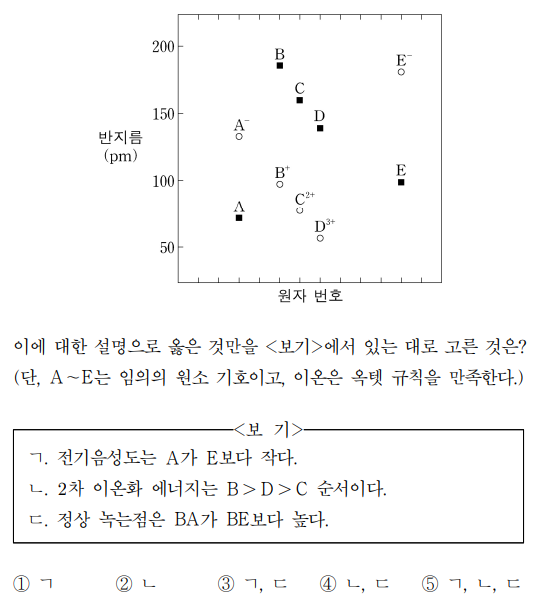
⑵ 풀이 : ④
ㄱ. 같은 주기에서 원자 번호가 증가할수록 반지름이 감소하므로 A는 2주기에 있고 나머지는 3주기에 있음. A-, B+, C2+, D3+, E-와 같은 화학종이 존재하므로 A : F, B : Na, C : Mg, D : Al, E : Cl이 성립하고 A는 전기음성도가 가장 큰 원자임 (F의 전기음성도 = 4.0)
ㄴ. 이온화 에너지 : Na (B), Mg (C), Al (D)의 2차 이온화 에너지 대소관계는 Na+ (Ne의 전자배치), Mg+ (Na의 전자배치), Al+ (Mg의 전자배치)의 1차 이온화 에너지 대소관계와 같고 그러므로 B ≫ D > C가 성립함
ㄷ. BA는 NaF이고 BE는 NaCl인데, 고체 결정에서 정상 녹는점은 이온 간 힘이 강할수록 높음. 그런데 이온 간 힘은 거리가 짧을수록 강하므로 BA가 BE보다 정상 녹는점이 높다는 설명은 타당함
3. 그림은 1,3-dichloroallene 분자의 구조식을 나타낸 것이다. 가장 타당한 루이스 구조를 근거로, 원자가 껍질 전자쌍 반발 이론과 원자가 결합 이론을 적용하여 이 분자에 대해 설명한 것으로 옳은 것은?
⑴ 문제

⑵ 풀이 : ①
① 1,3-dichloroallene은 평면 분자가 아니므로 C-Cl에 의한 쌍극자 모멘트가 상쇄되지 않음

② ㈎의 C의 혼성 오비탈은 sp2이고, ㈏의 C의 혼성 오비탈은 sp
③ ㈎와 ㈏의 C의 형식 전하는 모두 0
④ σ 결합 개수는 6개이고 π 결합 개수는 2개임
⑤ 결합 전자쌍 개수는 8개이고 비공유 전자쌍 개수는 6개임
4. 그림은 리튬(Li)의 원자 오비탈로부터 만들어진 Li2의 분자 오비탈 에너지 준위의 일부를 나타낸 것이다. 바닥 상태의 Li, Li2, Li2+에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 이온화는 오비탈의 에너지 준위를 변화시키지 않는다.)
⑴ 문제
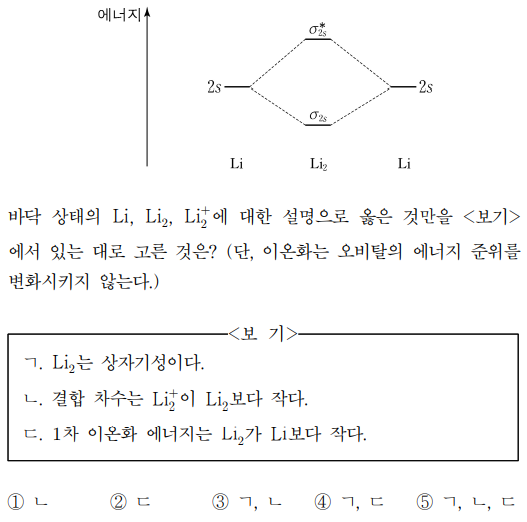
⑵ 풀이 : ①
ㄱ. σ2s 오비탈에 두 개의 전자가 채워져 있고 σ2s* 오비탈에 아무 전자도 없는 상황이므로 Li2는 반자기성
ㄴ. 결합 차수 = (결합 전자 수 - 반결합 전자 수) / 2이므로, Li2+의 결합 차수는 0.5이고 Li2의 결합 차수는 1
ㄷ. σ2s가 2s 오비탈보다 에너지 준위가 낮으므로 1차 이온화 에너지는 Li2가 Li보다 큼
5. 그림은 브로민화 리튬(LiBr) 결정의 면심 입방 단위 세포를 구성하는 모든 이온의 위치를 나타낸 것으로, 단위 세포의 모서리 길이는 a이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, Li과 Br의 원자량은 각각 7과 80이고, NA는 아보가드로 수이다.)
⑴ 문제
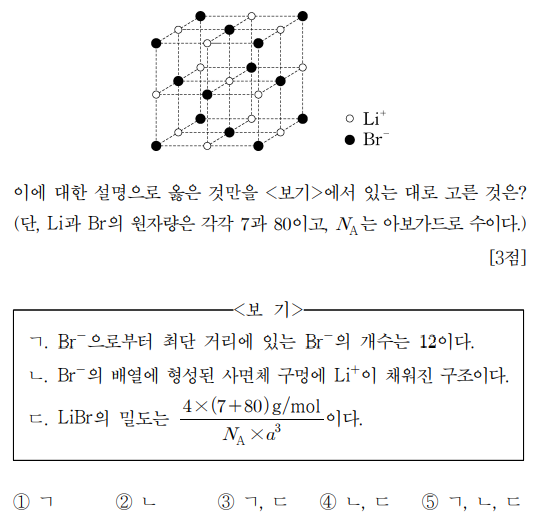
⑵ 풀이 : ③
ㄱ. 한 Br- 원자를 중심으로 x, y, z plane 별로 4개씩 있으므로 총 12개
ㄴ. 사면체 구멍(정사면체 틈새)이 아니라 팔면체 구멍(정팔면체 틈새)이 맞음
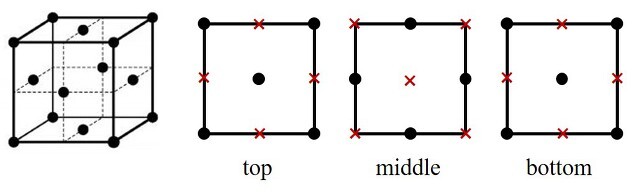
ㄷ. 단위 세포에 Li+가 0.5 × 8개, Br-가 0.5 × 8개 있으므로, LiBr의 밀도는 4 × (7 + 80) / NA / a3
6. 표는 Ne과 Ar 기체의 상태를 각각 나타낸 것이다. Ne과 Ar의 원자량은 각각 20과 40이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 기체는 이상 기체로 거동한다.)
⑴ 문제
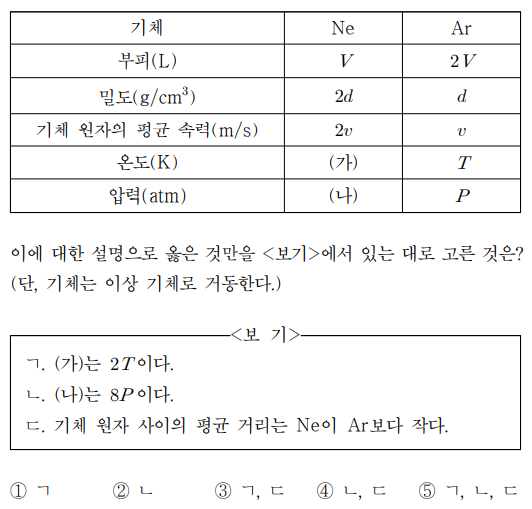
⑵ 풀이 : ⑤
ㄱ. vmean ∝ T0.5M-0.5이므로 Ne와 Ar 간의 분자량 차이를 고려하면 ㈎는 2T
ㄴ. PV = nRT로부터 P = ρRT / M을 얻을 수 있음
ㄷ. n/V = ρ/M으로부터 n/V 값은 Ne이 Ar보다 4배 더 큼. 그러므로 기체 원자 사이의 평균 거리는 Ne이 Ar보다 작음
7. 온도 T에서, 그림 ㈎는 용매만 통과할 수 있는 반투막으로 분리된 유리관에서 몰농도 C1인 포도당 수용액과, 압력 P0가 가해진 몰농도 C2인 포도당 수용액이 같은 높이로 평형을 이룬 상태를 나타낸 것이고, ㈏는 가해진 압력 P0를 제거한 후 새로운 평형에 도달한 상태를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 용액은 이상 용액이고, 용액의 밀도는 포도당 농도에 관계없이 ρ이며, 중력 가속도는 g이고, 기체 상수는 R이다. 포도당은 비휘발성 비전해질이다.)
⑴ 문제

⑵ 풀이 : ④
ㄱ. 삼투압 공식 : P0 = (C2 - C1)RT
ㄴ. ㈏에서 오른쪽은 중력에 의한 ρgh 만큼의 압력이 존재하므로 오른쪽 용액의 농도가 더 높음
ㄷ. ㈏에서 물이 왼쪽에서 오른쪽으로 이동하여 왼쪽 용액은 진해지고 오른쪽 용액은 묽어지므로, ρgh = (㈏에서 오른쪽 용액의 농도 - ㈏에서 왼쪽 용액의 농도) RT < (㈎에서 오른쪽 용액의 농도 - ㈎에서 왼쪽 용액의 농도) = P0
8. 다음은 반응물 A ~ C가 각각 생성물 X ~ Z를 생성하는 반응 ㈎ ~ ㈐의 반응식이고 k1 ~ k3는 반응 속도 상수이다. 반응 ㈎ ~ ㈐는 각각 0차, 1차, 2차 반응 중 하나이다.
㈎ A → X (반응속도 상수 = k1)
㈏ B → Y (반응속도 상수 = k2)
㈐ C → Z (반응속도 상수 = k3)
표는 반응 ㈎ ~ ㈐를 반응물의 농도가 각각 1 M인 상태에서 시작하여 주어진 값에 도달할 때까지의 반응 시간을 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 반응 과정에서 온도와 부피는 일정하다.)
⑴ 문제
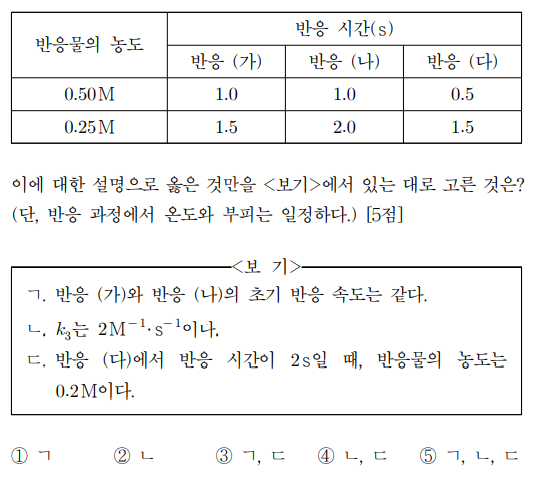
⑵ 풀이 : ④
ㄱ, ㄴ. 반응 ㈎는 반감기가 점점 짧아지고 반응 ㈏는 반감기가 일정하며 반응 ㈐는 반감기가 길어지므로 반응 ㈎, ㈏, ㈐는 각각 0차, 1차, 2차 반응임. 이를 통해, 반응속도 상수와 반감기의 관계식을 이용하면 k1 = 1/2, k2 = ln 2, k3 = 2임을 알 수 있음. 반응 ㈎와 반응 ㈏의 초기 반응 속도는 각각 0.5 M/s, ln 2 M/s임
ㄷ. 반응 ㈐에서 반응 시간이 2 s일 때, 반응물의 농도는 1/[A] = 1/[A]0 + k3t = 1 + 4 = 5로부터 0.2 M임을 알 수 있음
9. 다음은 A(g) + B(g) → C(g) 반응에 대해 제안된 반응 메커니즘이다. 사전평형(pre-equilibrium) 근사법을 적용한 전체 반응 속도는 다음과 같이 나타낼 수 있다.
전체 반응 속도 = k전체[A]m[B]n
이에 대한 설명으로 옳지 않은 것은?
⑴ 문제

⑵ 풀이 : ④
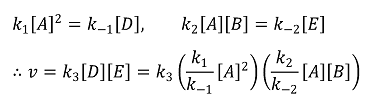
① 빠른 평형에 대한 맞는 설명
② 반응물은 D와 E, 총 2개가 있음
③ 중간체는 D와 E, 총 2개가 있음
④ 전체 반응 차수는 4
⑤ 맞는 설명
10. 그림은 반응 ㈎와 ㈏의 표준 반응 자유 에너지(ΔGº)를 온도(T)에 따라 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 표준 반응 엔탈피(ΔHº)와 표준 반응 엔트로피(ΔSº)는 주어진 온도 범위에서 일정하다.)
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. 반응 ㈎에서 ΔGº = ΔHº - TΔSº로부터, ΔSº = a / (T3 - T1) kJ/K을 얻을 수 있음. 한편, ΔHº = aT3 / (T3 - T1) kJ
ㄴ. 반응 ㈏에서 ΔGº = ΔHº - TΔSº로부터, ΔHº - T1ΔSº = 0 및 ΔHº - T2ΔSº = aT3 / (T3 - T1) - aT2 / (T3 - T1)를 얻을 수 있음. 이를 통해 ΔSº = a(T3 - T2) / (T3 - T1)이고 ΔHº = aT1(T3 - T2) / (T3 - T1)을 얻을 수 있음
ㄷ. ΔG = -RT ln K이므로 ΔG 값이 동일한 T2에서 두 반응의 평형 상수는 동일함
11. 그림 ㈎는 온도와 부피가 일정한 조건에서, 기체 A의 압력이 P초기인 초기 상태로부터 A(g) ⇄ B(g) + C(g) 반응이 진행되어 전체 압력이 P평형인 평형 상태에 도달한 것을 나타내고, ㈏는 400 K과 800 K에서 그림 ㈎의 과정의 P초기에 따른 P평형을 나타낸 것이다. A(g) ⇄ B(g) + C(g) 반응에 대한 설명으로 옳지 않은 것은? (단, Kp와 Kc는 각각 압력과 농도로 정의한 평형 상수이고, 기체는 이상 기체로 거동한다.)
⑴ 문제

⑵ 풀이 : ⑤
① 반응 결과 압력이 증가함. 온도가 증가했을 때 반응이 더 진행됐으므로 흡열 반응
② Kp = Kc × (RT)2-1이고 RT = 0.082 × 800 = 65.6 atm·L이므로 Kp는 Kc보다 큼
③ PA = 1 atm, PB = PC = 0.5 atm이므로 Kp = 0.52 / 1 = 0.25
④ 0.25 = PB × PC / PA2 = x2 / (0.5 - x)로부터 x = 0.25를 얻을 수 있음. 이를 통해 a = PA + PB + PC = 0.75를 얻음
⑤ ΔGº = -RT ln K인데 800 K에서가 400 K에서보다 더 많이 반응이 진행되어 K가 크므로, 역으로 ΔGº는 더 작음
12. 그림은 298 K에서 표준 생성 엔탈피(ΔHfº)가 0인 Sn (s, 백주석)과 Cl2 (g)로부터 SnCl4 (g)이 형성되는 과정과 표준 반응 엔탈피(ΔHº)를, 표는 관련된 열역학 자료를 나타낸 것이다. 298 K 표준 상태에서 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ③
ㄱ. SnCl4 (ℓ)의 ΔHfº는 ΔH1º + ΔH2º = -510 kJ/mol
ㄴ. Sn(s, 백주석) + Cl2 (g) → SnCl2 (s)의 표준 반응 엔탈피는 -325 kJ/mol이고 Sn(s, 회주석) + Cl2 (g) → SnCl2 (s)의 표준 반응 엔탈피는 -323 kJ/mol이므로 Sn(s, 회주석)의 ΔHfº는 -2 kJ/mol
ㄷ. SnCl4 (g)의 ΔHfº는 -470 kJ/mol이고 Cl(g)의 ΔHfº는 120 kJ/mol이므로 Sn (g)의 ΔHfº는 1250 - 4 × 120 + (-470) = 300 kJ/mol
13. 표는 298 K에서 벤젠(C6H6), 산소(O2), 이산화탄소(CO2), 물(H2O)의 열화학 자료를 나타낸 것이다. 298 K에서 1몰의 액체 벤젠이 완전 연소하는 반응에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 액체의 부피는 무시하고, 기체 상수 R는 8.31 J/mol·K이다.)
⑴ 문제
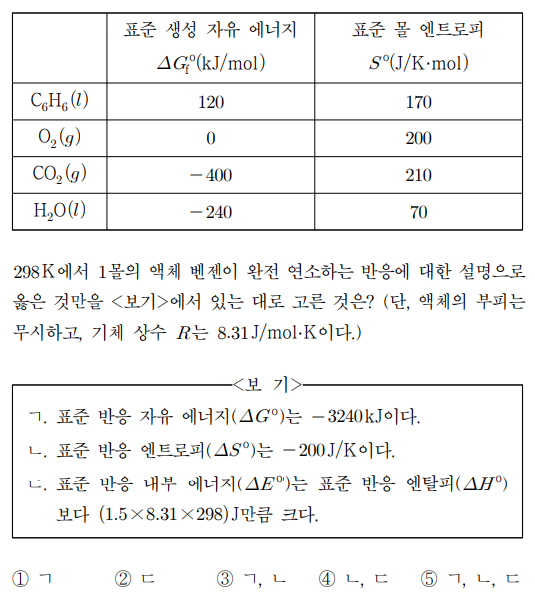
⑵ 풀이 : ⑤
ㄱ. C6H6 + 7.5O2 → 6CO2 + 3H2O의 표준 반응 자유 에너지는 6 × (-400) + 3 × (-240) - 120 - 0 = -3240 kJ
ㄴ. 표준 반응 엔트로피는 6 × 210 + 3 × 70 - 170 - 7.5 × 200 = -200 J/K
ㄷ. ΔEº = ΔHº - Δ(PV) = ΔHº - (Δngas)RT = ΔHº - (6 - 7.5) × 8.31 × 298 = ΔHº + 1.5 × 8.31 × 298
14. 표는 25 ℃에서 약산 수용액 ㈎ ~ ㈐에 대한 자료이다. 25 ℃에서 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ①
ㄱ. pH = -log [H+] = -log (0.1 × 0.01) = 3
ㄴ. HX의 산 해리 상수는 0.1 × 0.012 = 10-5이고, HY의 산 해리 상수는 0.2 × 0.0052 = 5 × 10-6
ㄷ. 산 해리 상수 = 0.02 × a2 = 0.1 × 0.012이므로, a = √5 × 0.01
15. 그림은 25 ℃에서 수용액의 pH에 따른 인산(H3PO4)의 해리를 H3PO4, H2PO4-, HPO42-, PO43-의 분율로 나타낸 것이다. 그림을 이용하여, 25 ℃에서 100 mL의 0.1 M 인산 수용액에 0.1 M NaOH 수용액 V mL를 가한 용액에 대해 설명한 것으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
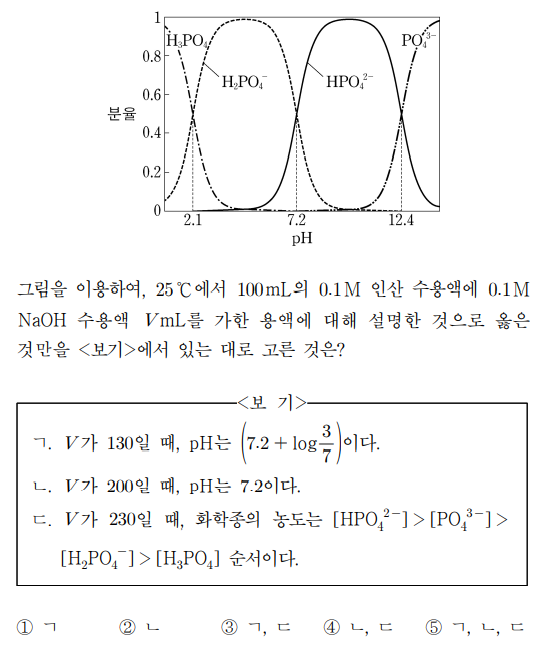
⑵ 풀이 : ③
ㄱ. V가 130일 때, 첫 100 mL NaOH 수용액으로 인해 제1 당량점에 도달하고 추가로 30 mL NaOH 수용액이 첨가됨으로써 pH = pKa2 + log (3 / 7) = 7.2 + log (3 / 7)
ㄴ. V가 200일 때, 첫 100 mL NaOH 수용액으로 제1 당량점에 도달하고 두 번째 100 mL NaOH 수용액으로 제2 당량점에 도달하므로 pH = (7.2 + 12.4) / 2 = 9.8
ㄷ. V가 230일 때, [HPO42-] : [PO43-] = 7 : 3이 성립하고 [PO43-] > [H2PO4-] > [H3PO4]임은 자명
16. 다음은 산성 수용액에서 철(Ⅱ) 이온(Fe2+)과 다이크로뮴산 이온(Cr2O72-)의 반응과, 관련된 반쪽 반응 및 25 ℃에서의 표준 환원 전위(Eº)를 나타낸 것이다. 25 ℃에서 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ②
ㄱ. Cr의 산화수는 [-2 - 7 × (-2)] / 2 = 6
ㄴ. Cr2O72- → 2Cr3+을 통해 총 6개의 전자가 환원되므로, a = 6이 되어 Fe2+ → Fe3+을 통해 총 6개의 전자가 산화됨
ㄷ. ΔGº = -nFEº = -6F(1.33-0.77) = -RT ln K이므로, K = 10(1.33 - 0.77) × 6 / 0.0592
17. 그림은 철(Fe) 전극이 사용된 반쪽 전지 ㈎와 백금(Pt) 전극이 사용된 반쪽 전지 ㈏를 NaNO3 염다리로 연결한 갈바니 전지의 초기 상태를, 표는 두 전극의 반쪽 반응식과 25 ℃에서의 표준 환원 전위(Eº)를 나타낸 것이다. 25 ℃에서 이에 대한 설명으로 옳은 것은? (단, 주어진 전지 반응 이외의 산화-환원 반응은 일어나지 않는다.)
⑴ 문제

⑵ 풀이 : ②
① Fe (s) → Fe2+ (aq) + 2e-와 Fe3+ (aq) + e- → Fe2+ (aq)가 커플링 돼 있는 갈바니 전지로서 철 전극은 산화전극, 즉 (-)극
② 초기 상태의 기전력은 E = Eº - (0.0592 / 2) × log Q = 1.22 - (0.0592 / 2) × log (0.22 × 0.1 / 0.22) = 1.22 + 0.0592 / 2
③ 전지 반응이 일어날 때 환원 전극인 백금 전극에 질량 변화는 없음
④ Fe2+은 2개가 생성됨
⑤ 환원 전극은 백금 전극으로 전자가 이동하는 양상이므로 염다리에서 음이온은 이를 보상하기 위해 ㈎ 방향으로 이동함
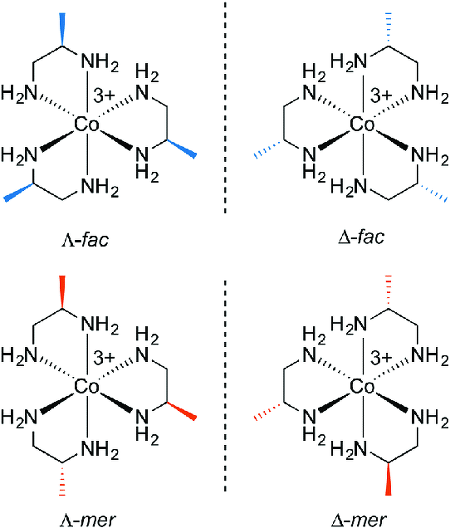
18. 다음은 Co(Ⅲ)의 팔면체 착물 [Co(NH3)6]3+이 [Co(en)3]3+으로 되는 리간드 치환 반응을 나타낸 것이다. [Co(NH3)6]3+은 반자기성이고, [Co(en)3]3+은 가시광선 영역에서 최대 흡수 파장이 λ최대이다. [Co(en)3]3+에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, en은 두 자리 리간드인 에틸렌다이아민이고, h는 플랑크 상수이다.)
⑴ 문제

⑵ 풀이 : ②
ㄱ. Co3+는 [Ar] 3d6임. 그리고 [Co(NH3)6]3+이 반자기성이므로 [Co(NH3)6]3+는 low spin임을 알 수 있음. 따라서 리간드 장 갈라짐이 더 큰 en이 배위결합하고 있는 [Co(en)3]3+은 low spin이고 반자기성
ㄴ. Λ 이성질체와 Δ 이성질체 등 총 2개의 거울상 이성질체가 존재함
ㄷ. 결정장 갈라짐 에너지(Δ) = hf = hc / λ
19. 그림은 백금 착화합물 ㈎로부터 착화합물 ㈏와 ㈐를 단계적으로 합성하는 과정을, 표는 각 착화합물의 조성을 몰비로 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ③
ㄱ. ㈎ → ㈏ 반응에서 ㈎ 1몰당 Cl 2몰이 방출되고, 이때 H가 2몰이 필요하므로 ㈎와 N2H4는 1 : 0.5의 몰비로 반응
ㄴ. ㈏와 ㈐에서 Pt의 전하는 +2로 동일하므로 배위수 또한 동일함
ㄷ. 1몰의 ㈐가 용매에 녹더라도 배위결합에 의해 1몰의 이온만이 용액 내에 잔류
20. 다음은 황산 철(Ⅱ) 칠수화물(FeSO4·7H2O)을 합성하는 실험이다. 이에 대한 설명으로 옳은 것은?
⑴ 문제

⑵ 풀이 : ④
① Fe에 H2O 분자가 배위 결합하고 있고 SO42-는 이온 결합에 의해 붙어 있음
② 과정 ㈎에서 철이 녹을 때 H+가 환원하여 수소 기체가 발생
③ 과정 ㈏에서 걸러낸 고체의 주성분은 반응하지 않은 철가루
④ 재결정(recrystalization) : 용해도 차이를 이용한 혼합물 분리. 에탄올을 가하는 이유는 에탄올에서 용해도가 낮기 때문
⑤ H2SO4를 10 mmol 첨가했으므로 이론적 수득량은 10 mmol이고 9 mmol을 실제로 얻어 퍼센트 수득률은 90%
입력: 2022.12.03 15:01
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【유기화학】 2023 PEET 유기화학 (11) | 2023.08.06 |
|---|---|
| 【화학】 2019 MEET/DEET 화학 (2) | 2023.03.16 |
| 【화학】 MEET/DEET 화학 풀이 (0) | 2022.09.25 |
| 【화학】 2018 MEET/DEET 화학 (0) | 2022.09.25 |
| 【화학】 2020 MEET/DEET 화학 (5) | 2022.09.25 |




최근댓글