2019 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
블랙루 님 지적사항 수정 (23.10.19)
1. 표는 어떤 Li 원자의 전자 배치를 4가지 양자수(n, l, ml, ms)로 나타낸 것이다. n, l, ml, ms는 각각 주양자수, 각운동량 양자수, 자기 양자수, 스핀 양자수이다.
⑴ 문제

⑵ 풀이 : ⑤
① 바닥 상태였다면 전자 3의 주양자수 n이 2여야 함
② 전자 1과 전자 2는 paired electrons이고, 전자 3이 유일한 홀전자를 구성함
③ 전자 1은 n = 1, l = 0이기 때문에 1s임
④ 에너지는 n이 클수록 큼
⑤ 마디의 개수 = n - 1 = 2
2. 표는 주기율표의 일부를 나타낸 것이다.
⑴ 문제

⑵ 풀이 : ④
① 같은 주기에서 원자 반지름은 족이 증가할수록 감소
② 1차 이온화 에너지는 족이 증가할수록 증가하는데, 2족-13족 및 15족-16족 간 경향성 비교만 주의하면 됨
③ Slater's rule에 의해, F(1s22s22p5)의 유효핵전하는 9 - (0.35 × 6 + 0.85 × 2) = 5.2이고 Na(1s22s22p63s1)의 유효핵전하는 2.2임. 직관적으로 F의 최외각 전자는 1s 전자에 의해서만 주된 가리움 효과를 받지만 Na의 최외각 전자는 1s 및 2s 전자 모두에 의해 주된 가리움 효과를 받아 최외각 전자의 유효 핵전하는 F가 Na보다 큼
④ 1s 오비탈의 에너지 준위는 유효 핵전하가 클수록 낮음. 즉, 유효 핵전하가 클수록 더 음의 위치 에너지를 가짐
⑤ 암기사항
3. 그림은 XeO2F2의 공명 구조 일부를 나타낸 것이다.
⑴ 문제
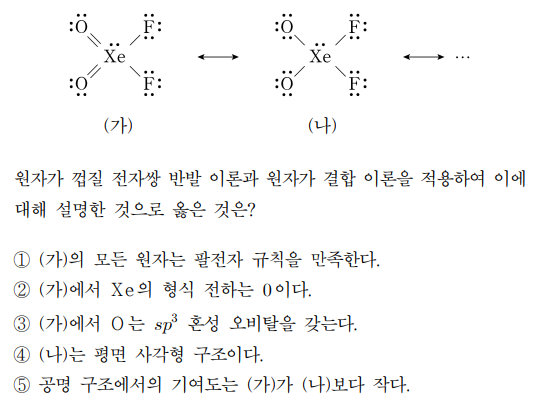
⑵ 풀이 : ②
① ㈎의 Xe의 최외각 전자는 14개로 팔전자 규칙을 만족하지 않음
② ㈎에서 O, F의 형식 전하는 모두 0이고, 전체의 전하도 0이므로 Xe의 형식 전하도 0임
③ ㈎에서 O는 sp2 혼성 오비탈을 가짐
④ VSEPR에 의해, ㈏는 입체수 5에 전자쌍이 1개이므로 시소형(see-saw form)
⑤ 3주기 이상에서는 확장 오비탈 규칙이 적용되어 Xe의 형식 전하가 0인 ㈎가 선호됨 (즉, 공명 기여도가 큼)
4. 그림은 O2의 2가지 상태에 대한 분자 오비탈의 에너지 준위와 전자 배치를 나타낸 것이다.
⑴ 문제

⑵ 풀이 : ①, ②, ③, ④, ⑤
ㄱ. ㈎는 모든 전자가 pair를 이루고 있으므로 반자기성 (O)
ㄴ. ㈏가 바닥 상태가 되려면 spin의 합의 절댓값이 최대가 되어야 함 (X)
ㄷ. ㈎와 ㈏의 결합 차수는 (6 - 2) / 2 = 2 (X)
○ 스핀 보존의 법칙(전자는 전이할 때 스핀이 바뀌지 않음)에 위배되는 전자 배치라서 모두 정답 처리 한 것으로 추정
5. 그림은 Ne(네온)과 Rn(라돈) 기체를 300 K에서 혼합하고 압축한 후, 250 K로 냉각하는 과정을 단계적으로 나타낸 것이다.
⑴ 문제
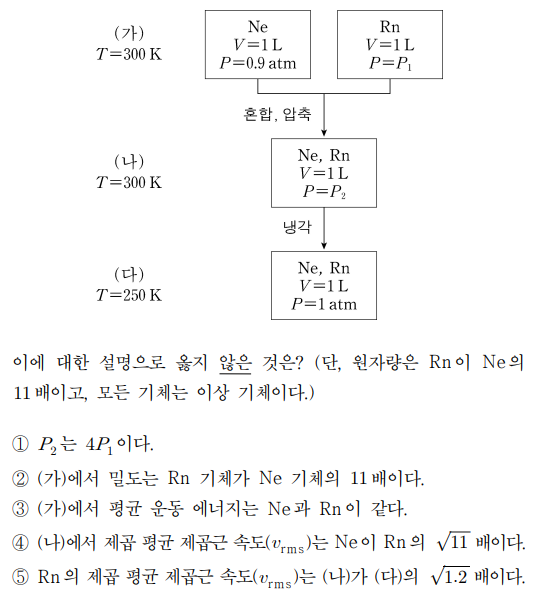
⑵ 풀이 : ②
① ㈎ → ㈏에서 P2 × 1 = 0.9 × 1 + P1 × 1을 얻고, ㈏ → ㈐에서 1 × 1 / 250 = P2 × 1 / 300을 얻음. 따라서 P1 = 0.3 atm, P2 = 1.2 atm을 얻음
② ρ = MP / RT (단, M은 분자량)이므로, ρRn : ρNe = 11 × 0.3 : 1 × 0.9 = 11 : 3
③ 평균 운동 에너지는 순전히 온도에 비례함
④ vrms = √(3RT / M) (단, M은 분자량)이므로, vrms, Rn : vrms, Ne = 1 : √11
⑤ vrms, ㈏ : vrms, ㈐ = √300 : √250 = √1.2 : 1
6. 그림은 형석 CaF2 결정의 입방 단위 세포를 구성하는 모든 이온의 위치를 나타낸 것이다. 단위 세포의 모서리 길이는 a이다.
⑴ 문제

⑵ 풀이 : ①
① Ca2+의 배위수는 Ca2+와 인접한 F-의 개수로 8임
② F-의 배위수는 F-와 인접한 Ca2+의 개수로 정사면체 틈새와 관련하여 4임
③ 면심 입방 구조
④ 주어진 구조가 단위 세포임
⑤ 주어진 구조에서 Ca2+의 개수는 8 × 1/8 + 6 × 1/2 = 4임
7. 그림 ㈎는 벤젠과 톨루엔의 혼합 용액의 분별 증류 과정을 나타낸 것이고, 그림 ㈏는 1기압에서 벤젠의 몰분율(x벤젠)에 따른 용액의 끓는점(곡선 Ⅰ)과 증기의 응축점(곡선 Ⅱ)을 나타낸 것이다. 그림 ㈎의 증류관 내부의 모든 위치에서 증기와 액체 용액은 평형을 이루고 있으며, A 지점과 B 지점의 온도는 각각 92 ℃와 84 ℃이다.
⑴ 문제
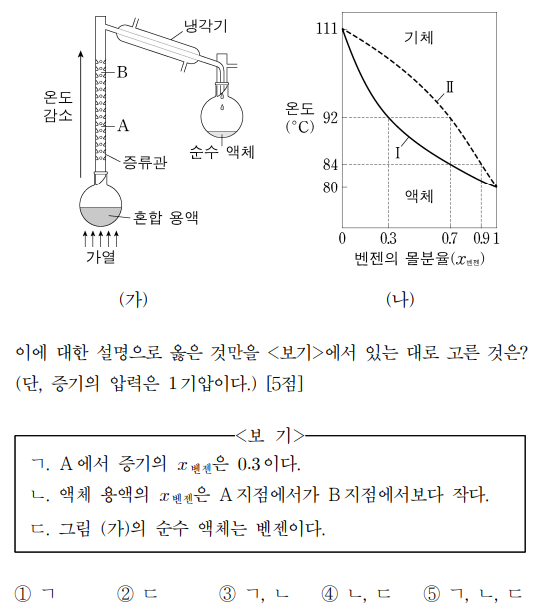
⑵ 풀이 : ④
ㄱ. 우선 혼합 용액의 몰분율이 알려져 있지 않음을 유의해야 함. 만약 A에서 증기의 x벤젠이 0.3이라면, A에서 벤젠과 톨루엔 모두가 액화하므로 순수 액체를 획득할 수 없음
ㄴ. 벤젠의 끓는점은 80 ℃이고, 톨루엔의 끓는점은 111 ℃이다. 끓는점이 높은 톨루엔이 증기관에서 먼저 액화하므로 x벤젠은 A → B로 갈수록 높아짐
ㄷ. 끓는점이 낮은 벤젠이 증류관을 액화되지 않고 통과할 수 있어 순수 액체로 얻어지는 것은 벤젠임
8. 300 K에서 분해 반응, N2O4 (g) ⇄ 2NO2 (g)의 평형 상수(Kp)는 0.16이다. 그림에서 ㈎는 300 K, 0.32 atm에서 NO2와 N2O4가 평형을 이룬 상태를, ㈏는 ㈎의 온도를 310 K로 높인 후 도달된 평형 상태를, ㈐는 ㈏에 Ar 기체를 주입한 후 도달된 평형 상태를 나타낸 것이다.
⑴ 문제

⑵ 풀이 : ⑤
① Kp = PNO22 / PN2O4 = 0.16, PN2O4 + PNO2 = 0.32 atm으로부터 PN2O4 = PNO2 = 0.16 atm을 얻음
② ΔG° = -RT ln Kp > 0
③ ΔH° = ΔG° + TΔS° > 0이므로, 르 샤틀리에 원리에 의해 310 K에서 Kp는 0.16보다 커짐
④ ③에 의해, 온도 증가에 의해 정반응이 더 진행되므로 기체의 몰수 총합은 ㈏가 ㈎보다 큼
⑤ 만약 온도를 동일하게 유지한 채 갑자기 Ar을 투입하면 전체 압력이 높아지므로 전체 압력이 0.32 atm으로 맞춰지려면 역반응이 진행(→ NO2 감소, N2O4 증가)돼야 함. 그러므로 N2O4의 분압은 ㈐에서가 ㈏에서보다 큼
9. 표는 25 ℃에서 Ag+과 관련된 평형 반응식과 평형 상수를 나타낸 것이다.
⑴ 문제
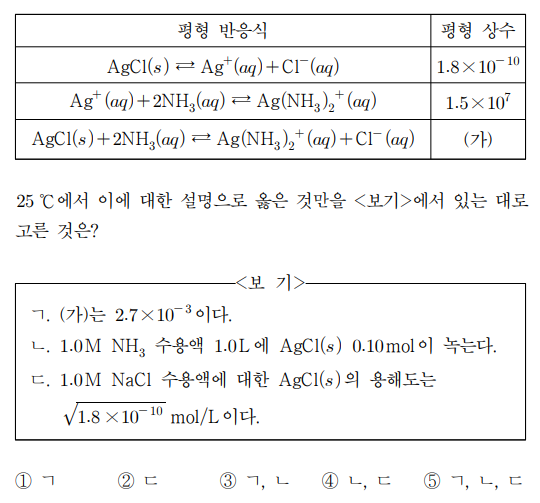
⑵ 풀이 : ①
ㄱ. ㈎는 (1.8 × 10-10) × (1.5 × 107) = 2.7 × 10-3
ㄴ. AgCl(s) 0.10 mol이 모두 녹는다고 가정하면, Q = 0.10 × 0.10 / 0.82 = 1/64 > 2.7 × 10-3 = K. 따라서 다 녹지는 않음
ㄷ. Cl- 농도는 거의 1.0 M로 고정되므로 s × 1.0 = 1.8 ×10-10. 즉, AgCl(s)의 용해도는 1.8 × 10-10 mol/L.
10. 그림은 298 K, 표준 상태에서 과산화 수소(H2O2)가 분해되는 반응 경로와 각 단계의 표준 반응 엔탈피를 나타낸 것이다.
⑴ 문제
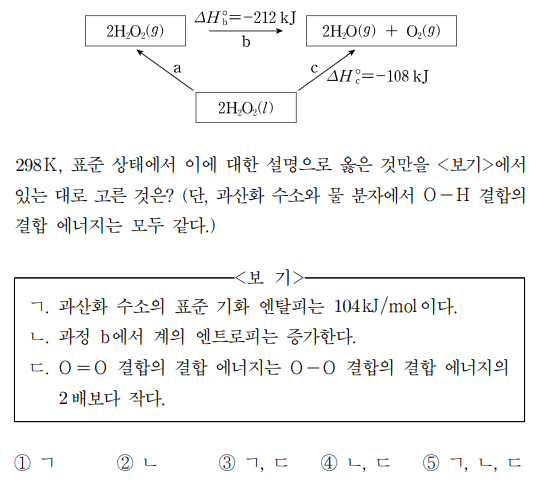
⑵ 풀이 : ②
ㄱ. 과산화 수소의 표준 기화 엔탈피는 (212 - 108) / 2 = 104 kJ / mol.
ㄴ. 과정 b에서 반응 당 기체 분자의 수가 2에서 3으로 증가했으므로 계의 엔트로피는 증가함
ㄷ. b 반응의 엔탈피가 (-)이기 때문에, O=O 결합은 O-O 결합의 두 배보다 더 강한 결합임을 암시함
11. 표는 298 K에서 PCl5(g)의 분해 반응 ㈎와 생성 반응 ㈏에 대한 반응식과 열화학 자료를 나타낸 것이다.
⑴ 문제
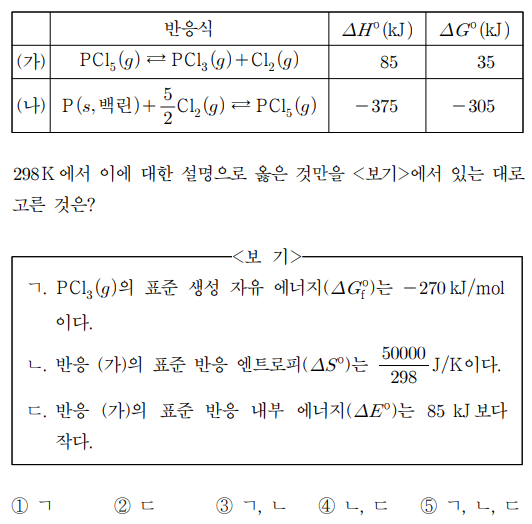
⑵ 풀이 : ⑤
ㄱ. ㈏를 통해 PCl5 (g)의 표준 생성 자유 에너지는 -305 kJ / mol. ㈎로부터 ΔGf°(PCl3 (g)) - ΔGf°(PCl5 (g)) = 35. ΔGf°(PCl3 (g)) = -270 kJ / mol
ㄴ. 35 kJ = 85 kJ - 298 K × ΔS°
ㄷ. ΔH = ΔE + Δ(PV)이고 Δ(PV) = PΔV>0이므로 ΔE는 85 kJ보다 작음
12. 다음은 H2 (g) + Br2 (g) → 2HBr (g) 반응에 대해 제안된 메커니즘이다.
⑴ 문제

⑵ 풀이 : ③
① 단계 ⑴은 평형을 이루므로 정반응 속도와 역반응 속도를 내포함을 당연히 전제함
② 단계 ⑵가 단계 ⑶보다 느리므로 활성화 에너지는 단계 ⑵가 더 크다고 할 수 있음
③, ④ 다음과 같이 계산할 수 있음
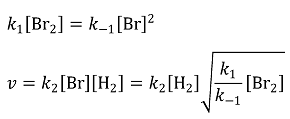
⑤ 라디칼은 대표적인 중간체
13. 그림 ㈎는 300 K와 600 K에서 A → P1 반응의 반응물 농도를 반응 시간에 따라 각각 나타낸 것이고, 그림 ㈏는 300 K에서 B → P2 반응의 반응물 농도를 시간에 따라 나타낸 것이다.
⑴ 문제
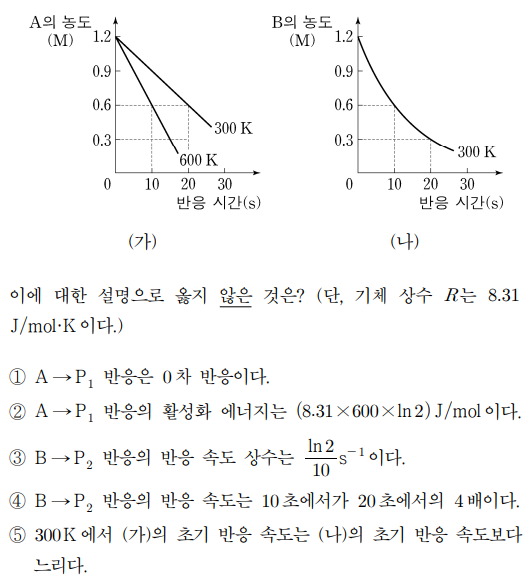
⑵ 풀이 : ④
① A → P1 반응은 A의 농도에 전혀 무관하므로 0차 반응
② k300 K = 0.3 M / s, k600 K = 0.6 M / s인데, 아레니우스 식 ln k = ln A - Ea / RT로부터 Ea = 8.31 × 600 × ln 2를 얻음
③ B → P2 반응은 1차 반응이고, 반감기가 10초이므로 k = ln 2 / 10 (s-1)
④ B → P2 반응의 반응 속도는 k[B]로 표현되며 10초가 20초보다 [B]가 2배이므로 반응 속도도 2배여야 함
⑤ 300 K에서 ㈎의 초기 반응 속도는 0.3 M / s이고, ㈏의 초기 반응 속도는 0.12 × ln 2 M / s
14. 그림은 25 ℃에서 0.10 M 이양성자 염기 B의 수용액 10.0 mL를 0.10 M HCl 표준 용액으로 적정하여 얻은 적정 곡선을 나타낸 것이다.
⑴ 문제
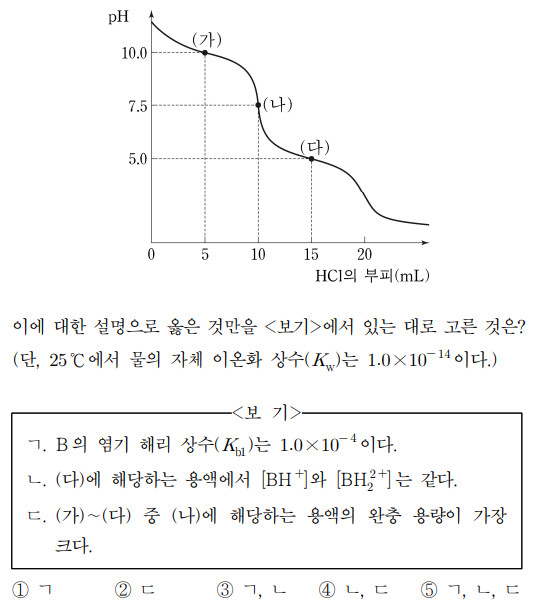
⑵ 풀이 : ③
ㄱ. ㈎에서 pKb1 = pOH = 4가 성립함
ㄴ. 맞는 설명
ㄷ. 완충 용량은 짝산과 짝염기가 1 : 1로 있을 때 가장 크며, ㈏는 [BH+]만 존재하므로 완충 용량이 가장 작음
15. 그림은 25 ℃에서 약산 HA 수용액의 몰농도에 따른 pH를 나타낸 것이다.
⑴ 문제
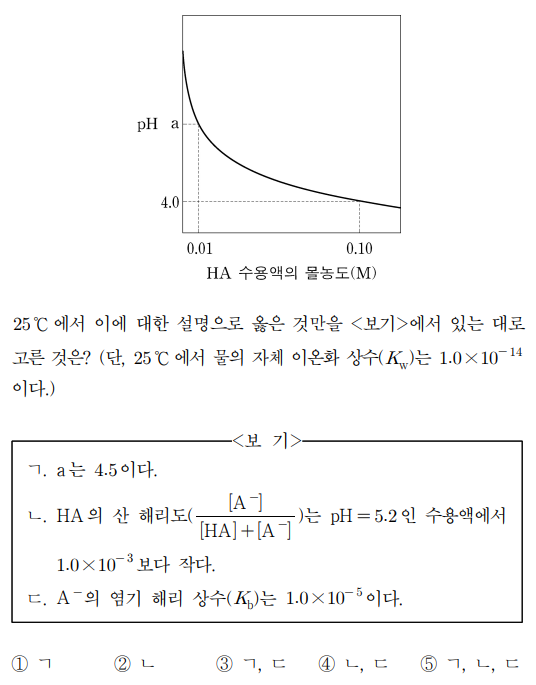
⑵ 풀이 : ①
ㄱ. [H+][A-] / [HA] = Ka로부터 pH = -0.5 (log [HA] + log Ka)를 얻을 수 있음. Ka = 10-7임을 쉽게 알 수 있어서, a = -0.5 (log 0.01 + log 10-7) = 4.5
ㄴ. 핸더슨-하셀바흐 식에 따라, pH = 5.2 = pKa + log ([A-] / [HA]). 따라서 [A-] / ([HA] + [A-]) = 10-1.8 / (1 + 10-1.8) > 10-3
ㄷ. A-의 염기 해리 상수(Kb)는 10-14 / (10-7) = 10-7
16. 그림은 산소와 물에 의해 철(Fe)이 부식되어 녹(Fe2O3·xH2O)이 형성될 때, ⑴ ~ ⑶ 지점에서 일어나는 반응과 해당 반응식을 각각 나타낸 것이다.
⑴ 문제

⑵ 풀이 : ①
① Fe는 Fe3+이 되고 (산화수 변화 : +3) O2는 2O2-가 되므로 (산화수 변화 : -4), Fe와 O2는 4 : 3의 몰비로 반응
② 전체 부식 과정에서 Fe는 1몰당 총 3몰의 전자를 잃음
③ 물을 통해 ⑴에서 ⑶으로 전자가 이동함
④ NaCl이 물에 녹아 있으면 대체적인 산화환원 반응이 일어나서 부식이 더 빨라짐
⑤ 철보다 환원력이 큰 금속을 연결해야 함
17. 표는 바닥 상태에 있는 4가지 착이온의 구조와 홀전자 개수를 나타낸 것이다.
⑴ 문제
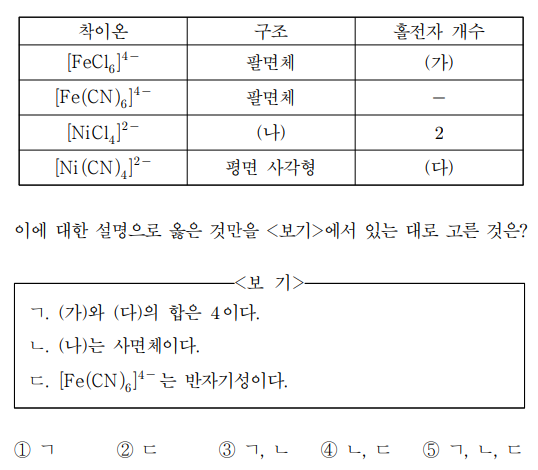
⑵ 풀이 : ⑤
ㄱ. Fe의 산화수는 +2이므로 4s2 전자 두 개 날리고, d 오비탈 전자 6개를 고려하면 됨. low-spin을 가정하면 ㈎ = 0이라고 할 수 있음. ㄷ 선택지를 준 것을 보면 low-spin으로 푸는 흐름이 필연적임
ㄴ. Ni의 산화수는 +2이므로 4s2 전자 두 개 날리고, d 오비탈 전자 8개를 고려하면 됨. 4배위이므로 평면 사각형과 사면체를 고려할 수 있는데, 평면 사각형인 경우 홀전자 개수가 0이 되어 사면체가 맞음
ㄷ. [FeCl6]4-가 low-spin이므로 더 리간드 장 갈라짐이 큰 CN-와 배위 결합을 하고 있는 [Fe(CN)6]4-도 또한 low-spin. 따라서 d 오비탈 전자 6개가 모두 paired이므로 반자기성이 맞음
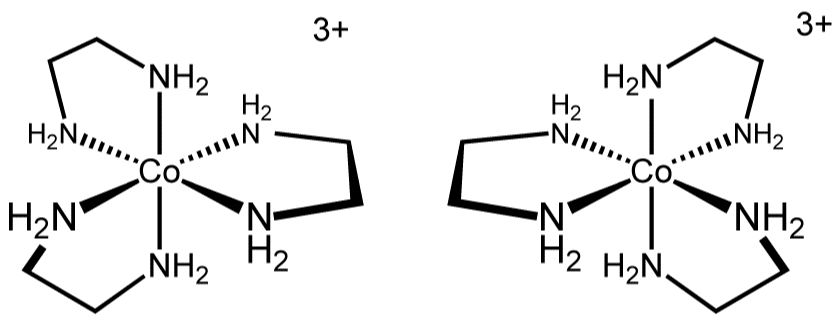
18. 그림은 두 자리 리간드인 bpy을 나타낸 것이다.
⑴ 문제

⑵ 풀이 : ④
ㄱ. bpy를 xy-plane에 두었을 때, z축으로만 Cl-이 있는 경우, z축으로만 Br-이 있는 경우, 그 밖의 나머지 (거울상 이성질체 존재)와 같이 나타낼 수 있어 입체이성질체의 개수는 총 4개
ㄴ. 두 개의 bpy가 같은 plane에 있을 때, 두 개의 bpy가 다른 plane에 있을 때 (거울상 이성질체 존재)와 같이 나타낼 수 있어 입체이성질체의 개수는 총 3개
ㄷ. 대칭성 리간드가 3개 붙어 있는 경우 거울상 이성질체를 가져, 입체이성질체의 개수는 총 2개
19. 다음은 고체 용해도의 온도 의존성을 이용한 분별 결정 실험이다.
⑴ 문제

⑵ 풀이 : ②
㉠ 10 ℃에서 K2Cr2O7이 가장 용해도가 낮으므로 가장 먼저 석출됨
㉡ 80 ℃에서 NaCl이 가장 용해도가 낮으므로 그 다음으로 NaCl이 석출됨
㉢ 여전히 잔존해 있는 Na2Cr2O7과 KCl이 반응을 진행시켜 ㈒에 이르러 추가적으로 K2Cr2O7이 석출됨
20. 다음은 아스코브산(ascorbic acid, C6H8O6) 수용액의 미지 농도를 분석하기 위한 실험이다.
⑴ 문제

⑵ 풀이 : ④
① 녹말은 I-는 염색하지 않지만 요오드 덩어리(예 : I3-)는 염색시킴
② I-는 1.8 × 10-2 mol을 가하고 I2는 2.50 × 10-3 mol을 가하는데 두 화합물이 1 : 1로 반응하므로 한계 반응물은 I2
③ 아스코르브산은 산소를 받아들여 산화하므로 환원제임
④ ㈏ 과정 이후에 250 mL 용액 안에 I- = 6.2 × 10-2 M, I2 = 0, I3- = 10-2 M이 됨
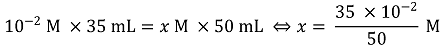
⑤ I3- → 3I-이 되는 과정에서 2몰의 전자가 이동하는데 이 전자들은 아스코브산으로부터 왔음
입력 : 2023.03.16 00:44
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【화학】 2024 MEET/DEET 화학 (7) | 2023.08.11 |
|---|---|
| 【유기화학】 2023 PEET 유기화학 (11) | 2023.08.06 |
| 【화학】 2021 MEET/DEET 화학 (4) | 2022.12.04 |
| 【화학】 MEET/DEET 화학 풀이 (0) | 2022.09.25 |
| 【화학】 2018 MEET/DEET 화학 (0) | 2022.09.25 |




최근댓글