2024 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
1. 다음은 원소 X ~ Z의 중성 원자에 대한 바닥 상태 전자 배치를 나타낸 것이다. 이에 대한 설명으로 옳은 것은?
⑴ 문제

⑵ 풀이 : ④
① X ~ Z는 각각 탄소, 질소, 산소 원자로 홀전자 개수는 각각 2개, 3개, 2개임
② 같은 주기에서 원자 반지름은 원자번호가 증가할수록 작아짐
③ 1s 오비탈의 에너지 준위는 원자번호가 증가할수록 더 음의 퍼텐셜을 가짐
④ 각운동량 양자수가 1인 오비탈은 2p 오비탈이고 이때 스핀은 훈트 규칙(Hund's rule)에 의해 모두 같은 방향이 됨 : ms에는 +1/2, -1/2밖에 없으며 각각이 서로 다른 방향의 스핀을 나타냄
⑤ 방사 방향 마디 개수는 n - ℓ - 1이므로 해당 개수가 0이 되려면 1s 오비탈 혹은 2p 오비탈이어야 함 → 전자 5개
2. 그림은 2, 3주기 원소의 일부에 대하여 원자 반지름과 전자 친화도를 나타낸 것이다. 이에 대한 설명으로 옳은 것은?
⑴ 문제

⑵ 풀이 : ④
① (n+2)번에서 (n+3)번으로 갈 때 원자 반지름이 갑자기 커지므로 (n+2)번 원자는 Ne, (n+3)번 원자는 Na라고 할 수 있음. 그러므로 n번 원자은 O (원자가 전자 : 6개)이고, (n+3)번 원자는 Na (원자가 전자 : 1개)
② (n+2)번 원자는 Ne, (n+3)번 원자는 Na인데 비활성 기체가 알칼리 금속보다 당연히 1차 이온화 에너지가 큼 : 비활성 기체는 이미 안정한 상태이고, 알칼리 금속은 전자 1개를 잃어버려야 안정한 상태가 되므로
③ (n+3)번 원자는 Na, (n+4)번 원자는 Mg인데, 같은 주기에서 원자 번호가 증가할수록 원자반지름이 작아지므로 최외각 전자의 유효 핵전하는 커져 Mg가 Na보다 최외각 전자의 유효 핵전하가 더 큼
④ n번 원자는 O, (n+1)번 원자는 Fe인데, 전자 친화도는 2족, 15족, 18족을 제외하고는 대체로 주기율표 상의 오른쪽 위로 갈수록 커지므로 (n+1)번 원자인 Fe가 n번 원자인 O보다 전자 친화도가 큼
⑤ (n+1)번 원자는 Fe이고 (n+4)번 원자는 Mg이므로 안정한 2 : 1 고체 화합물을 만듦
3. 다음은 중심 원자가 3주기 원소인 3가지 분자이다. 가장 타당한 루이스 구조를 근거로, 원자가 껍질 전자쌍 반발 이론과 원자가 결합 이론을 적용하여 이에 대해 설명한 것으로 옳지 않은 것은?
⑴ 문제

⑵ 풀이 : ④
① 정사면체 구조
② P의 원자가 전자는 5로 3개의 F와 각각 한 쌍의 전자를 공유하고, 나머지 한 쌍의 비공유 전자쌍을 가짐 (입체수 4) → 형식전하 0
③, ④ SF4에서 S는 각 F에 한 쌍의 전자를 공유하고 (형식 전하가 0이 되기 위해) 비공유 전자쌍 1쌍을 가짐 (입체수 5). SF4에서 S의 형식 전하 = 원자가 전자 - 결합전자 수 ÷ 2 - 비공유전자 수 = 6 - 8 / 2 - 2 = 0. 이때, S는 옥텟 규칙을 만족하지 않은데 이게 가능한 이유는 3d 오비탈 때문

⑤ ∠ (F-Si-F)는 정사면체의 대칭성으로 인해 109.5°인데 반해, ∠ (F-P-F)는 비공유 전자쌍에 의한 반발로 인해 109.5°보다 작아짐
4. 그림은 알릴 양이온(CH2CHCH2+)의 탄소 2pz 오비탈로부터 만들어지는 π 분자 오비탈 MO1 ~ MO3을 나타낸 것이다. 바닥 상태 CH2CHCH2+에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ①
ㄱ. H2C=C-C+H2와 같은 구조에서 C=C 결합은 1개의 σ 결합과 1개의 π 결합으로 구성. 그리고 1개의 π 결합은 2개의 전자로 구성됨
ㄴ. MO1은 마디(nodal plane)가 1개이고, MO3은 마디(nodal plane)가 2개이므로 MO3의 에너지 준위가 더 높음
ㄷ. MO1, MO2, MO3의 마디 개수는 각각 1개, 0개, 2개
5. 그림은 구멍이 있는 용기에 단원자 이상 기체 A 또는 B가 들어 있는 초기 상태를 나타낸 것이고, 표는 T1 K과 T2 K에서 A와 B의 초기 분출 속도를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
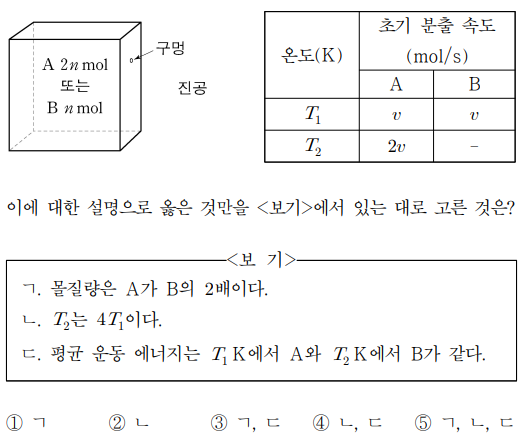
⑵ 풀이 : ②
ㄱ. A와 B의 제곱평균제곱근 속도가 동일하므로, 몰질량도 동일함


ㄷ. 평균 운동 에너지는 오직 온도에 관계함
6. 그림 ㈎는 비휘발성 A가 X에 녹아 있는 용액이, ㈏는 X와 Y로 이루어진 용액이 각각의 증기와 평형을 이루고 있는 것을 나타낸 것이다. X의 몰분율(χX)은 ㈎의 용액에서 9/10이고, ㈏의 용액에서 1/4이다. PX와 PY는 각각 X(g)와 Y(g)의 부분 압력이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 온도는 25 ℃이고 용액은 이상 용액이며, 기체는 이상 기체이다. A, X, Y는 모두 비전해질이고 반응하지 않는다.)
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. ㈏의 용액에서 X의 몰분율이 1/4로 주어져 있고, A가 없이 나머지 Y의 몰분율이 3/4일 것이므로 마맞는 설명
ㄴ. ㈏에서 375 = PX + PY = 270 × 10/9 × 1/4 + PYº × 3/4. 따라서 PXº = 300 Torr, PYº = 400 Torr
ㄷ. ㈏에서 Y의 몰분율은 용액에서 3/4, 증기에서 300 / 375이므로 맞는 설명
7. 그림은 이온성 고체 CsCl, KCl, CuCl의 입방 단위 세포를 모형으로 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ①
ㄱ. 단순입방구조(simple-cubic, primitive-cubic) : 정육면체의 8개의 꼭짓점에 원자가 있음
ㄴ. 어떤 원자의 배위수 = 그 원자와 가장 가까운 (아무) 원자의 배위수
○ KCl에서의 Cl-의 배위수 = Cl-와 가장 가까운 원자의 수 = 6
○ CuCl에서의 Cl-의 배위수 = 4 (cf. 오른쪽 혹은 왼쪽 면에 있는 Cl-를 보면 배위수를 계산하기 쉬움)
ㄷ. 단위 세포당 원자의 개수 : 세포의 중심, 세포의 각 면, 세포의 각 꼭짓점은 각각 1, 1/2, 1/8의 가중치를 곱해줌
○ CsCl에서 Cl-의 개수 = 8 × 1/8 = 1
○ CuCl에서 Cl-의 개수 = 6 × 1/2 + 8 × 1/8 = 4
8. 다음은 C (s)와 CO2 (g)로부터 CO (g)가 생성되는 반응의 화학 반응식과 압력으로 정의된 평형 상수(Kp)를 나타낸 것이다.
C (s) + CO2 (g) ⇄ 2CO (g), Kp
표는 10 L 강철 용기에 C (s) 10 g과 CO2 (g) 22 g을 넣은 후, T1 K와 T2 K에서 각각 도달한 평형에 대한 자료이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 기체는 이상 기체이고, 고체의 부피와 증기압은 무시하며 제시된 반응 이외의 반응은 고려하지 않는다. C와 O의 원자량은 각각 12와 16이다.)
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. 기체의 질량이 반응 전 22 g에서 반응 후 25 g이 되었으므로, C (s)의 질량은 10 g에서 7 g으로 줆
ㄴ. T1 K에서,
○ C (s), CO2 (g)가 각각 0.25 mol 반응함
○ CO2 (g)가 0.5 mol에서 0.25 mol이 됨
○ CO (g)가 0 mol에서 0.5 mol이 됨
○ PCO2 = 0.25 RT1 / V = 1/2 PCO
○ ∴ Kp = a = PCO2 / PCO2 = 2 PCO
○ ∴ 전체 압력 = PCO + PCO2 = 3/2 PCO = 3a / 4
ㄷ. T2 K에서,
○ C (s)가 7 g에서 8.5 g으로 증가함
○ CO2 (g)가 0.25 mol에서 3/8 mol로 증가함
○ CO (g)가 0.5 mol에서 0.25 mol로 감소함
○ PCO2 = (3/8) RT2 / V = (3/2) PCO
○ ∴ Kp = 2a / 15 = PCO2 / PCO2 = (2/3) PCO
○ ∴ PCO = (1/4) RT2 / V = a / 5 = 2 × (0.5 RT1 / V) / 5
○ ∴ T2 / T1 = 4/5
9. 다음은 A (g)와 B (g)로부터 C (g)가 생성되는 반응의 화학 반응식과 온도 T에서 압력으로 정의된 평형 상수 (Kp)를 나타낸 것이다.
A (g) + B (g) ⇄ C (g), Kp = 0.8
그림은 온도 T에서 콕으로 분리된 강철 용기 Ⅰ과 Ⅱ 각각에서 A (g) ~ C (g)가 평형을 이룬 상태를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 온도는 T로 일정하고, RT = 25 atm·L/mol이다. 기체는 이상 기체이고 연결관의 부피는 무시한다.)
⑴ 문제

⑵ 풀이 : ②
ㄱ. Kp = 5 / x2 = 0.8로부터 x = 2.5임을 알 수 있음
ㄴ. Kp = Kc × (RT)1(생성물)-2(반응물) = Kc / 25. ∴ Kc = 20
ㄷ. 콕을 연 후
○ 20 = y / (0.2 × 0.4) ⇔ y = 1.6 mol
○ 반응 전 A (g)의 압력 = x + 0.2 × 25 = 7.5 atm
○ 반응 전 B (g)의 압력 = x + 0.4 × 25 = 12.5 atm
○ 반응 전 C (g)의 압력 = 5 + 40 = 45 atm
○ 부피, 온도가 일정할 때, 압력 ∝ 몰수이므로 압력은 반응계수의 덧셈 등이 성립
○ A (g)의 몰수가 0.6이고 압력이 15 atm인 경우, 반응계수 Q = (45 - 7.5) / ((7.5 + 7.5) × (12.5 + 7.5)) = 0.125 < 0.8이므로 역반응이 진행되어 A (g)의 몰수는 0.6보다 작음
10. 표는 300 K에서 X의 기화에 관련된 자료를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, ΔHº와 ΔSº는 온도에 무관하다.)
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. ΔGº = 3k = ΔHº - TΔSº = 30k - 300 × ΔSº. ∴ ΔSº = 90 J/K·mol
ㄴ. ΔG = ΔH - TΔS = ΔHº - TΔSº = 0으로부터 T = 1000 / 3 K을 얻을 수 있음
ㄷ. ΔG = 0 = ΔGº + RT ln K = 3k + 300 × 8.31 ln P ⇔ ln P = -10 / 8.31
11. 그림은 A (g) + B (g) ⇄ 2C (g) 반응의 표준 반응 엔탈피(ΔHº)와 표준 반응 엔트로피(ΔSº)를 온도 T에 따라 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ②
○ (주석) 개인적으로 ΔHº, ΔSº이 온도에 따라 변하는 문제를 거의 처음으로 보는 것 같음
ㄱ, ㄷ. 흡열 반응, 온도에 따라 평형 상수 증가
○ 온도가 증가할수록 TΔSº이 우상향 곡선을 그리는데 이는 A (g) + B (g)보다 2C (g)일 때 더 무질서하며 거기에 온도가 곱해졌기 때문. 따라서 모든 온도 구간에서 ΔSº > 0이라고 할 수 있음
○ 270 K에서 ΔHº > TΔSº > 0이므로 270K의 표준 상태에서 정반응은 흡열 반응 (ㄱ)
○ 풀이 1. 르 샤틀르에 원리를 적용 : 주어진 반응은 흡열반응이므로 온도 증가에 따라 평형상수가 증가함 (ㄷ)
○ 풀이 2. 반트호프 방정식(van't Hoff equation)에 따라 ln K는 온도가 증가함에 따라 증가함 (ㄷ)

○ 기본적으로 2C (g)가 더 무질서함
ㄴ. 전형적인 출제 패턴이 아님
○ 이상기체의 경우 : ΔH = ΔE + Δ(PV) = ΔE + (Δn)RT = ΔE
○ 실제기체의 경우 : A (g) + B (g)보다 2C (g)일 때 더 무질서하다는 것은 활동도 상으로 몰수가 더 많아지는 효과와 동등함. 이 때문에 ΔH = ΔE + Δ(PV) = ΔE + (Δn)RT > ΔE라고 할 수 있음
12. 다음은 A와 B로부터 C가 생성되는 반응의 화학 반응식과 속도 법칙 및 반응 메커니즘을 나타낸 것이고, 표는 일정한 온도에서 초기 반응 속도를 측정한 실험 Ⅰ과 Ⅱ에 대한 자료를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ②
ㄱ. D는 반응 전후로 보존되므로 촉매에 해당
ㄴ. K = [E]2[D] / [A][D] = [E]2 / [A] → v = k' [B][E]2 = k [A][B]이므로 ㈎ = 6 × 10-4
ㄷ. k × 0.1 × 0.1 = 1 × 10-4로부터 k = 1 × 10-2 M-1·s-1을 얻을 수 있음
13. 다음은 A와 B로부터 C와 D가 생성되는 반응의 화학 반응식과 속도 법칙을 나타낸 것이다.
A + B → C + D, 전체 반응 속도 = k[A]m[B]n
그림은 일정한 온도에서 B의 초기 농도([B]0)를 달리하여 진행한 실험 Ⅰ과 Ⅱ에서 반응 시간에 따른 1/[A]을 각각 나타낸 것이다. [B]0가 A의 초기 농도([A]0)보다 훨씬 크기 때문에 반응 과정에서 [B]의 변화는 무시할 수 있다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. 전형적인 2차 반응 곡선으로서 m = 2이며, 직선의 기울기(=k[B]n)가 [B]0에 1차 비례하므로 n = 1
ㄴ. Ⅰ에서 k × 20 = 600 / 30으로부터 k = 1 M-2·s-1을 얻을 수 있음
ㄷ. a에서 전체 반응 속도 = 1 × (1/500)2 × 10 = 4 × 10-5 M/s
14. 그림은 25 ℃에서 일양성자 염기 A와 B 각각의 수용액 800 mL를 HCl 0.20 M 수용액으로 적정할 때의 적정 곡선 ㈎와 ㈏를 나타낸 것이다. 당량점까지 가한 HCl의 부피는 A와 B에서 각각 20 mL, 40 mL이고, 적정 전 B 수용액의 pH는 9.0이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 25 ℃에서 물의 자체 이온화 상수(Kw)는 1 × 10-14이다.)
⑴ 문제

⑵ 풀이 : ③
ㄱ. B의 초기 농도 = 0.20 × 40 / 800 = 0.01 M. Kb,B = (10-5)2 / 0.01 = 10-8.
ㄴ. A의 반당량점에서의 pH = pKa,A = 8. 핸더슨-하셀바흐 식에 따라 a에서의 pH = pKa,A + log ([A] / [AH+]) = 8 + log ((20 - 5) / 5) = 8 + log 3
ㄷ. b에서 두 용액의 pH가 동일하므로, pKa,A + log([A] / [AH+]) = pKa,B + log([B] / [BH+]) ⇔ log[([AH+] / [A]) × ([B] / [BH+])] = 8 - 6 = 2이므로 맞는 설명
15. 그림은 25 ℃에서 1 × 10-4 M HA 수용액 1 L와 1 × 10-4 M HB 수용액 1 L로부터 각각 물이 증발할 때, 증발 후 남은 수용액의 부피에 따른 [A-] / [HA]와 [B-] / [HB]를 각각 나타낸 것이다. 25 ℃에서 산 해리 상수(Ka)는 HA가 HB의 4배이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, HA와 HB는 비휘발성이다.)
⑴ 문제

⑵ 풀이 : ⑤
ㄱ. 핸더슨-하셀바흐 식 : 산도가 클수록 해리되는 비율이 커지므로 위의 그래프가 HA, 아래의 그래프가 HB 수용액을 나타냄. pH = pKa + log ([짝염기] / [짝산])이고, [짝염기] / [짝산]이 동일한 상황에서 Ka,HA = Ka,HB × 4임을 이용하면 a에서가 b에서보다 pH가 log 4 낮고, [H+]가 4배 더 높음을 증명할 수 있음
ㄴ. Ka,HA = [H+][A-] / [HA] = [A-]2 / [HA] = ((3/8) × 10-4 / 0.45)2 / ((5/8) × 10-4 / 0.45) = 5 × 10-5
ㄷ. 5 × 10-5 = ((1/5) × 10-4 × 1000 / V)2 / ((4/5) × 10-4 × 1000 / V) = 5 × 10-3 / V → V = 100
16. 표는 25 ℃에서 0.1 M H2A 수용액 30 mL와 a M Na2A 수용액의 혼합 용액을 만들 때, Na2A 수용액의 부피에 따른 혼합 용액의 pH를 나타낸 것이다. H2A는 이양성자 산이고, 25 ℃에서 단계적 산 해리 상수 Ka1과 Ka2는 각각 1.0 × 10-4, 1.0 × 10-10이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ③
ㄱ. Na2A가 10 mL일 때 제1 반당량점에 도달하므로, H2A의 몰수 = 0.1 × 30 - a × 10 = HA-의 몰수 = 2 × 10 × a ⇔ a = 0.1
ㄴ. H2A 3 mmol + A2- 2 mmol의 경우, H2A 1 mmol + HA- 4 mmol와 pH가 동일하여 pH = x = 4.0 + log 4
ㄷ. H2A 3 mmol + A2- 0.1V mmol인 경우 제2 반당량점이므로, HA-의 몰수 = 6 mmol = A2-의 몰수 = (0.1V - 3) mmol ⇔ V = 90
17. 다음은 요소(H2NCONH2) 수용액으로 이산화 질소(NO2)를 분해시키는 단계적 과정에 대한 균형 반응식 ㈎와 ㈏를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, a ~ d는 10보다 작은 정수이다.)
⑴ 문제

⑵ 풀이 : ③
ㄱ. ㈎에서 산화수가 변하는 것은 없음
ㄴ. 반응물에서 산화∙환원하는 화학종이 3개이므로 brute-force 하게 푸는 게 권장됨
○ N의 계수 : a + b = 2c --- ⑴
○ H의 계수 : 3a = 2d --- ⑵
○ O의 계수 : 2b + 2 = d --- ⑶
○ a ~ d는 10보다 작은 정수
○ 변수가 4개이고, 식이 3개이므로 대수학적으로 해가 결정되지는 않고 정수론적으로 해가 결정됨
○ ⑵, ⑶에 의해 d는 3의 배수이고 짝수이므로 d = 6
○ a = 4, b = 2, c = 3이 곧바로 결정됨
○ 그러므로 요소 1몰당 2몰의 NH3가 생성되고, 2몰의 NH3당 NO2 1몰이 분해됨
ㄷ. 반응 계수가 a = 4, b = 2, c = 3, d = 6일 때 ㈏에서 이동하는 전자의 전체 몰수 × 2 = 4 × 3 (NH3-N의 산화수 변화량) + 2 × 4 (NO2-N의 산화수 변화량) + 1 × 4 (O2-O의 산화수 변화량) = 24이므로, NO2 1몰당 24 / 2 / 2 = 6몰의 전자가 이동하는 셈
18. 그림은 PbSO4이 입혀진 Pb 전극이 사용된 반쪽 전지 ㈎와 Pb 전극이 사용된 반쪽 전지 ㈏를 염다리로 연결한 갈바니 전지의 초기 상태를, 표는 온도 T에서 관련 반응의 표준 환원 전위를 나타낸 것이다. 산화 반응은 ㈎에서 일어나고, 전지의 초기 기전력은 0.21 V이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 온도는 T로 일정하고, ln 10 × RT / F는 0.060 V이다. R와 F는 각각 기체 상수, 패러데이 상수이다.)
⑴ 문제

⑵ 풀이 : ③
ㄱ. Nernst equation : 산화 반응은 ㈎에서 일어나므로, a < -0.12가 성립. 그러므로 0.21 = (-0.12 - a) - 0.060 / 2 × log (1.0 / 0.10) ⇔ a = -0.36
ㄴ. ΔG° = -nFΔE° = -RT ln (1 / Ksp) ⇔ ΔE° = 0.24 = -(RT / nF) ln Ksp = -(0.060 / 2) log Ksp ⇔ Ksp = 10-8
ㄷ. ㈏에 소량의 KI를 가하면, 침전이 생기면서 반응지수 Q = 1 / ([Pb2+][SO42-])가 커져서 기전력 E = E° - 0.060 / 2 × log Q가 감소
19. 표는 바닥 상태의 3가지 Ni 착물에 대한 자료를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 착물의 색은 Ni 3d 오비탈 사이의 전자 전이에 의한 것이다.)
⑴ 문제

⑵ 풀이 : ①
ㄱ. Ni(CN)42-의 중심금속 Ni(산화수 : +2)은 d 오비탈이 8개이고 이를 평면 사각형 전자 오비탈에 채우면 홀전자가 없음

ㄴ. Ni의 산화수는 Ni(CO)4에서 0, NI(NH3)62+에서 +2
ㄷ. 리간드 장 이론 : CN-가 더 강한 장 리간드
CO, CN- > NO2- > ONO- > en > NH3 > SCN- > H2O > OH- > F- > Cl- > Br- > I-
20. 다음은 NaOH 수용액을 표준화하는 실험이다. 이에 대한 설명으로 옳은 것은? (단, 온도는 25 ℃이다.)
⑴ 문제

⑵ 풀이 : ② → ①
① 맞는 설명
② 당량점은 몰수에만 관계하므로 과정 ㈐에서 부피를 첨가한들 일반적인 상황에서 가한 NaOH 수용액의 부피는 불변
③ ㉠은 무색, ㉡은 분홍색
④ 페놀프탈레인의 변색 pH 범위는 8.2 ~ 9.6
⑤ NaOH 수용액의 표준 농도 M × 0.02360 L = 0.450 g × 1 mol / 204.2 g
입력 : 2023.08.20 17:01
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【유기화학】 2022 PEET 유기화학 (0) | 2024.02.04 |
|---|---|
| 【유기화학】 2024 MEET/DEET 유기화학 (0) | 2023.08.13 |
| 【유기화학】 2023 PEET 유기화학 (11) | 2023.08.06 |
| 【화학】 2019 MEET/DEET 화학 (2) | 2023.03.16 |
| 【화학】 2021 MEET/DEET 화학 (4) | 2022.12.04 |




최근댓글