20강. 착물화학 (무기화학, 배위화학)
추천글 : 【화학】 화학 목차
1. 전이원소(transition metal) [목차]
⑴ 개요
① 정의 : 최외각 전자의 오비탈이 d 오비탈인 원소, 3족 ~ 12족, d block라고도 함
② 필수 암기 전이 원소 : 스티바크망철코니구아(Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn)
③ 주로 빈 d 오비탈이 많은 전이금속에서 배위결합이 발생함 (cf. 일반적인 화학결합)
⑵ 특징
① 산화수가 다양 (예외 : Zn은 산화수가 1개)
② 착이온을 잘 형성
⑶ d 오비탈의 종류 : 총 5종류 존재
ℓ = 2이기 때문에 모두 2개의 각마디를 가지고 있음
2. 착이온 [목차]
⑴ 착이온 : 금속 이온이 리간드와 결합하여 만들어진 이온

Mn+ : 중심금속
xL : 리간드(ligand)
MLxn+ : 착이온
① 배위수(coordination number) = 중심금속이 갖는 결합의 수 = 입체수 = 혼성에 참가하는 오비탈 개수
② 중심금속의 산화수 = 착물염의 전하 - 배위하는 리간드들의 전하 합
○ 중심금속의 산화수가 곧 착물염의 MO를 구성하는 전자수를 결정
③ 리간드의 미량, 과량
○ 리간드를 미량으로 넣으면 소량의 금속이온만 반응해도 착물형성 상수 식 만족
○ 리간드를 과량으로 넣으면 금속이온의 농도가 0이 되어야 착물형성 상수 식 만족
⑵ 형성상수 Kf : 착이온이 형성되는 반응의 평형 상수
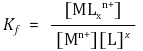
① 착화합물의 이온화 : 일반적으로 리간드는 수용액에서 이온화되지 않음 (∵ Kf ≫ 1)
② 크기 비교 : 중심금속과 리간드의 결합이 강할수록 형성상수가 큼
○ 형성상수의 차이는 주로 엔트로피 변화의 차이 때문
○ 킬레이트는 형성상수가 큼
○ 일반 리간드 < 에틸렌다이아민(en) < 디에틸렌트리아민(trien)
○ 결정장 갈라짐이 클수록 형성상수가 큼
○ 예외 : Zn2+의 경우 OH-의 형성상수가 NH3의 형성상수보다 큼
⑶ 킬레이트(킬레이터, chelator) : 여러 자리에 동시에 결합하는 리간드
① 주요 킬레이트
○ (주석) 아래에서 1 배위는 참고로 기술한 것으로 킬레이트 리간드가 아님
○ 1 배위 : H2O, CN-, SCN-(싸이오사이아네이트), X-(할로젠), NH3, NO2-(나이트라이트), OH- 등
○ 2 배위 : 옥살산(oxalic ion), 에틸렌다이아민(en), 에틸렌글리콜, acac, CO32- 등
○ 옥살산 : HO2CCO2H
○ 에틸렌다이아민 : H2NCH2CH2NH2
○ 에틸렌글리콜 : HO(CH2)2OH
○ acac : (CH3COCHCOCH3)-
○ (참고) m-phenylenediamine은 2 배위 킬레이트가 아님
○ 3 배위 : 다이에틸트라이아민(dien)
○ 6 배위 : 에틸렌다이아민테트라아세테이트(EDTA)
○ EDTA = (HOOCCH2)2NCH2CH2N(CH2COOH)2
② 킬레이트 효과
○ 정의 : 동등한 결합을 만드는 두 개의 착이온 형성 반응이 있을 때, 킬레이트 리간드가 포함되는 반응이 더 잘 일어남
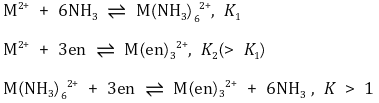
○ 1 배위 리간드가 금속 이온에 6 배위로 결합하는 경우 총 7개의 자유도가 1개로 줄어듦으로 엔트로피적으로 불리
○ 킬레이트 착이온 형성 반응은 착물 형성 시 필요한 리간드 수가 적으므로 엔트로피적으로 유리함
○ 킬레이트의 형성상수가 킬레이트가 아닌 리간드의 형성상수보다 큼
⑷ 혼성오비탈
① 혼성오비탈을 알기 전 중심금속의 오비탈 전자배치를 알아야 함
○ 주의사항 : Aufbau 쌓음원리에 따르면, 4s 오비탈이 3d 오비탈보다 더 낮아 4s 오비탈에 먼저 전자가 채워지지만, 오비탈이 형성되면 3d 오비탈이 4s 오비탈보다 더 낮아 4s 오비탈부터 전자가 빠져나옴
○ 예 : Fe의 전자배치는 1s22s22p63s23p64s23d6이고, Fe2+의 전자배치는 1s22s22p63s23p63d6임
○ 문제상황에서 중심금속의 산화수를 반드시 파악해야 하는 이유
② 2배위
○ sp 혼성 : 선형. [Ag(NH3)2]+ 등
③ 4배위
○ sp3 혼성 : 사면체. [Zn(NH3)4]2+ 등
○ dsp2 혼성 : 평면 사각형. [Ni(CN)4]2-, [Pt(NH3)4]2+ 등 주로 d8 착물
④ 6배위
○ sp3d2 (d2sp3) 혼성 : 팔면체. XeF4, [Co(NH3)6]3+, [PtCl6]2- 등
○ 참고로, s, p의 주양자수가 n이라고 가정할 때 다음과 같음 (ref)
○ d2sp3 : 착물이 (n-1)번째 d 오비탈 전자를 사용할 때
○ sp3d2 : 착물이 n번째 d 오비탈 전자를 사용할 때
⑸ 이성질체 (coordination isomer) : 같은 화학식을 갖지만 원자배열이 다른 화합물
① 구조이성질체 : 원자 사이 서로 다른 결합을 하는 화합물
○ 결합이성질체 : 서로 다른 금속-리간드 결합을 가지는 이성질체
○ 이온화이성질체 : 용액 중에서 서로 다른 이온으로 되는 이성질체
② 입체이성질체 : 원자들이 동일하게 결합하지만 공간 배열이 다른 화합물
○ 종류 1. 기하이성질체 : cis/trans 이성질체, fac/mer 이성질체 등
○ 종류 1-1. cis/trans 이성질체 : 두 치환기가 같은 방향이면 cis, 반대 방향이면 trans
○ 종류 1-2. fac/mer 이성질체
○ fac 이성질체 : 특정 세 치환기가 모두 직교하는 경우
○ (주석) fac은 'facial'에서 온 말로 세 치환기가 모두 직교하는 경우 세 치환기가 놓이는 한 평면을 상상할 수 있음
○ mer 이성질체 : 세 치환기 중 한 쌍의 치환기가 마주보는 경우
○ (주석) mer는 'meridional'에서 온 말로 한 쌍의 마주보는 치환기가 자오선을 형성함
○ 종류 2. 광학이성질체 (거울상이성질체)
○ 예 1. FeCl3(H2O)3 (ferric chloride)는 fac/mer 이성질체가 존재함. 분자 내 대칭면이 있으므로 광학이성질체는 없음
Figure. 2. FeCl3(H2O)3의 입체 이성질체
○ 예 2. [CoBr4Cl2]3-는 2개의 입체 이성질체를 가짐 : 각 구조는 거울상을 가지지 않음

Figure. 3. [CoBr4Cl2]3-의 입체 이성질체
○ 예 3. [Co(bipy)Br2Cl2]-는 4개의 입체 이성질체를 가지며, 이 중 한 쌍은 거울상 이성질체

Figure. 4. [Co(bipy)Br2Cl2]-의 입체 이성질체
○ 예 4. Co(en)2Cl2+는 거울상 관계에 있는 두 개의 cis-Co(en)2Cl2+와 한 개의 trans-Co(en)2Cl2+가 존재함
Figure. 5. Co(en)2Cl2+의 입체 이성질체
○ 예 5. Co(en)2BrCl+는 거울상 관계에 있는 두 개의 cis-Co(en)2BrCl+와 한 개의 trans-Co(en)2BrCl+가 존재함
○ (주석) 천천히 돌려보면 알 수 있음 (참고 : 입체구조와 벡터의 외적)
Figure. 6. Co(en)2BrCl+의 입체 이성질체
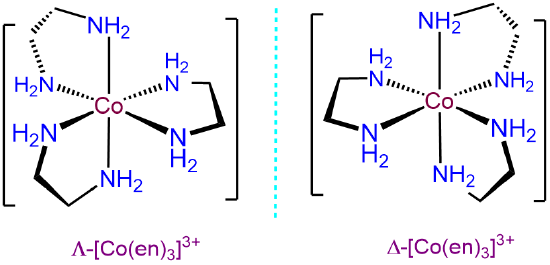
○ 예 6. [Co(en)3]3+과 같이 대칭성 리간드가 3개 붙어 있는 경우 거울상 이성질체가 존재함 : 입체이성질체는 총 2개
○ Λ-형 : 좌회전성, (-)
○ Δ-형 : 우회전성, (+)
Figure. 7. [Co(en)3]3+의 입체 이성질체
○ 예 7. [Co((R)-pn)3]3+은 Λ-fac, Δ-fac, Λ-mer, Δ-mer 등 총 네 종류의 이성질체가 존재함
Figure. 8. [Co((R)-pn)3]3+의 입체 이성질체
○ 예 8. 2자리(N 말단, O 말단) 킬레이트 gly를 갖는 [Fe(gly)3]3-는 예 7.처럼 총 네 종류의 이성질체가 존재함
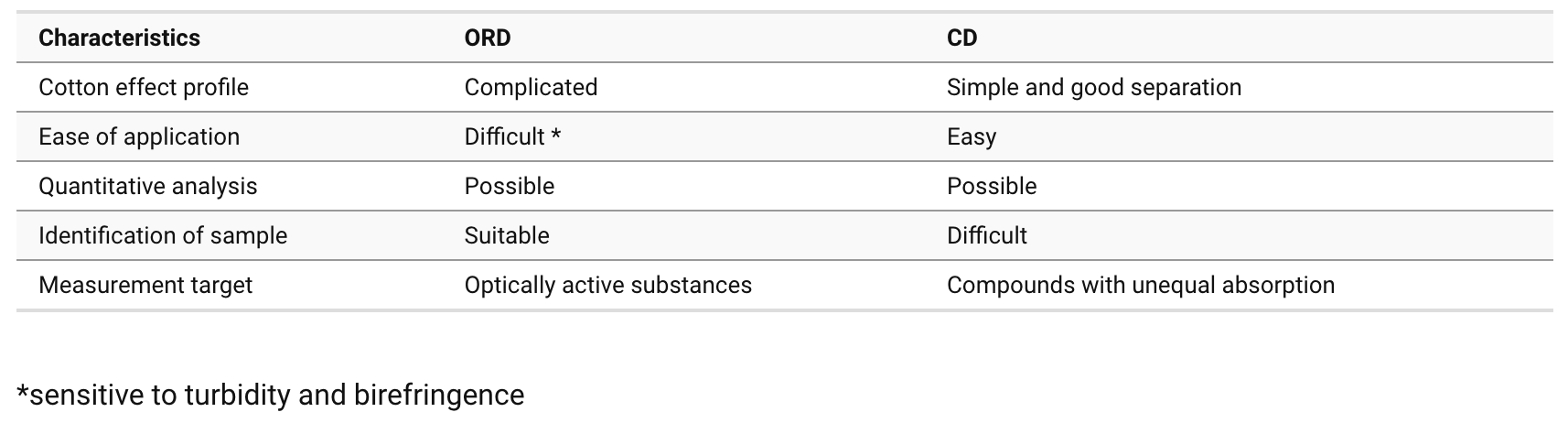
③ 입체배열의 실험적 결정 : CD(circular dichroism spectroscopy), ORD(optical rotary dispersion)를 사용
○ CD/ORD의 특징
Table. 1. CD/ORD의 특징
○ Cotton effect : UV 스펙트럼 범위에서 ORD 스펙트럼과 CD의 피크가 관찰됨
○ 정보 1. sign (±) : CD (+), ORD (long-wavelength maximum)
○ 정보 2. magnitude : CD peak value, ORD peak, valley amplitude
○ 정보 3. position : CD peak wavelength = ORD inflection point
○ 응용 1. 우회전성, 좌회전성 판단
○ 입체화학에서 우회전성이면 (+), 좌회전성이면 (-)로 표시
○ CD가 양의 피크를 가지면 (+), 음의 피크를 가지면 (-) 배향
○ ORD의 최댓값이 변곡점보다 파장이 큰 영역에서 형성돼 있으면 (+), 그렇지 않으면 (-) 배향
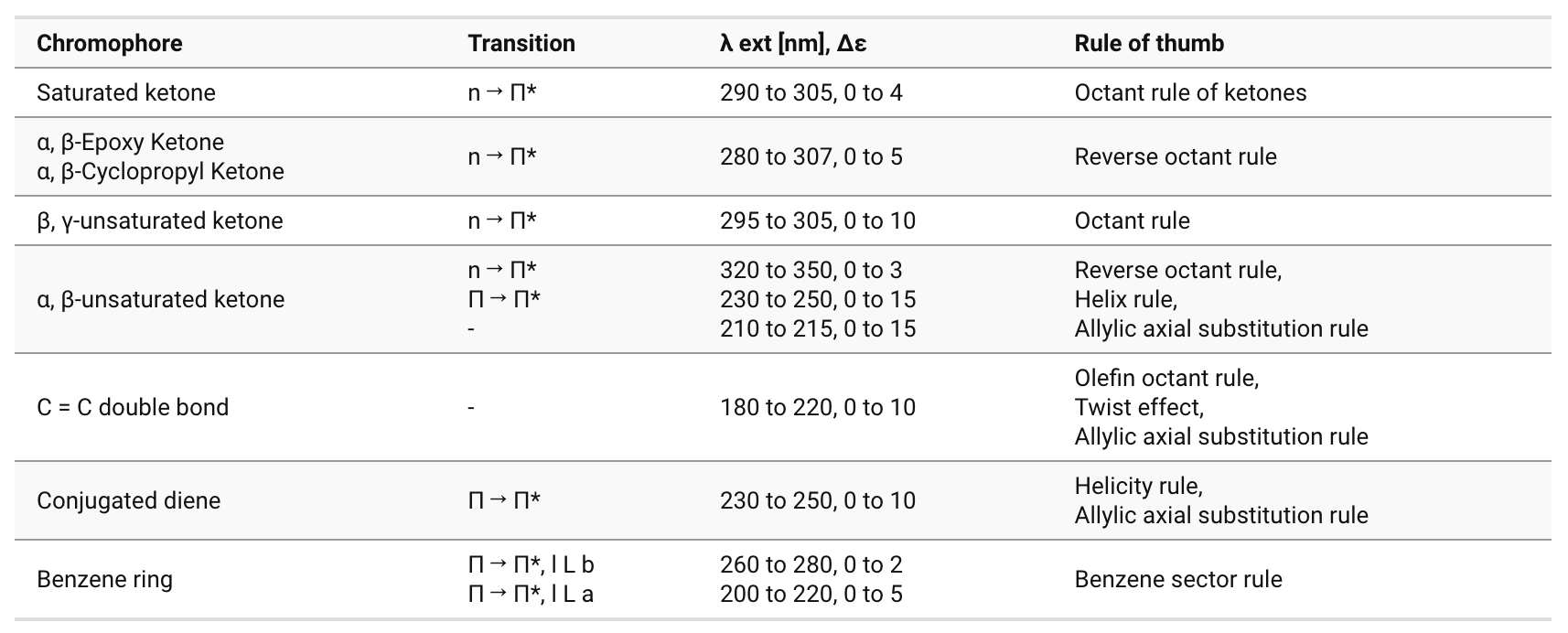
○ 응용 2. 작용기별 Cotton effect
Table. 2. 작용기별 Cotton effect
3. 결정장 이론(수정장 이론, CFT, crystal field theory) [목차]
⑴ 정의 : 착이온을 형성하는 중심금속이온의 d 오비탈 에너지 변화를 통해 착이온의 색과 자기적 성질을 설명하는 이론
⑵ 결정장 갈라짐
① 정의 : 리간드의 비공유 전자쌍이 중심금속 이온의 d 오비탈 전자와 반발하면서 d 오비탈 에너지준위가 크게 높아지고, d 오비탈 전자들과 리간드와의 거리에 따라 다른 반발력을 나타내면서 d 오비탈이 갈라지는 것
② 반발이 클수록 더 불안정하므로 더 높은 에너지 준위를 가짐
⑶ 구조에 따른 결정장 갈라짐
① 개요
○ 결정장 갈라짐은 d 오비탈 전자배치에 영향을 줌
○ d 오비탈은 상자성 / 반자성 판단에서 중요하므로 구조에 따른 결정장 갈라짐을 잘 이해해야 함
② 가정
○ 금속 - 리간드 결합을 완전한 이온결합으로 간주
○ 리간드가 접근하는 방향이 오비탈과 겹쳐 반발의 세기가 세질수록 d 오비탈의 에너지 준위가 높아짐
③ 팔면체 구조
○ 리간드가 x, y, z축 방향에서 접근
○ 리간드의 음전하는 축 방향에서 전자가 발견될 확률이 높은 dz2과 dx2-y2 오비탈과 더 크게 반발
○ 비교 : dz2 = dx2-y2 > dxy = dyz = dxz (필수암기)
○ 암기 팁. 진분수 같은 느낌
○ Jahn-Teller effect : CrF2 결정에서 Cr 주변의 6개의 Cr-F 배위결합은 2개의 긴 결합과 4개의 짧은 결합으로 구성
④ 사면체 구조
○ 리간드가 x, y, z축 사이 공간으로 접근
○ 리간드의 음전하는 dxy, dyz, dxz 오비탈과 더 크게 반발
○ 비교 : dxy = dyz = dxz > dz2 = dx2-y2 (필수암기)
○ 암기 팁. 가분수 같은 느낌
⑤ 사각형 구조
○ 예 : 시스플라틴 (cis-Pt(NH3)2Cl2)
○ 리간드가 x, y축 방향에서 접근
○ 리간드의 음전하는 x, y 축에서 높은 전하 밀도를 갖는 dx2-y2 오비탈과 가장 크게 반발
○ 비교 : dx2-y2 > dxy > dz2 > dxz = dyz (필수암기)
○ dxz, dyz가 dz2보다 낮은 에너지 준위임을 주의
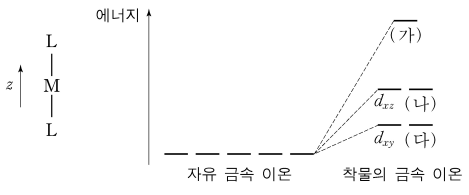
⑥ 직선형 구조
○ 예 : I3-
○ 리간드가 z축 방향에서 접근할수록 반발이 커져 에너지 준위가 높아짐
○ 비교 : dz2 > dxz = dyz > dxy = dx2-y2
○ (주석) dxz와 dyz는 항상 같이 붙어 있음
Figure. 12. 직선형 구조를 갖는 ML2 착물의 중심 금속 이온 M의 d 오비탈 에너지 갈라짐
㈎ : dz2, ㈏ : dyz, ㈐ : dx2-y2
⑷ 결정장 갈라짐의 크기
① 원리
○ 중심금속이 리간드와 강하게 결합할수록 리간드의 전자가 중심금속으로 모여 결정장 갈라짐 크기 증가
○ 결정장 갈라짐이 클수록 형성상수 증가
○ 결정장 갈라짐이 클수록 중심금속이 환원될 경향이 작아져서 산화제 강도가 약해짐
② 요인 1. 리간드장 이론(ligand-field theory; LFT)
○ 리간드마다 중심금속과 결합하는 정도가 달라 결정장 갈라짐의 크기가 다름
○ 결정장 이론과의 차이점
○ 결정장 이론은 금속-리간드 상호작용을 정전기적 인력으로 이해함
○ 리간드장 이론은 금속-리간드 상호작용을 공유 결합으로 간주함
○ 결정장 이론은 d 오비탈 준위의 높이가 리간드의 종류에 따라 일정하다고 간주
○ 리간드장 이론은 d 오비탈 준위의 높이가 리간드의 종류에 따라 변한다고 간주
○ 비교
CO, CN- > NO2- > ONO- > en > NH3 > SCN- > H2O > OH- > F- > Cl- > Br- > I-
○ 할로젠 음이온은 주기가 작아질수록 반지름이 작아져 전자 반발이 커지므로 결정장 갈라짐이 커짐
○ 첫 네 개(C, N, E, N)은 필수 암기
○ 센 장 리간드, 약한 장 리간드
○ 반례 : Zn2+이 중심금속인 경우 OH-의 형성상수가 NH3보다 큼
③ 요인 2. 중심금속 전하 : 중심금속 전하가 클수록 전자가 핵으로 끌어당겨져 반발이 커지므로 결정장 갈라짐이 커짐
○ 중심금속의 산화수가 클수록 결정장 갈라짐이 커짐 → 흡수파장이 짧아짐
○ 예외 : CuCl2는 푸른색이지만 CuCl은 d 오비탈에 전자가 가득 차 있어 모든 빛을 반사(하얀색)
④ 요인 3. 혼성오비탈 구조 : 팔면체 구조가 사면체 구조보다 전자 반발이 많으므로 결정장 갈라짐이 큼
○ 리간드장 이론이 적용되지 않음 : 거의 항상 팔면체가 사면체보다 결정장 갈라짐이 큼
○ 팔면체 구조는 에너지가 큰 짧은 파장(가시광선, 자외선)을 흡수
○ 사면체 구조는 에너지가 작은 비교적 긴 파장을 흡수
○ 사각평면 구조가 가장 짧은 파장을 흡수함 (ref)
⑤ 결정장 안정화 에너지(결정장 갈라짐 에너지, CFSE, crystal field splitting energy) : 쿨롱에너지만 고려
○ 정의 : 착화합물에서 리간드에 의해 형성된 결정장에 금속 이온(구형 장)이 놓여 있을 때 안정화되는 에너지
○ Δ 또는 Δo로 표시
○ 정팔면체 구조에서 다음과 같이 나타남
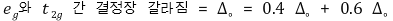

⑥ 짝지음 에너지(pairing energy, P) : 쿨롱에너지와 전자 교환에너지를 모두 고려
⑸ 결정장 갈라짐에 따른 sp3d2 오비탈의 구분
① sp3d2 오비탈은 전자 반발에 따른 결정장 갈라짐의 크기(Δ)에 따라 저스핀과 고스핀으로 구분됨
② 고스핀(high spin) : 스핀 양자수가 큰 전자배치
○ dx2-y2, dz2 오비탈과 dxy, dyz, dxz 오비탈과 차이가 작아 훈트 규칙처럼 스핀합이 최대가 되도록 배치됨
○ 상황 : P > Δ인 경우. 약한 장 리간드에 해당
○ eg와 t2g의 차이가 비슷하기 때문에 모두 동일한 에너지 준위로 간주하고 홀전자가 가장 많게 전자 배치
○ 고스핀에서도 에너지 준위차가 있으므로 dx2-y2, dz2 오비탈에 가장 마지막으로 전자가 배치
③ 저스핀(low spin) : 스핀 양자수가 작은 전자배치
○ dx2-y2, dz2 오비탈과 dxy, dyz, dxz 오비탈과 차이가 많아 고스핀보다 스핀합이 적어짐
○ 상황 : P < Δ인 경우. 센 장 리간드에 해당
○ eg > t2g가 분명하기 때문에 t2g부터 전자 배치를 함
④ 기타
○ K2[MnCl4]는 사면체 구조이고 high spin이기 때문에 홀전자의 개수는 5개임
⑹ 착물의 색
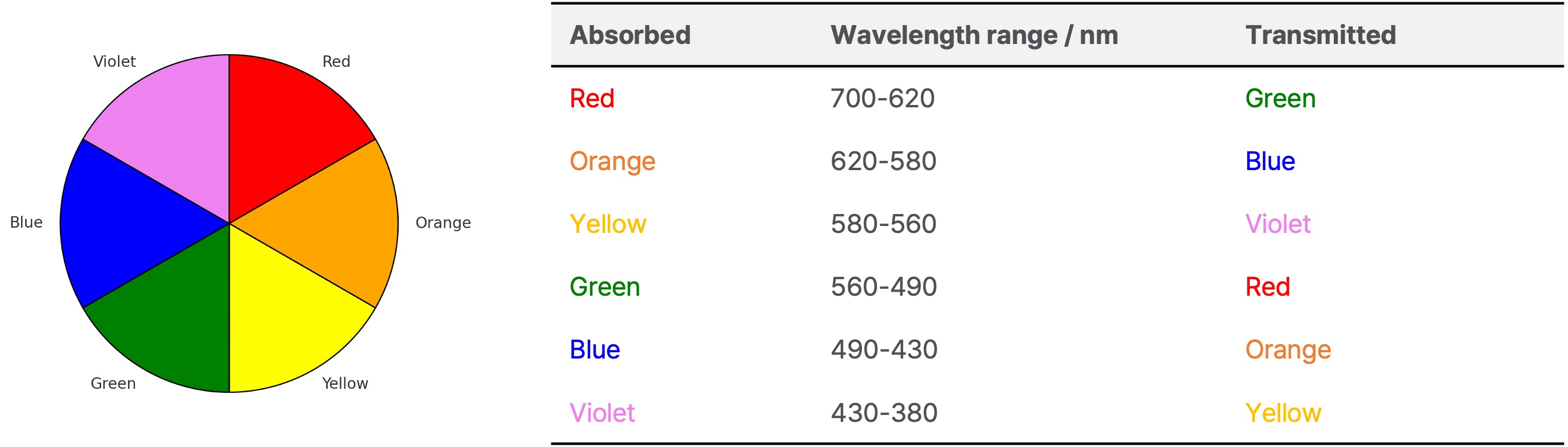
① 결정장 갈라짐(Δ)이 클수록 착물의 최대 흡수 파장(λmax)이 짧아짐
② 용액의 색은 흡수하고 남은 빛의 색깔로 나타나므로, 보색이 관찰됨
○ 흡수 파장이 크면 그의 보색인 파랑과 가까운 색이 관찰됨
○ 흡수파장이 작으면 그의 보색인 빨강과 가까운 색이 관찰
○ 갈라짐이 커짐 → 흡수 파장이 작아짐 → 보색은 색상표를 통해 판단할 것
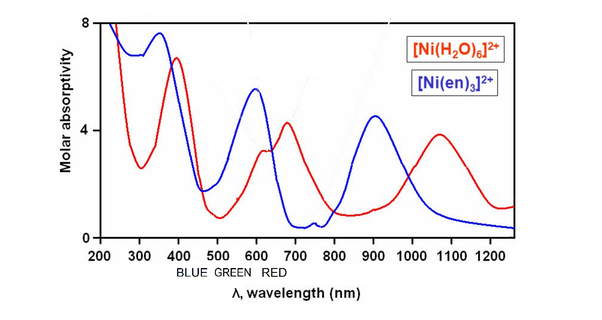
③ Ni(H2O)62+와 Ni(en)32+와 같이 단순히 보색의 원리를 따르지 않는 경우도 있음
Figure. 14. Ni(H2O)62+와 Ni(en)32+의 흡광도
○ Ni(H2O)62+ : 초록색으로 관찰됨
○ Ni(en)32+ : 파란색으로 관찰됨
○ 예상 : 결정장 갈라짐 ↑ (en > H2O) → 흡수 파장 ↓ (en < H2O) → 관찰 파장 ↑ (en > H2O)
○ 실제 : Ni(en)32+의 관찰파장이 Ni(H2O)62+의 관찰파장보다 짧음
○ 이유 : 1개의 피크만 있거나 다른 피크가 가시광선을 침범하지 않는 경우 위 예상이 들어맞음
○ 즉, Ni 착화합물의 경우 다른 피크가 가시광선을 침범하게 됨
○ Ni(H2O)62+의 실제 흡광도 : 다른 피크가 400 nm도 흡수하여 흡수하지 않은 중간 500 nm 정도의 색이 관찰
○ Ni(en)32+의 실제 흡광도 : 다른 피크가 비교적 덜 간섭하여 보색의 원리에 따라 450 nm 정도의 색이 관찰
⑺ 착물의 자성
① 원리 : 홀전자가 있으면 상자성이고, 홀전자가 없으면 반자성
○ 예 : d0와 d10 착물은 항상 반자성을 띰
○ 이유 : 기본적으로 홀전자가 있을 수 없기 때문이고, 더 근본적으로는 t2g → eg 전자 전이가 불가능하기 때문
② 4배위 차물
○ 사면체 : 상자성
○ 사각형(d8) : 반자성
③ 6배위 착물
○ d6 착물 + 저스핀 : 반자성
○ d6 착물 + 고스핀 : 상자성
○ 기타 : 상자성
입력: 2019.01.02 19:42
수정: 2023.06.03 20:49
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 22강. 핵화학 (3) | 2019.01.08 |
|---|---|
| 【화학】 14-1강. 산소요구량 (0) | 2019.01.04 |
| 【화학】 19강. 용해도와 착이온 평형 (0) | 2018.12.27 |
| 【화학】 18강. 산·염기 반응 (16) | 2018.12.27 |
| 【화학】 17강. 화학평형 (3) | 2018.12.27 |




![[Co((R)-pn)3]3+의 입체 이성질체](https://t1.daumcdn.net/cfile/tistory/996D96485E6ADDFE21)







최근댓글