4강. 입체화학(stereochemistry)
추천글 : 【유기화학】 유기화학 목차
1. 이성질체 [본문]
2. EZ 명명법 [본문]
3. 거울상 이성질체 [본문]
4. 광학활성 [본문]
5. 메조 화합물과 라세미 혼합물 [본문]
6. 착물 이성질체 [본문]
7. Bürgi–Dunitz trajectory [본문]
b. 이성질체 예제
1. 이성질체 [목차]
⑴ 정의 : 분자식은 같으나 다른 화합물을 총칭
① 형태(conformation) : 단일 결합이 회전을 함으로써 생길 수 있는 모양. 그런 화합물을 형태체(conformer)라고 함
② 배위(configuration) : 공간적 배열이 서로 달라서 생기는 모양, 그런 화합물을 입체 이성질체라고 함
⑵ 구조이성질체(structural isomer)
① 정의 : 원자의 결합순서가 다른 이성질체
○ 공명 관계에 있더라도 원자들의 배열이 달라지면 구조 이성질체가 될 수 있음
② regioisomer : 한 반응에서 생긴 구조이성질체
○ 그렇게 생성된 구조이성질체를 위치선택적(regioselective) 생성물이라고 함
③ 알케인의 구조이성질체
○ 탄소수에 따른 알케인의 구조이성질체의 수 : 탄소가 1개씩 증가할 때마다 구조이성질체의 수가 대략 2.36배씩 증가
| 화학식 | 구조이성질체의 수 |
| C3H8 | 1 |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
| C11H24 | 159 |
| C12H26 | 355 |
| C13H28 | 802 |
| C14H30 | 1,858 |
| C15H32 | 4,347 |
| C16H34 | 10,359 |
| C17H36 | 24,894 |
| C18H38 | 60,523 |
| C19H40 | 148,284 |
| C20H42 | 366,319 |
| C30H62 | 4,111,846,763 |
| C40H82 | 62,481,801,147,341 |
Table. 1. 탄소수에 따른 알케인의 구조이성질체의 수
○ 팁. 주사슬의 탄소수에 따라 경우를 분리함
○ butane : 2개. n-butane, isobutane. nonisomorphic trees with 4 vertices
Figure. 1. butane의 구조이성질체
○ pentane : 3개. n-pentane, isopentane, neopentane. nonisomorphic trees with 5 vertices
Figure. 2. pentane의 구조이성질체
○ hexane : 5개. nonisomorphic trees with 6 vertices
Figure. 3. hexane의 구조이성질체
○ heptane : 9개. nonisomorphic trees with 7 vertices
Figure. 4. heptane의 구조이성질체
○ octane : 18개. nonisomorphic trees with 8 vertices
Figure. 5. octane의 구조이성질체
○ 파이썬으로 탄소수에 따른 알케인의 구조이성질체 모두 그리기
④ 중수소 D와 수소 H는 다른 물질로 취급해야 함 → 구조이성질체 아님
⑶ 입체이성질체(stereoisomer)
① 정의 : 원자의 결합순서는 동일하나 입체배열이 차이나는 이성질체
○ 그렇게 생성된 입체이성질체를 입체선택적(stereoselective) 생성물이라고 함
② 종류 1. 거울상이성질체(광학이성질체, enantiomorph) : 자신의 거울상과 겹치지 않는 입체이성질체
③ 종류 2. 부분입체이성질체(diastereomers) : 거울상이성질체를 제외한 모든 입체이성질체
④ 종류 2-1. 기하이성질체(geometrical isomer) : 부분입체이성질체 중 입체적인 배열이 다른 이성질체
○ 종류
○ cis-이성질체 : 두 치환기가 같은 방향인 경우 (예 : cis-1,3-dimethylcyclobutane)
○ trans-이성질체 : 두 치환기가 다른 방향인 경우 (예 : trans-1-bromo-3-ethylcyclopentane)
○ 유형 1. 이중결합에 의한 위치 고정
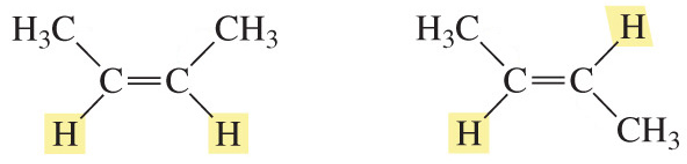
Figure. 6. 이중결합에 의한 위치 고정
○ 유형 2. 회전 입체장애에 의한 위치 고정
○ 단일결합이더라도 회전이 불가능할 수 있음
○ cycloalkane의 치환기 두 개가 서로 다른 탄소에 결합되어 있는 경우 기하이성질체가 생길 수 있음

Figure. 7. 회전 입체장애에 의한 위치 고정
○ 유형 3. 옥텟 규칙의 확장을 하는 중심원자는 쉽게 기하이성질체를 만들 수 있음
○ 이 경우에도 cis, trans 정의 가능
○ 예 : Pt(NH3)2Cl2, Pt(NH3)3Cl3, PCl2Br3
⑤ 종류 2-2. 에피머, 아노머
○ 에피머(epimer)
○ 복수의 카이랄 중심이 있는 이성질체에서 1개만 입체구조가 다를 때
○ 단당류, 이당류에 사용
○ 아노머(anomer)
○ 에피머 중 아세탈(acetal) 또는 헤미아세탈(hemiacetal) 탄소의 절대배열이 다른 것
○ 단당류, 이당류에 사용
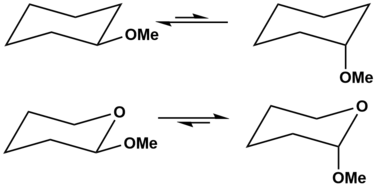
○ 아노머 효과(anomeric effect, Edward-Lemieux effect) : cyclohexane 내 heteroatom 옆에 붙어 있는 치환기가 axial 배향을 선호하는 현상
Figure. 8. 아노머 효과
⑷ 광학분할
① 구조이성질체 및 부분입체이성질체는 물리·화학적 성질이 달라 분리 가능
② 거울상이성질체는 모든 물리·화학적 성질이 같으나 평면 편광의 회전 방향이 정반대
③ 광학분할(optical resolution) : 거울상이성질체를 분리하기 위해서는 특수한 방법이 요구됨
2. EZ 명명법 [목차]
⑴ 우선순위 규칙(CIP rule, Cahn-Ingold-Prelog priority rule)
① 규칙 1. 각 탄소와 직접 결합한 원자들의 원자번호가 클수록 우선순위가 높음
② 규칙 2. 두 원자가 동일한 원자번호를 가질 경우, 해당 원자에 연결된 다음 치환기의 원자번호가 클수록 우선순위가 높음
○ 다중결합이 없다면 총 3개의 2-layer 원자들이 있으므로 하나라도 더 원자번호가 큰 게 우선순위가 높음
③ 규칙 3. 2-layer 원자들로 비교할 수 없는 경우 3-layer 원자, 4-layer 원자, ···로 최초로 차이가 날 때까지 비교
○ n-layer 원자들을 모두 비교한 뒤에 (n+1)-layer로 넘어갈 수 있음
④ 규칙 4. 비공유전자쌍은 우선순위가 가장 낮은 것으로 간주
⑤ 규칙 5. 다중결합의 경우, 모두 단일결합으로 바꾼 뒤 결합에 참가하는 각각의 원자가 추가적으로 상대방 원자를 치환기로 가지는 것처럼 간주
Figure. 9. 다중결합 우선순위 규칙
⑵ EZ 명명법
① 도입 이유 : cis / trans 명명법은 알켄에 오직 두 종류의 치환기가 두 개씩 있을 때만 명명 가능
② Z 이성질체 : 우선순위가 높은 게 cis로 위치하는 경우, 함께라는 뜻의 그리스어인 'zusammen'가 어원
③ E 이성질체 : 우선순위가 높은 게 trans로 위치하는 경우, 반대라는 뜻의 그리스어인 'entgegen'가 어원
④ 이민(imine)도 (E), (Z)를 판단할 수 있으며, 비공유 전자쌍은 가장 낮은 우선순위로 판단
⑶ Re, Si 명명법
① sp2 혼성 탄소에 결합되어 있는 세 치환기의 우선순위를 정하고 시작
② Re면(Re-face) : 세 치환기의 우선순위 방향이 시계 방향으로 돌아가는 면
③ Si면(Si-face) : 세 치환기의 우선순위 방향이 반시계 방향으로 돌아가는 면
3. 거울상 이성질체 [목차]
⑴ RS 명명법 : 거울상이성질체를 구별하기 위한 판별법. (참고) 유기화학에서 지겹도록 풀어야 할 문제
① RS 명명법은 절대배위 명명법
○ 절대배열(absolute configuration)
○ 상대배열(relative configuration) : 절대배열을 모를지라도 서로 같은 배위인지 아닌지를 지칭하는 실험상의 관계
② 기본 원리
○ 우선순위 규칙은 EZ 이성질체와 동일
○ 4번 원자를 지면 뒤쪽에 둔 상태에서 1, 2, 3번 원자가 돌아가는 방향이 시계 방향이면 R, 반시계 방향이면 S
○ R 이성질체 : 시계방향이라는 의미의 'rectus'가 어원
○ S 이성질체 : 반시계방향이라는 의미의 'sinister'가 어원
③ 필자의 제안 원리 : RS 판단은 0.5초 안에 이뤄져야 한다.
○ CIP 우선순위 순서에 따라 각 탄소 주위로 1, 2, 3, 4번 벡터를 명명
○ 공식 1. "1번 벡터 × 4번 벡터 = 2번 벡터"라면 S
Figure. 11. 공식 1을 활용한 RS 판단법
외적 방향이 3번인 경우 R
○ 공식 2. "1번 벡터 × 2번 벡터 = 3번 벡터"라면 S
○ 공식 3. "3번 벡터 × 4번 벡터 = 1번 벡터"라면 S : 메틸기가 3번, 수소가 4번인 경우가 많음
○ 공식 1 설명 : 중심탄소를 원점으로 보고 1번 원자(즉, 우선순위가 가장 높은 원자)의 위치벡터와 4번 원자(즉, 우선순위가 가장 낮은 원자)의 위치벡터의 외적 방향이 2번 원자(즉, 우선순위가 2번째로 높은 원자)인 경우 절대배열은 S
○ (주석) 스페셜하니까 S인 것으로 외우자.
○ (주석) 외적은 피연산 벡터들과 직교하는 벡터를 출력하므로 정사면체 배향상으로는 외적 연산이 100%로 들어맞지 않음을 유의
⑵ 카이랄 분자
① 카이랄(chiral) : 거울상이성질체를 가질 수 있는 분자
○ 카이랄의 어원은 '손'
○ 비카이랄(achiral) : 카이랄의 반의어
Figure. 12. 카이랄 분자의 예
② 분자 내 대칭면(거울면, plane of symmetry) : 분자 내 대칭면이 존재하지 않으면 카이랄 분자, 부정도 성립
③ 거울면의 유일성 : 어떻게 거울면을 잡아도 뒤집히는 분자는 결국 하나로 결정됨
④ 예시 : 카이랄 의약이 60% 정도 시판되고 있음
○ (R)-Limonene은 오렌지향 ↔︎ (S)-Limonene은 레몬향
○ (S)-Asp-(S)-pheOMe은 매우 달아 코카콜라에 쓰임 ↔︎ (R)-Asp-(R)-pheOMe은 매우 씀
○ (S)-Thalidomide는 입덧 치료제 ↔︎ (R)-Thalidomide는 기형 유발제
○ (S)-Ketamine는 마취제 ↔︎ (R)-Ketamine는 환각제
○ (S)-Penicillamine는 관절염 치료제 ↔︎ (R)-Penicillamine은 돌연변이 유발제
⑶ 입체중심(stereogenic center) : 어느 원자에 결합된 두 치환기를 교환시 입체이성질체가 될 때의 중심 원자
① 카이랄 중심(chiral center) : 어느 원자에 결합된 두 치환기를 교환시 거울상이성질체가 될 때의 중심 원자
○ 원칙 : 반드시 서로 다른 치환기를 가지는 중심 원자 (예 : C, N, O, P, S, Si)
○ 카이랄 중심은 기본적으로 sp3
○ 비공유 전자쌍도 치환기로 간주
② 카이랄 중심은 카이랄성을 만들 수 있지만 항상 카이랄 화합물인 것은 아님
○ 예 : 메조화합물, 아민 반전 등
③ 입체중심은 카이랄 중심과 기하이성질체 중심 등을 지칭
⑷ 카이랄 판단 기준
① 입체중심 0개 : 비카이랄 (예외 : ⑹)
② 입체중심 1개 : 카이랄
③ 입체중심 2개 이상 : 분자 내 대칭면으로 카이랄 판단
⑸ 헤테로 원소의 카이랄성
① 자연계에 존재하는 노이즈 : 80 kJ / mol
② 아민의 질소반전(nitrogen inversion) : 25 kJ / mol
○ 이차, 삼차 아민의 경우 비공유 전자쌍까지 포함하여 카이랄 중심처럼 분석할 수 있음
○ 질소 반전이 상온에서 매우 쉽게 일어나 카이랄성을 가지지 못함
○ 비틀림 스트레인, 각 스트레인 등에 의해 질소 반전의 에너지 차이가 커지면 카이랄성이 생김
Figure. 13. 질소 반전
○ 반례 1. 1,2,2-trimethylaziridine (18.5 kcal / mol)
○ 이 경우 광학 활성을 가짐
○ 이유 : cyclopropane의 고리 스트레인에 의한 에너지의 불안정도가 크기 때문
○ 3각 고리 외에 4각 고리, 5각 고리 이상의 헤테로고리 아민 화합물에서는 질소 반전이 일어남
○ 반례 2. 암모늄 이온은 상온에서 질소반전을 일으키지 못함 (ref)
③ 설폭사이드, 설포늄, 포스핀, 포스핀 옥사이드
○ P=O, S=O 등에서 전자를 P+-O-, S+-O-와 같이 만든 뒤 생각
○ 에너지 장벽이 커 카이랄성이 생김
⑹ 카이랄 중심이 없는 화합물의 카이랄성
① 알렌(allen)
○ 예 : H(CH3)C=C=C(CH3)H, 4-chloropenta-2,3-dien-2-ol
② 고리형 알켄
○ 면 카이랄성
○ 예 : trans-cyclooctene
③ 헬리센(helicene)
○ 예 : phenanthro[3,4-c]phenanthrene
④ 회전장애 이성질체(atropisomer)
○ 입체 반발에 의해 카이랄성이 생기는 경우
○ 고온의 환경인 경우 회전이 일어날 수 있음
○ 예 : BINAP
Figure. 14. 회전장애이성질체의 예
⑤ 스피로 화합물(spiro compound)
○ 예 : Fecht acid
⑺ (+) / (-) 명명법
① 정의 : 편광실험 결과 (+)의 편광이 관찰되면 (+) 이성질체이고, (-)의 편광이 관찰되면 (-) 이성질체
② (+)의 편광은 우회전(dextrorotary) 혹은 우선성을, (-)의 편광은 좌회전(levorotary) 혹은 좌선성을 의미함
③ (+) 이성질체를 d 이성질체, (-) 이성질체를 l 이성질체라고 하나 현재는 d, l 명명법이 사용되지 않음 (ref)
④ (+) / (-) 명명법은 RS 명명법에 대한 아무런 정보도 제공하지 못함
○ 예 : (S)-(+)-lactic acid, (S)-(-)-lactate
⑻ DL 명명법 : 생물학에서 자주 채용
① 탄수화물의 DL 명명법
○ 포도당은 CHO로부터 가장 먼 탄소(피셔 구조에서 가장 아래쪽 탄소)의 입체구조를 기준으로 D형, L형을 구분
○ 표준 피셔 구조에서 CHO로부터 가장 먼 탄소에 치환된 -OH기가 R형, 즉 오른쪽을 향하면 D형, 그렇지 않으면 L형
○ 오직 1개의 탄소에 대한 절대배열을 나타낼 뿐 양의 편광, 음의 편광과는 전혀 상관관계가 없음
○ 생명체에서 단당류 등의 탄수화물은 D형 이성질체로 존재함
② 아미노산의 DL 명명법
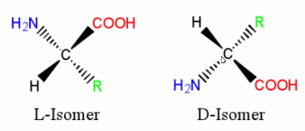
Figure. 15. 아미노산과 DL 명명법
○ 중심탄소 주변에 있는 수소 치환기, 카르복실기, 아미노기, 작용기의 입체배열에 따라 위와 같이 DL 명명법이 결정됨
○ 생명체에서 아미노산은 L형 이성질체로 존재함
4. 광학활성(optical activity) : 카이랄성이라고도 함 [목차]
⑴ 거울상 이성질체는 모든 물리·화학적 성질(녹는점, 끓는점, 용해도 등)이 같음
⑵ 평면편광(plane-polarized light)
① 빛은 진행 방향에 수직인 모든 방향으로 진동하나 한 방향으로만 진동하도록 만든 빛
② 광선이 편광프리즘(Nicol prism)을 통과하면 투과된 광선은 모두 같은 방향으로 진동
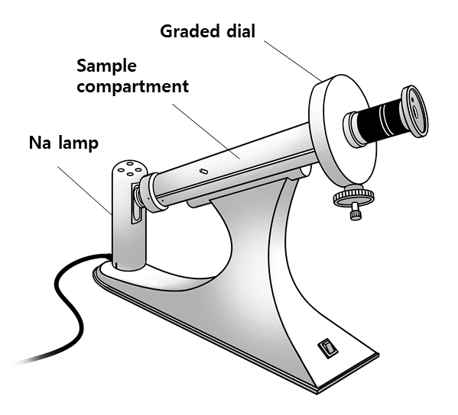
⑶ 편광계(polarimeter) : 평면편광이 유기 화합물이 들어 있는 시료관을 지나가게 하는 장치
Figure. 16. 편광계
⑷ 광학활성
① 비카이랄 분자는 평면편광을 회전시키지 못함
② 카이랄 분자는 평면편광 회전 → 광학활성이 있음
③ 거울상 이성질체는 서로 평면편광을 회전시키는 방향이 정반대임
⑸ 고유 광회전도(specific rotation) : 각 카이랄 분자의 고유 광회전도는 물질의 특성임
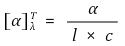
① T : 보통 25 ℃에서 측정
② α : 편광계에서 측정되는 광회전도, αD의 경우 D선 Na 램프의 파장을 이용했다는 의미
③ λ : 빛의 파장, 보통 소듐증기 램프의 D선(589.3 nm)을 사용
④ l : 시료관의 길이(단위 : dm = 10 cm)
⑤ c : 카이랄 시료의 농도(g/ml)
⑥ (+) / (-) 이성질체
○ 우회전성이면 (+), 좌회전성이면 (-)로 표시
○ (+)형 이성질체 : 편광면을 오른쪽으로 회전시키는 이성질체
○ (-)형 이성질체 : 편광면을 왼쪽으로 회전시키는 이성질체
5. 메조 화합물과 라세미 혼합물 [목차]
⑴ 입체이성질체의 최대 개수 : 카이랄 중심이 n개 이면 입체이성질체의 최대 개수 N은
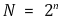
⑵ 메조 화합물(meso compound)
① 정의 : 입체중심이 2개 이상인 화합물이 분자 내 대칭면이 존재하여 자신의 거울상과 동일한 물질인 경우
② 교재에 따라 메조 화합물이 카이랄 중심이 2개 이상인 경우를 지칭하기도 함
③ 팁. (R, S)는 메조화합물일 가능성이 있지만, (R, R), (S, S)는 메조화합물일 가능성 없음
Figure. 17. 메조 화합물 판단 예제
○ (A) ≠ (B) ≠ (C) ≠ (D)이지만, (a) = (d) ≠ (b) ≠ (c)가 성립함
○ (A), (B), (C), (D)의 관계 : 광학 이성질체
○ (b), (c)의 관계 : 광학 이성질체
○ (a), (d)의 관계 : 메조 화합물
③ 팁. 2 이상의 홀수 개의 카이랄 중심을 가지고 있는 경우 메조화합물이 아님 : 그 화합물은 카이랄성이 반드시 있기 때문
○ 2,3,4-tribromo-pentane에서 3번 탄소는 입체 중심이지만 카이랄 중심은 아니라는 것을 유의
⑶ 라세미 혼합물(racemic mixture) : 포도송이라는 뜻의 라틴어인 'racemus'가 어원
① 정의 : 거울상이성질체가 1 : 1 비율로 존재하는 혼합물
② 광학활성 : 동일한 양의 거울상이성질체가 동일한 만큼 평면편광을 회전시켜 광학활성이 상쇄되어 0이 됨
③ 메조화합물과 차이점 : 메조화합물은 한 종류의 물질으로만 구성돼 있고, 라세미 혼합물은 혼합물
④ 자연계와 실험실
○ 자연에서는 효소에 의해 카이랄 분자 한 가지만 얻어짐
○ 예 : 젖산 탈수소효소는 (+) 젖산만 피루브산으로 산화시킴
○ 예 : fumarase는 한쪽에서만 물 분자가 접근할 수 있음
○ 인체에 정상 카이랄 분자의 거울상이성질체를 투여하면 위험할 수 있음
○ 실험실에서 특정 반응은 라세미 혼합물이 얻어짐 → 순도를 떨어트려 좋지 않음 & 인체 유해 위험
⑤ 라세미화 : 라세미 혼합물이 얻어지는 반응
○ 비카이랄 분자(반응물)가 반응하여 카이랄 분자(생성물)가 얻어지는 반응
○ 비카이랄 중간체를 거쳐서 카이랄 분자가 생성되는 반응
○ 다단계 반응은 카이랄 반응물이라도 위 조건을 만족하면 라세미화 일어남
⑥ 거울상 초과량(enantiomer excess)
○ 거울상 초과량 ee(%) = 거울상체 A 백분율 - 거울상체 B 백분율
○ 혼합물 광회전도 = 고유 광회전도 × 거울상 초과량(%)
○ A가 60%, B가 40% 존재한다면 ee(%) = 60 - 40 = 20 %ee이고 A가 B보다 20% 초과하여 존재하고 있음
⑦ 광학적 순도(optical purity)
○ 정의 : 순수한 하나의 거울상체의 광회전도 대비 혼합물의 광회전도
○ 광학적 순도 = 고유 광회전도 × 광학이성질체 ee%
○ 거울상체 A와 B가 동량으로 섞인 라세미체는 광학적 순도가 0
⑧ 라세미 혼합물의 분리
○ 1st. 카이랄 특이적 산 · 염기 반응, 효소론적 반응으로 카이랄 분자를 (R, R)형, (R, S)형 따위로 만듦
○ 2nd. 액체 크로마토그래피(LC), 재결정, 분별증류 등으로 분리
○ 예시
○ (R)-알라닌과 (S)-알라닌에 아세트산 무수물을 처리하면 각각 (R)-N-아세틸알라닌과 (S)-N-아세틸알라닌이 됨
○ 그 뒤 아실레이즈(acylase)를 처리하면 (S)-N-아세틸알라닌의 아마이드 결합만 가수분해됨
○ (R)-N-아세틸알라닌은 그대로 있으므로 작용기 차이에 따른 혼합물 분리가 가능함
⑴ 종류 1. 기하이성질체 : cis/trans 이성질체, fac/mer 이성질체 등
⑵ 종류 1-1. cis/trans 이성질체 : 두 치환기가 같은 방향이면 cis, 반대 방향이면 trans
⑶ 종류 1-2. fac/mer 이성질체
① fac 이성질체 : 특정 세 치환기가 모두 직교하는 경우
② (주석) fac은 'facial'에서 온 말로 세 치환기가 모두 직교하는 경우 세 치환기가 놓이는 한 평면을 상상할 수 있음
③ mer 이성질체 : 세 치환기 중 한 쌍의 치환기가 마주보는 경우
④ (주석) mer는 'meridional'에서 온 말로 한 쌍의 마주보는 치환기가 자오선을 형성함
⑷ 종류 2. 광학이성질체 (거울상이성질체)
⑸ 예 1. FeCl3(H2O)3 (ferric chloride)는 fac/mer 이성질체가 존재함. 분자 내 대칭면이 있으므로 광학이성질체는 없음
Figure. 18. FeCl3(H2O)3의 입체 이성질체
⑹ 예 2. [CoBr4Cl2]3-는 2개의 입체 이성질체를 가짐 : 각 구조는 거울상을 가지지 않음

Figure. 19. [CoBr4Cl2]3-의 입체 이성질체
⑺ 예 3. [Co(bipy)Br2Cl2]-는 4개의 입체 이성질체를 가지며, 이 중 한 쌍은 거울상 이성질체

Figure. 20. [Co(bipy)Br2Cl2]-의 입체 이성질체
⑻ 예 4. Co(en)2Cl2+는 거울상 관계에 있는 두 개의 cis-Co(en)2Cl2+와 한 개의 trans-Co(en)2Cl2+가 존재함
Figure. 21. Co(en)2Cl2+의 입체 이성질체
⑼ 예 5. Co(en)2BrCl+는 거울상 관계에 있는 두 개의 cis-Co(en)2BrCl+와 한 개의 trans-Co(en)2BrCl+가 존재함
① (주석) 천천히 돌려보면 알 수 있음 (참고 : 입체구조와 벡터의 외적)
Figure. 22. Co(en)2BrCl+의 입체 이성질체
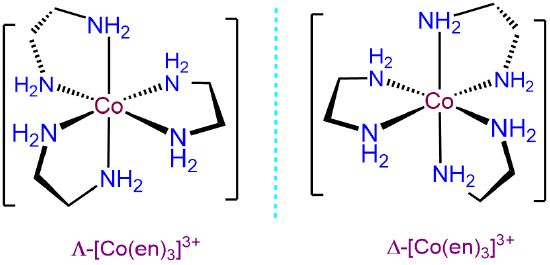
⑽ 예 6. [Co(en)3]3+과 같이 대칭성 리간드가 3개 붙어 있는 경우 거울상 이성질체가 존재함 : 즉, 입체이성질체는 총 2개
① Λ-형 : 좌회전성, (-)
② Δ-형 : 우회전성, (+)
Figure. 23. [Co(en)3]3+의 입체 이성질체
⑾ 예 7. [Co((R)-pn)3]3+은 Λ-fac, Δ-fac, Λ-mer, Δ-mer 등 총 네 종류의 이성질체가 존재함
Figure. 24. [Co((R)-pn)3]3+의 입체 이성질체
⑿ 예 8. 2자리(N 말단, O 말단) 킬레이트 gly를 갖는 [Fe(gly)3]3-는 예 7.처럼 총 네 종류의 이성질체가 존재함
7. Bürgi–Dunitz trajectory [목차]
⑴ Bürgi–Dunitz angle : 카르보닐기의 반결합 궤도(LUMO)에 대하여 친핵체의 HOMO가 접근할 때의 각도
Figure. 25. NaBH4에 의한 환원 반응 속도 비교
⑵ Bürgi–Dunitz angle에 따르면 약 107°의 각도로 BH4-가 카르보닐 탄소의 π*를 공격하게 됨
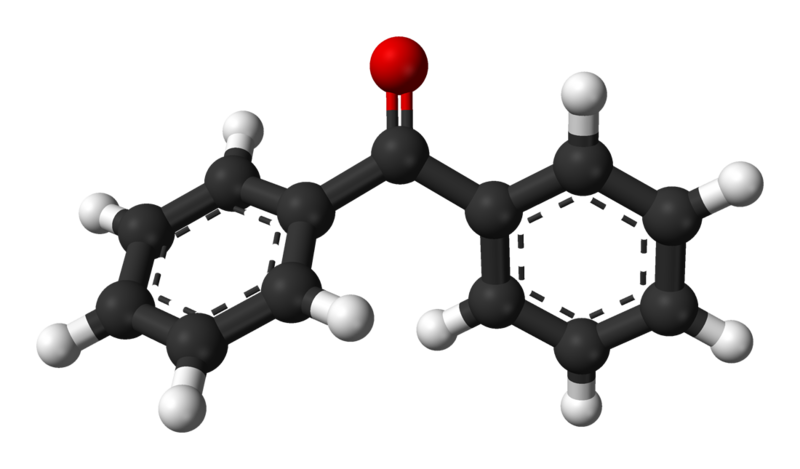
⑶ 두 개의 phenyl기가 한 평면 위에 있지 않으므로 이 경로로 BH4-가 접근할 때 반발력을 크게 받음
Figure. 26. 실제 benzophenon의 구조
입력: 2019.01.09 02:03
수정: 2023.11.07 07:29
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 5강. 유기반응 개요 (4) | 2018.12.27 |
|---|---|
| 【유기화학】 6강. 유기반응 공통 (0) | 2018.12.27 |
| 【유기화학】 2강. 명명법 (12) | 2018.12.27 |
| 【유기화학】 3강. 알케인 (4) | 2018.12.27 |
| 【유기화학】 1강. 유기화학의 기초 (18) | 2018.12.27 |















![[Co((R)-pn)3]3+의 입체 이성질체](https://t1.daumcdn.net/cfile/tistory/990DA6435E6AE4FE2C)





최근댓글