19강. 용해도와 착이온 평형
추천글 : 【화학】 화학 목차
a. 치약과 용해도곱 상수
1. 용해도 [목차]
⑴ 고체의 용해도 : 온도가 증가할수록 용해도 증가
① ΔG = ΔH - TΔS
② | ΔH격자 | ≒ | ΔH수화 | ⇒ ΔH용해 ≃ 0
③ 고체의 용해는 ΔS > 0인 반응이므로
④ T↑ ⇒ ΔG↓
⑵ 액체의 용해도 : 온도가 증가할수록 용해도 증가
① ΔG = ΔH - TΔS
② | ΔH격자 | ≒ | ΔH수화 | ⇒ ΔH용해 ≃ 0
③ 액체의 용해는 ΔS > 0인 반응이므로
④ T↑ ⇒ ΔG↓
⑶ 기체의 용해도 : 온도가 증가할수록 용해도 감소
① ΔG = ΔH - TΔS
② | ΔH격자 | ≒ | ΔH수화 | ⇒ ΔH용해 ≃ 0
③ 기체의 용해는 ΔS < 0인 반응이므로
④ T↑ ⇒ ΔG↑
⑷ 극한 용해 엔탈피(limiting enthalpy of solution)
① 정의 : 용질-용질 상호작용이 무시될 수 있는 묽은 용액의 생성 엔탈피
2. 용해도곱 상수 [목차]
⑴ 용해도곱 상수
① 정의 : AgCl을 예로 들자.

○ 앙금의 정의 : [Ag+] × [Cl-] < Ksp인 경우 AgCl(s)의 자유도가 1이 아니고 그래서 앙금이 없는 것으로 정의
○ 앙금생성반응은 산·염기 반응의 특이한 형태
② 용해도 s (g/L)와의 관계
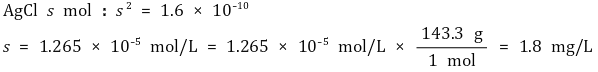
③ 25 ℃에서의 용해도곱상수 Ksp
| 플루오르화물 | |
| BaF2 | [Ba2+][F-]2 = 1.7 × 10-6 |
| CaF2 | [Ca2+][F-]2 = 3.9 × 10-11 |
| MgF2 | [Mg2+][F-]2 = 6.6 × 10-9 |
| PbF2 | [Pb2+][F-]2 = 3.6 × 10-8 |
| SrF2 | [Sr2+][F-]2 = 2.8 × 10-9 |
| 염화물 | |
| AgCl | [Ag+][Cl-] = 1.6 × 10-10 |
| CuCl | [Cu+][Cl-] = 1.0 × 10-6 |
| Hg2Cl2 | [Hg22+][Cl-]2 = 2 × 10-18 |
| 브롬화물 | |
| AgBr | [Ag+][Br-] = 7.7 × 10-13 |
| CuBr | [Cu+][Br-] = 4.2 × 10-8 |
| Hg2Br2 | [Hg22+][Br-]2 = 1.3 × 10-21 |
| 아이오드화물 | |
| AgI | [Ag+][I-] = 1.5 × 10-16 |
| CuI | [Cu+][I-] = 5.1 × 10-12 |
| PbI2 | [Pb2+][I-]2 = 1.4 × 10-8 |
| Hg2I2 | [Hg22+][I-]2 = 1.2 × 10-28 |
| 수산화물 | |
| AgOH | [Ag+][OH-] = 1.5 × 10-8 |
| Al(OH)3 | [Ag3+][OH-]3 = 3.7 × 10-15 |
| Fe(OH)3 | [Fe3+][OH-]3 = 1.1 × 10-36 |
| Fe(OH)2 | [Fe2+][OH-]2 = 1.6 × 10-14 |
| Mg(OH)2 | [Mg2+][OH-]2 = 1.6 × 10-11 |
| Mn(OH)2 | [Mn2+][OH-]2 = 2 × 10-13 |
| Zn(OH)2 | [Zn2+][OH-]2 = 4.5 × 10-17 |
| 아이오드산염 | |
| AgIO3 | [Ag+][IO3-] = 3.1 × 10-8 |
| CuIO3 | [Cu+][IO3-] = 1.4 × 10-7 |
| Pb(IO3)2 | [Pb2+][IO3-]2 = 2.6 × 10-13 |
| 탄산염 | |
| Ag2CO3 | [Ag+]2[CO32-] = 6.2 × 10-12 |
| BaCO3 | [Ba2+][CO32-] = 8.1 × 10-9 |
| CaCO3 | [Ca2+][CO32-] = 8.7 × 10-9 |
| PbCO3 | [Pb2+][CO32-] = 3.3 × 10-14 |
| MgCO3 | [Mg2+][CO32-] = 4.0 × 10-5 |
| SrCO3 | [Sr2+][CO32-] = 1.6 × 10-9 |
| 크롬산염 | |
| Ag2CrO4 | [Ag+]2[CrO42-] = 1.9 × 10-12 |
| BaCrO4 | [Ba2+][CrO42-] = 2.1 × 10-10 |
| PbCrO4 | [Pb2+][CrO42-] = 1.8 × 10-14 |
| 옥살산염 | |
| CuC2O4 | [Cu2+][C2O42-] = 2.9 × 10-8 |
| FeC2O4 | [Fe2+][C2O42-] = 2.1 × 10-7 |
| MgC2O4 | [Mg2+][C2O42-] = 8.6 × 10-5 |
| PbC2O4 | [Pb2+][C2O42-] = 2.7 × 10-11 |
| SrC2O4 | [Sr2+][C2O42-] = 5.6 × 10-8 |
| 황산염 | |
| BaSO4 | [Ba2+][SO42-] = 1.1 × 10-10 |
| CaSO4 | [Ca2+][SO42-] = 2.4 × 10-5 |
| PbSO4 | [Pb2+][SO42-] = 1.1 × 10-8 |
Table. 1. 25 ℃에서의 용해도곱상수
④ 주요 침전물 : 정석 분석법을 통해 특정 화학종의 존재 여부를 검출하는데 사용됨
○ 탄산칼슘(CaCl2) : 흰색 앙금
○ 황산바륨(BaSO4) : 흰색 앙금
○ 아이오딘화 납(PbI2) : 노란색 앙금
○ 염화은(AgCl) : 흰색 앙금
○ 아이오딘화은(AgI) : 노란색 앙금
○ 황화은(Ag2S) : 검정색
○ 이산화망간(MnO2) : 갈색 앙금
○ Fe(OPh)3 : 적자색
○ Fe(OH)2 : green rust
○ Fe(OH)3 : dark orange
○ Cr2(SO4)3 : 청녹색
⑵ 침전 : 염이 너무 많아서 고체 생성물을 형성하고 가라앉는 현상
① 침전 : 반응지수 Q와 Ksp를 비교
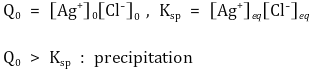
○ Q > K : 침전이 일어남 ↔ 염이 너무 많음
○ Q < K : 침전반응이 일어나지 않음 ↔ 염이 너무 적음
② 공통 이온 효과 : 공통이온의 존재 하에서 용해도 감소
③ 염 효과
⑶ 공통 이온 효과
⑷ pH와 용해도
① 수산화물
② 염기성염
3. 착이온 평형 [목차]
⑴ 형성 상수 Kf
⑵ 착물의 형성과 용해도
⑶ 양쪽성 원소
입력: 2018.12.27 14:54
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 14-1강. 산소요구량 (0) | 2019.01.04 |
|---|---|
| 【화학】 20강. 착물화학 (55) | 2018.12.27 |
| 【화학】 18강. 산·염기 반응 (16) | 2018.12.27 |
| 【화학】 17강. 화학평형 (3) | 2018.12.27 |
| 【화학】 15강. 전기화학 (48) | 2018.12.27 |




최근댓글