14-1강. 산소요구량(oxygen demand)
추천글 : 【화학】 14강. 산화환원반응
1. 총유기탄소 [본문]
2. 화학적 산소요구량 [본문]
3. 생물학적 산소요구량 [본문]
1. 총유기탄소(TOC, total organic carbon) [목차]
⑴ 정의 : 총탄소(TC, total carbon)에서 비유기탄소(IC, inorganic carbon)를 뺀 값
① 비유기탄소 : H2CO3, HCO3-, CO32- 등
⑵ TOC = COD + not oxidizable
① 다만, 이 수식에는 오해의 여지가 있는 게 TOC는 탄소의 양인 반면 COD는 산소요구량이므로 단위가 다른 셈
⑶ 공정시험방법
① 방법 1. 고온연소방법(conbustion)
○ TC : 공기중에서 유기물을 완전연소시켜서 얻은 CO2의 생성량을 적외선 분광기로 읽어들여 측정함
○ IC : 산을 유기물에 살포하여 방출된 CO2를 적외선 분광기로 읽어들여 측정함
○ TC에서 IC를 빼어 TOC를 측정
② 방법 2. 자외선-과황산 산화방법(UV sulfate)
2. 화학적 산소요구량(COD, chemical oxygen demand) [목차]
⑴ 정의 : 물질을 완전히 산화하는 데 필요한 전자의 양을 4로 나눈 것
① 4로 나눈 이유 : O2의 양으로 표시하기 위함. 한 개의 O2는 4개의 전자를 흡수함
② 일반적으로 mol/L가 아니라 ppm으로 단위를 나타냄
⑵ COD = BOD + not biologically degradable
⑶ 실험 과정 : 화학적 산소요구량은 다음과 같은 실험 과정을 거쳐 결정한다.
① 단계 1. 오염된 물에 알고 있는 양의 Cr2O72-를 넣어, 오염 물질을 산화시킴
○ 화학반응식 : 오염물질 + Cr2O72- → 2Cr3+ + 산화된 물질
○ Cr2O72-을 쓰는 이유 : Cr2O72-는 굉장히 강한 산화제로 물질을 완전히 산화시킬 수 있음
○ 예제. 오염된 물 1.00 L에 Cr2O72- 0.0240 mol을 넣고 오염물을 산화시킴
② 단계 2. 반응하고 남은 Cr2O72-를 Fe2+로 산화·환원 적정하여 오염 물질과 반응한 Cr2O72-의 양을 결정
○ 화학반응식 : Cr2O72- + 6Fe2+ → 2Cr3+ + 6Fe3+
○ 예제. 남아 있는 Cr2O72-을 환원시키기 위하여 0.120 mol의 Fe2+가 소비
○ 예제. 0.120 mol의 Fe2+가 반응했으므로 반응하고 남은 Cr2O72-는 0.120 ÷ 6 = 0.020 mol
○ 예제. 오염 물질과 반응한 Cr2O72-는 0.0240 - 0.020 = 0.004 mol
③ 단계 3. 오염 물질과 반응한 Cr2O72-의 양을 산소의 질량으로 환산
○ 화학반응식 : O2 + 4e- → 2O2-
○ 예제. 1 mol Cr2O72-는 6 mol의 전자를 환원하고 1 mol O2는 4 mol의 전자를 환원
○ 예제. O2로 표시한 전자량
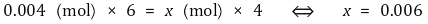
④ 단계 4. 단위 변환(unit conversion) : 오염된 물에 대한 산소의 질량 비를 ppm으로 표시
○ 예제. 아래 식에서 1 L H2O / 1 kg H2O 및 1 kg O2 / 1,000 g O2를 생략
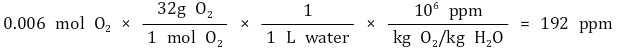
○ 예제. 알칼리 폐수에 대한 COD 계산
3. 생물학적 산소요구량(BOD, biological oxygen demand) [목차]
⑴ 정의 : 미생물이 시료 내 유기물을 산화하는 데 필요한 산소량
① BOD는 유기물의 양에 비례함
② 미생물의 양에는 크게 상관 없음 : 유기물이 전부 산화하는 데 필요한 전자만큼만 산소가 사용되므로
③ 화학적 산소요구량과 달리 충분한 시간을 기다려야 유기물이 완전히 산화되어 올바른 BOD 값이 측정됨
⑵ 실험 방법 (출처 : 2013 MEET/DEET 자연과학 I)
① 단계 1. 두 하천에서 채취한 시료를 20 ℃로 맞춘 후, 같은 온도의 희석수로 5배 희석
② 단계 2. 희석한 시료를 하천별로 각각 3개의 병 A~C에 완전히 채운 후 밀폐함
③ 단계 3. A 시료의 용존산소량(DO1)을 즉시 측정함
④ 단계 4. B와 C 시료를 20 ℃의 어두운 곳에서 5일간 배양한 후, 용존산소량을 측정하여 B와 C의 평균값(DO2)을 구함
○ 어두운 곳에서 배양하는 이유 : 빛이 있으면 시아노박테리아의 영향으로 BOD가 감소하기 때문
○ 즉, 미생물들이 산소를 덜 소비한 것으로 나타남
⑤ 단계 5. BOD = (DO1 - DO2) × 5
○ 5를 곱해주는 이유 : 단계 1에서 5배로 희석했기 때문
○ 유기물이 많으면 DO2가 감소하여 BOD가 증가함
○ 초기 미생물이 많아도 유기물만큼만 DO2가 감소하여 BOD가 달라지지 않음
○ CBOD만 있는 경우, 충분한 시간이 지난 이후에는 BOD 값이 크게 달라지지 않음
⑶ BOD = hard BOD + soft BOD
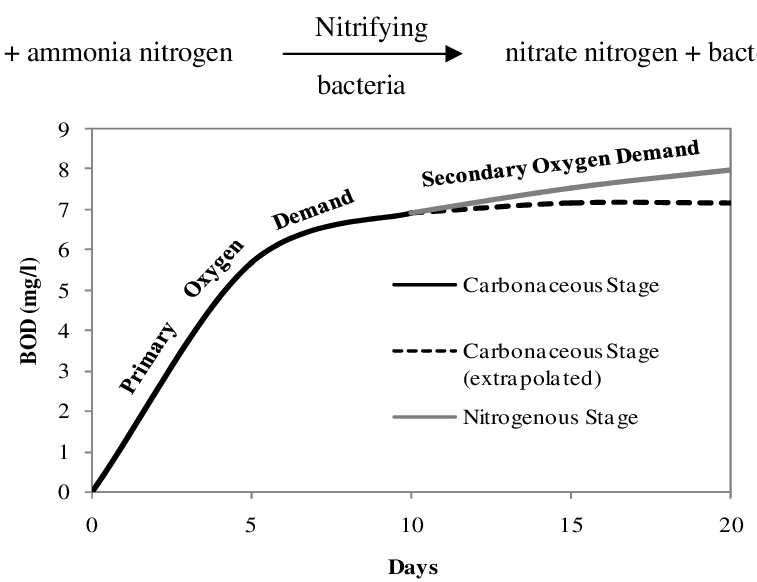
⑷ BOD = CBOD(carbonaceous BOD) + NBOD(nitrogenous BOD)
① NBOD : 질소나 암모니아 등 환원된 질소 화합물을 산화하는 데 필요한 산소량
○ Nitrosomonas bacteria, Nitrobacter bacteria 등의 질소 대사 미생물에 의해 만들어짐
② CBOD는 primary stage에서 빠르게 증가하지만 금방 포화되고, NBOD는 secondary stage에서부터 서서히 증가
Figure. 1. primary stage, secondary stage와 BOD
③ 계산 과정
⑸ 경도(hardness of water)
① 정의 : 수중의 2가 양이온 (예 : Ca2+, Mg2+, Fe2+, Mn2+, Sr2+ 등) 함량을 이에 대응하는 mg CaCO3 / L로 환산 표시한 것
○ 근사적으로 Ca2+ hardness와 Mg2+ hardness의 합으로 나타낼 수 있음
② 중요성 : 경도가 높은 경우, 2가 양이온들이 비누와 먼저 결합반응을 하여 세척효과를 떨어트림
③ 경도에 따른 물의 분류
○ 연수(soft water) : 전체 경도가 0 ~ 75인 경우
○ 적당한 경수(moderately hard water) : 전체 경도가 75 ~ 100인 경우
○ 경수(hard water) : 전체 경도가 100 ~ 300인 경우
○ 강한 경수(very hard water) : 전체 경도가 300 이상인 경우
④ 예제
입력: 2019.03.19 20:49
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 분자량 결정 실험 (0) | 2019.02.19 |
|---|---|
| 【화학】 22강. 핵화학 (3) | 2019.01.08 |
| 【화학】 20강. 착물화학 (55) | 2018.12.27 |
| 【화학】 19강. 용해도와 착이온 평형 (0) | 2018.12.27 |
| 【화학】 18강. 산·염기 반응 (16) | 2018.12.27 |



최근댓글