18강. 산·염기 반응(acid·base reaction)
추천글 : 【화학】 화학 목차
1. 산·염기의 정의 [목차]
⑴ 일상적인 산·염기
① 산의 일반적인 성질
○ 신맛 : 신맛은 H+에 반응하는 미각을 의미
○ 금속과 반응하여 수소 발생
○ 25 ℃에서 pH < 7
② 염기의 일반적인 성질
○ 쓴맛 : 쓴맛은 퀴논에 반응하는 미각
○ 촉감이 미끄러움
○ 25 ℃에서 pH > 7
⑵ 아레니우스(Arrhenius) 산·염기
① 산 : 수용액에서 수소 이온을 내놓는 물질
② 염기 : 수용액에서 수산화 이온을 내놓는 물질
③ 수소가 다른 원소에 비해 특별한 이유
○ 원소 중 가장 가벼워 수많은 화학반응에 관여할 수 있음
④ 한계
○ 수용액 상태가 아닌 경우 설명 불가
○ NH3의 경우 물에 녹아 염기성을 나타내지만 아레니우스 염기의 정의 불만족
⑶ 브뢴스테드-로우리(Brønsted–Lowry) 산·염기
① 1923년 덴마크의 브뢴스테드와 영국의 로우리가 동시에 발표
② 산 : 양성자 주개 (H+ donor)
③ 염기 : 양성자 받개 (H+ acceptor)
④ 상대성 : 산과 염기의 개념은 상대적임
○ 짝염기(conjugate base) : 브뢴스테드-로우리 산은 양성자를 잃고 짝염기가 됨
○ 짝산(conjugate acid) : 브뢴스테드-로우리 염기는 양성자를 얻고 짝산이 됨
○ 양쪽성 : 정상 조건에서 산이나 염기로 작용할 수 있는 것, 물·알코올 등
⑤ 한계
○ 산이 반드시 산성 수소 원자를 포함해야 함
○ 수소 이온을 주고받지 않는 산, 염기는 설명 불가
⑷ 루이스(Lewis) 산·염기 : 산화수 변화가 없는 모든 화학반응을 기술
① 루이스라는 미국의 물리학자가 도입
② 산 : 전자쌍 받개
③ 염기 : 염기쌍 주개, 친핵체와 유사
④ 모든 브뢴스테드-로우리 산은 루이스 산이지만 역은 성립하지 않음
○ 예 1. BF3 : empty p orbital이 있어 루이스 산이지만 브뢴스테드-로우리 산은 아님
○ 예 2. AlCl3
⑤ 루이스 염기는 브뢴스테드-로우리 염기와 유사한 개념
⑥ 예 : AlCl3 + NH3 → Cl3Al-NH3
○ 생성물은 반응물에 비해 옥텟룰을 만족하므로 정반응 우세
○ 루이스 산인 AlCl3는 루이스 염기인 NH3로부터 공유전자쌍을 받아 반응 진행
⑸ 중화반응(neutralization reaction)
① 산과 염기 사이의 반응
② 수용액의 산-염기 반응은 물과 염을 생성시키고 열(중화열)을 발생
2. 이온화 평형 [목차]
⑴ 이온화 상수 : 산 · 염기가 수용액에서 이온화하는 반응의 평형상수
① 산 해리 상수 Ka
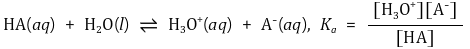
② 염기 해리 상수 Kb
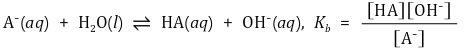
⑵ 물의 이온화와 pH
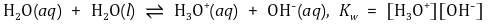
① 한 쌍의 짝산-짝염기에서 다음 공식이 성립
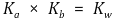
② pH + pOH = pKw
③ 25 ℃에서 수용액이 중성일 때, Kw = 10-14, pH = pOH = 7
○ 물의 이온화 반응은 흡열반응이기 때문에 온도가 증가하면 Kw 증가
○ 온도가 증가하면 중성 pH는 낮아짐
④ 유용한 공식 : pKa + pKb = pKw
⑶ 이온화도
① 실험결과와 이온화도
② 강산과 강염기 : 100 % 이온화한다고 가정
○ 평준화 효과(leveling effect) : 용매의 짝산보다 강한 산과 짝염기보다 강한 염기는 전부 전환됨
○ H3O+보다 강한 산은 H2O 하에서 존재할 수 없음
○ OH-보다 강한 염기는 H2O 하에서 존재할 수 없음
○ H2SO4는 H3O+보다 강한 산이기 때문에 수용액 하에서 전부 HSO4-로 전환됨
○ H2SO4를 물에 녹이면 H2SO4를 반응물로 하는 반응은 일어날 수 없음 : 단, 물과의 산염기 반응은 제외
○ 평준화 효과의 본질
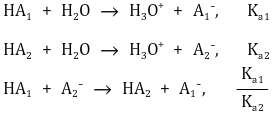
○ 평준화 효과 중 짝산과 비교하는 상황은 HA1이 강산이고 HA2가 H3O+인 상황
○ 일반적으로 평형상수의 비는 지수적이기 때문에 이들의 비는 굉장히 크거나 굉장히 작음
○ Ka1 > Ka2인 상황이므로 Ka1 ÷ Ka2는 굉장히 큼
○ 3번째 반응이 평형상수가 굉장히 크기 때문에 거의 100%가 정반응을 진행
③ 약산과 약염기 : 일부만 이온화한다고 가정
3. 산도 상수(Ka)와 pKa [목차]
⑴ 산도, 염기도를 비교하기 위해 pKa 값을 자주 이용 : pKa = -logKa
⑵ 산과 염기의 세기
① Ka가 클수록 산의 세기가 강하고, Kb가 클수록 염기의 세기가 강함
② Ka × Kb가 일정하므로 산의 세기가 세면 짝염기의 세기는 약하고, 역도 성립
⑶ ΔpKa
① ΔpKa > 0 : 정반응
② ΔpKa < 0 : 역반응
③ ΔpKa = 0 : 평형상태
④ | ΔpKa | ≤ 7 : 정반응과 역반응의 평형반응
⑤ | ΔpKa | > 7 : 정반응이나 역반응의 일방적 반응
4. 완충용액(버퍼, buffer) [목차]
⑴ 정의 : 소량의 산이나 염기를 첨가할 때 pH가 거의 일정한 용액 (예 : 탄산의 완충작용)
⑵ 조건 : 약산과 짝염기가 동시에 존재하는 용액은 완충용액으로 작용할 수 있음
① 제법 1. 약산과 보다 몰수가 적은 강염기를 혼합한 용액
② 제법 2. 약염기와 보다 몰수가 적은 강산을 혼합한 용액
③ 짝산-짝염기 관계가 아닌 서로 다른 약산, 약염기를 혼합하면 완충용액이 아님
○ 한 화학종은 전부 짝산, 다른 화학종은 전부 짝염기인 식으로 반응이 진행하기 때문
○ K = K1 ÷ K2이므로 K ≪ 1이거나 K ≫ 1임
⑶ 완충용량 : 단위 부피의 완충용액에서 일정 수준의 pH 변화가 나타낼 때까지 필요한 H+나 OH-의 양
① HA와 A-의 총량은 일정하고 [HA]와 [A-]의 비율만 변할 때 [HA] = [A-]일 때 완충용량이 가장 큼
○ [HA]>[A-] : 염기에 대한 완충용량이 산에 대한 완충용량보다 큼
○ [HA]<[A-] : 산에 대한 완충용량이 염기에 대한 완충용량보다 큼
② HA 및 A-의 총량이 많을수록 완충용량이 큼
③ [HA]와 [A-]의 비율과 HA와 A-의 총량이 모두 변할 때 완충용량 비교 문제는 출제되지 않음
⑷ 완충용액은 pKa - 1 < pH < pKa + 1일 때 완충작용을 잘 한다(즉, pH 변화 ≪ 1)고 실험적으로 증명
⑸ 완충용액의 종류
① 탄산수 : 주로 해양에서 관찰할 수 있으며 pH = 8에서 거의 HCO3-가 존재. 2가 양이온이므로 완충구간이 2개
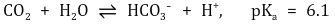
② 인산수 : 자연수에서 탄산수 다음으로 많이 관찰되는 완충계. 3가 양이온이므로 완충구간이 3개나 있음
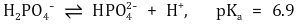
③ 단백질 완충계
④ 암모니아 완충계
NH3 + H+ → NH4+
⑤ PBS (phosphate buffered saline) : 화학실험에서 자주 사용하는 PH 7.4 정도의 버퍼
⑥ DPBS (Dulbecco’s PBS) : 세포 부착에 관여하는 Mg2+, Ca2+ 등이 제거되어 세포가 더 쉽게 떼어질 수 있게 함
⑦ 트리스 버퍼(Tris-HCl buffer) : 시험관 내 버퍼
○ 약한 염기 : pKb = 5.9
○ Tris (aq) + H+ (aq) ⇄ TrisH+ (aq)
⑧ HEPES 버퍼 : 세포 내 버퍼
⑨ STE
⑩ NaAc (sodium acetate)
⑪ NH4Ac (amonium acetate)
⑫ MES (2-(N-morpholino)ethanesulfonic acid)
⑬ 리파 버퍼(ripa buffer)
⑭ 로딩 버퍼(loading buffer, Laemmil sample buffer)
⑮ 트랜스퍼 버퍼(transfer buffer)
⑯ sodium cacodylate buffer : bio-TEM 샘플 전처리 과정에서 이용
⑰ MOPS buffer
5. 적정(titration) [목차]
⑴ 적정 : 농도를 모르는 산이나 염기의 농도를 측정하는실험
① 적정 용액은 강산이거나 강염기여야 함
② ①의 이유 : 중화반응이 100% 일어나야 하므로
⑵ 당량점(stoichiometric point) : 미지시약 내 산(염기)의 몰수와 첨가한 염기(산)의 몰수가 같아지는 지점
⑶ 지시약(indicator) : 색깔을 통해 용액의 pH를 확인하기 위해 사용하는 물질
① 종말점(end point) : [HIn] = [In-]인 pH로서 pKIn이기도 함
○ 적정 실험에서 지시약의 변색범위 고려 : pKIn - 1 <당량점의 pH < pKIn + 1이어야 함
○ 위 식으로부터 산·염기 적정에서 사용하는 모든 지시약은 약산 혹은 약염기여야 함이 도출
○ 아래에서 소개될 당량점은 미지 시약의 성질인 반면, 종말점은 지시약의 성질임
② 일반 지시약
| 지시약의 종류 | pI | 변색 pH | 색깔 |
| 티몰 블루 (thymol blue) |
1.2 ~ 2.8 | 빨강(강산성) 노랑(약산성) |
|
| 메틸 옐로우 (methyl yellow) |
2.9 ~ 4.1 | 빨강(강산성) 노랑(약산성) |
|
| 메틸오렌지 (methyl orange) |
3.46 | 3.1 ~ 4.4 | 빨강(산성) 노랑(염기성) |
| 브로모크레졸 그린 (bromocresol green) |
4.66 | 3.8 ~ 5.4 | 노랑(산성) 파랑(중성, 염기성) |
| 메틸레드 (methyl red) |
5.1 | 4.8 ~ 6.0 | 빨강(산성) 노랑(염기성) |
| 리트머스 종이 (litmus paper) |
5.0 ~ 8.0 | 빨강(산성) 초록(중성) 파랑(염기성) |
|
| 브로모크레졸 퍼플 (bromocresol purple) |
6.3 | 5.2 ~ 6.8 | 노랑(산성) 보라(염기성) |
| 브로모티몰 블루 (BTB, bromothymol blue) |
7.0 | 6.0 ~ 7.6 | 노랑(산성) 초록(중성) 파랑(염기성) |
| 에리오크롬 블랙 T (EBT, eriochrome black T) |
6.3 ~ 11.5 | 빨강(산성) 주황(염기성) |
|
| 자일레놀 오렌지 (xylenol orange) |
6.4 ~ 10.4 | 노랑(산성) 오렌지-레드(염기성) |
|
| 뉴트랄 레드 (neutral red) |
6.8 ~ 8.0 | 빨강(산성, 중성) 노랑(염기성) |
|
| 페놀 레드 (phenol red) |
7.81 | 6.8 ~ 8.4 | 노랑(산성) 빨강(염기성) |
| 페놀프탈레인 (phenolphthalein) |
8.2 ~ 9.6 | 무색(산성) 분홍(염기성) |
|
| 티몰 프탈레인 (thymol phthalein) |
9.3 ~ 10.5 | 무색(산성, 중성) 파랑(염기성) |
Table. 1. 지시약의 종류
③ 특별한 지시약
○ 예 1. 녹말 지시약 : I-는 염색하지 않지만 요오드 덩어리(예 : I3-)는 염색시킴
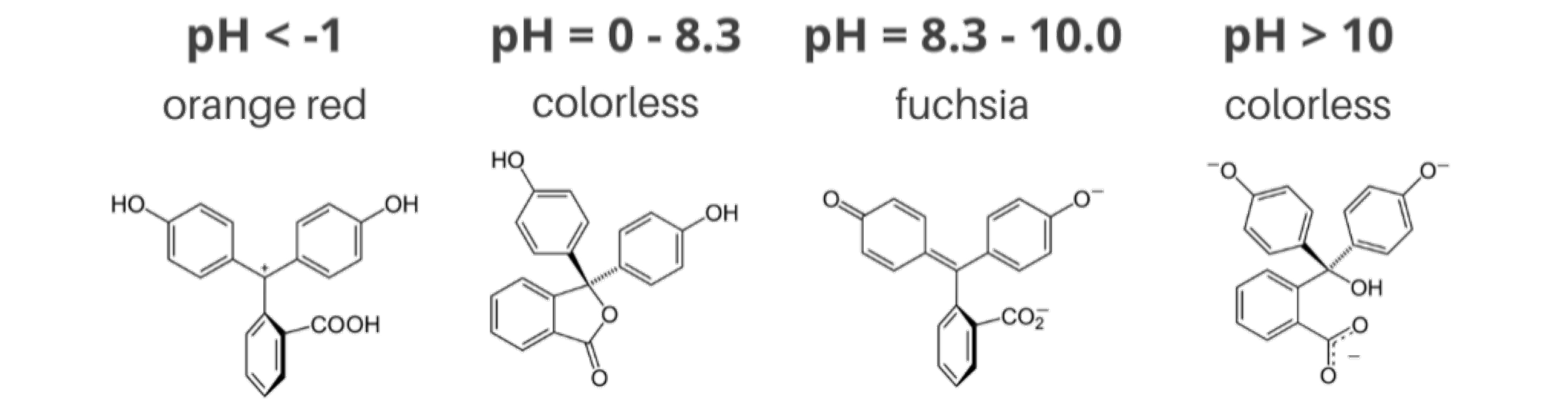
④ 지시약의 색깔이 바뀌는 원리
○ π 결합은 가시광선 흡수 가능 : 일반적인 분자 공명진동수는 자외선이지만 공명범위가 넓어지면 가시광선에서 공명
○ conjugation 길이가 길어지면 흡수파장이 길어짐
Figure. 1. pH에 따른 페놀프탈레인의 형태 변화
Figure. 2. 염기성 형태의 페놀프탈레인이 가시광선을 흡수하는 이유 (상자 속 입자)
○ 단, 페놀프탈레인의 경우 강산 조건에서 다시 공명 구조가 길어져서 orange red 색상을 띠게 됨
⑷ 일양성자성 산(1가산)의 이온화 평형
① 반응식
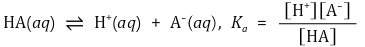
② 핸더슨-하셀바흐 방정식(Henderson-Hasselbalch equation) : Ka 정의에 단순히 -log 취한 것에 불과함
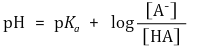
③ 강염기로 적정시 : 최초에 HA가 α mmol만 존재한다고 가정
○ 최초 시점
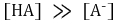
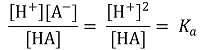
○ 반당량점 : 강염기를 0.5α mmol 첨가했을 때

○ 당량점 : 강염기를 α mmol 첨가했을 때
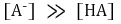
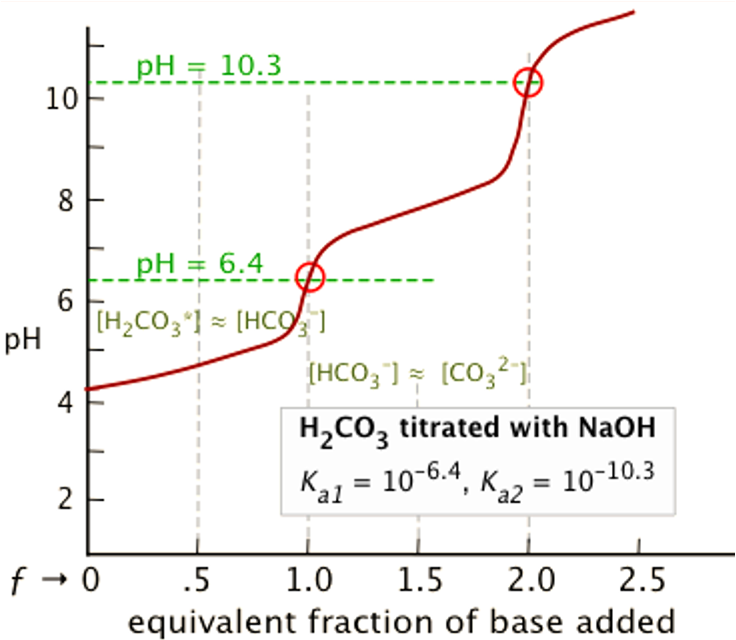
⑸ 이양성자성 산(2가산) (예 : H2CO3)의 이온화 평형
① 반응식
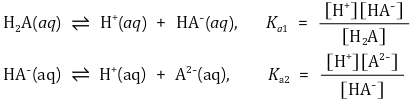
② 핸더슨-하셀바흐 방정식 : Ka 정의에 단순히 -log 취한 것에 불과함
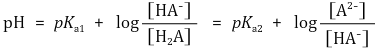
③ 강염기로 적정시 : 최초에 H2A가 α mmol만 존재한다고 가정
○ 최초 시점
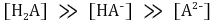
○ 제1 반당량점 : 강염기를 0.5α mmol 첨가했을 때
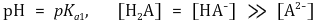
○ 제1 당량점 : 강염기를 α mmol 첨가했을 때. 대칭성에 의해 [H2A]와 [A2-]가 등호임을 유의
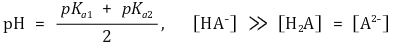
○ 제2 반당량점 : 강염기를 1.5α mmol 첨가했을 때

○ 제2 당량점 : 강염기를 2α mmol 첨가했을 때
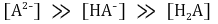
⑹ 삼양성자성 산(3가산) (예 : H3PO4)의 이온화 평형
① 반응식
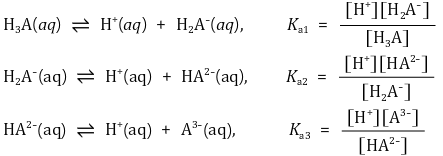
② 핸더슨-하셀바흐 방정식 : Ka 정의에 단순히 -log 취한 것에 불과함
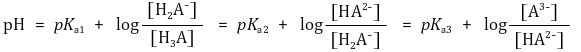
③ 강염기로 적정시 : 최초에 H3A가 α mmol만 존재한다고 가정
○ 최초 시점
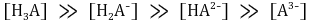
○ 제1 반당량점 : 강염기를 0.5α mmol 첨가했을 때
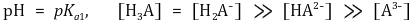
○ 제1 당량점 : 강염기를 α mmol 첨가했을 때
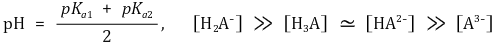
○ 제2 반당량점 : 강염기를 1.5α mmol 첨가했을 때. 대칭성에 의해 [H3A]와 [A3-]가 등호임을 유의
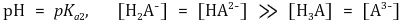
○ 제2 당량점 : 강염기를 2α mmol 첨가했을 때
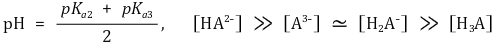
○ 제3 반당량점 : 강염기를 2.5α mmol 첨가했을 때
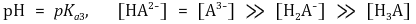
○ 제3 당량점 : 강염기를 3α mmol 첨가했을 때
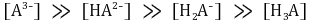
6. 아미노산 적정 [목차]
⑴ 아미노산의 특징
① 등전점(isoelectric point) : 아미노산이 전하를 띠지 않는 pH. pH가 급변하는 지점이기도 함
② 아미노산은 중성 pH에서 양쪽성 이온(zwitter ion)
⑵ 예 1. 중성아미노산 : gly
① 작용기가 -H인 경우
② 카르복실기 : pKa1 = 2.34
③ 아미노기 : pKa2 = 9.60
④ 등전점 : [NH3+-RH2-COOH] = [NH2-RH2-COO-]인 경우
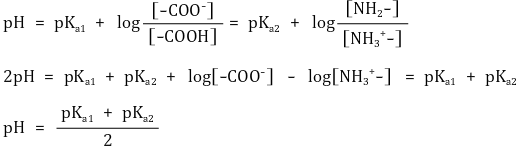
⑤ 등전점 해석
○ pH < pKa1 : NH3+-RH2-COOH 우세, NH3+-RH2-COO- 약세
○ pKa1 < pH < pKa2 : NH3+-RH2-COO- 우세, NH3+-RH2-COOH 및 NH2-RH2-COO- 약세
○ pKa2< pH : NH2-RH2-COO- 우세
○ 결론 : 중성인 분자를 파악한 뒤 전후로 가장 가까운 pKa 값을 찾아 평균을 취하면 등전점이 됨
⑶ 예 2. 음전하 아미노산 : Asp, Glu
① 작용기의 pKa가 2.34보다 큼
② 등전점
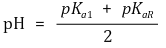
③ 팁. 가까운 두 개의 pKa 값을 평균 취하면 등전점이 됨 : 작용기의 pKaR이 pKa1과 가까우므로
⑷ 예 3. 양전하 아미노산 : Arg, His, Lys
① 작용기의 pKaR가 9.60보다 작음
② 등전점
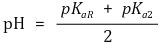
③ 팁. 가까운 두 개의 pKa 값을 평균 취하면 등전점이 됨 : 작용기의 pKaR이 pKa2와 가까우므로
⑸ 각 아미노산 별 pKa1, pKa2, pKaR, pI, 소수성 지표, 단백질에서의 비율
| 아미노산 | 단축형 이름 | 분자량 | pKa1 (-COOH) |
pKa2 (-NH3+) |
pKaR | pI (등전점) |
소수성지표 | 단백질에서의 비율(%) |
| 비극성, 지방족 R기 | ||||||||
| 글라이신 | Gly, G | 75 | 2.34 | 9.60 | 5.97 | -0.4 | 7.2 | |
| 알라닌 | Ala, A | 89 | 2.34 | 9.69 | 6.01 | 1.8 | 7.8 | |
| 프롤린 | Pro, P | 115 | 1.99 | 10.96 | 6.48 | -1.6 | 5.2 | |
| 발린 | Val, A | 117 | 2.32 | 9.62 | 5.97 | 4.2 | 6.6 | |
| 류신 | Leu, L | 131 | 2.36 | 9.60 | 5.98 | 3.8 | 9.1 | |
| 아이소류신 | Ile, I | 131 | 2.36 | 9.68 | 6.02 | 4.5 | 5.3 | |
| 메싸이오닌 | Met, M | 149 | 2.28 | 9.21 | 5.74 | 1.9 | 2.3 | |
| 방향족 R기 | ||||||||
| 페닐알라닌 | Phe, F | 165 | 1.83 | 9.13 | 5.48 | 2.8 | 3.9 | |
| 타이로신 | Tyr, Y | 181 | 2.20 | 9.11 | 10.07 | 5.66 | -1.3 | 3.2 |
| 트립토판 | Trp, W | 204 | 2.38 | 9.39 | 5.89 | -0.9 | 1.4 | |
| 극성, 비전하 R기 | ||||||||
| 세린 | Ser, S | 105 | 2.21 | 9.15 | 5.68 | -0.8 | 6.8 | |
| 트레오린 | Thr, T | 119 | 2.11 | 9.62 | 5.87 | -0.7 | 5.9 | |
| 시스테인 | Cys, C | 121 | 1.96 | 10.28 | 8.18 | 5.07 | 2.5 | 1.9 |
| 아스파라진 | Asn, N | 132 | 2.02 | 8.80 | 5.41 | -3.5 | 4.3 | |
| 글루타민 | Gln, Q | 146 | 2.17 | 9.13 | 5.65 | -3.5 | 4.2 | |
| 양전하 R기 | ||||||||
| 라이신 | Lys, K | 146 | 2.18 | 8.95 | 10.53 | 9.74 | -3.9 | 5.9 |
| 히스티딘 | His, H | 155 | 1.82 | 9.17 | 6.00 | 7.59 | -3.2 | 2.3 |
| 아르지닌 | Arg, R | 174 | 2.17 | 9.04 | 12.48 | 10.76 | -4.5 | 5.1 |
| 음전하 R기 | ||||||||
| 아스파르트산 | Asp, D | 133 | 1.88 | 9.60 | 3.65 | 2.77 | -3.5 | 5.3 |
| 글루탐산 | Glu, E | 147 | 2.19 | 9.67 | 4.25 | 3.22 | -3.5 | 6.3 |
Table. 2. 각 아미노산 별 pKa1, pKa2, pKaR, pI, 소수성 지표, 단백질에서의 비율
⑹ 아미노산 서열의 알짜 전하, 등전점
Glu - His - Trp - Ser - Gly - Leu - Arg - Pro - Gly
① 특정 pH에서의 알짜 전하
○ 1단계. -NH3+ 말단, 아미노산의 작용기, -COO- 말단 각각에 대하여 pKa와 pH를 비교
○ -NH3+ 말단 : pKa = 9.60
○ Glu 작용기 : pKa = 4.25
○ His 작용기 : pKa = 6.00
○ Arg 작용기 : pKa = 12.48
○ COO- 말단 : pKa = 2.34
○ 2단계. 실무율 : 각각에 대하여 pH < pKa이면 짝산이 존재한다고 보고, pH > pKa이면 짝염기가 존재한다고 간주
○ 3단계. 각각에 대하여 전하를 결정하고 다 합산
○ 짝산이라고 +1이고 짝염기라고 -1이 당연히 아님을 유의
| pH | NH3+ 말단 | Glu 작용기 | His 작용기 | Arg 작용기 | COO- 말단 | 알짜 전하 |
| 3 | +1 | 0 | +1 | +1 | -1 | +2 |
| 8 | +1 | -1 | 0 | +1 | -1 | 0 |
| 11 | 0 | -1 | 0 | +1 | -1 | -1 |
Table. 3. 특정 pH에서의 알짜 전하 판단 방법 예시
② 등전점
○ 방법 1. pKa 값을 통해 등전점 계산
○ 1st. ionizable group을 모두 찾기 : 위의 예시에서 NH3+ 말단, Glu, His, Arg, COO- 말단
○ 2nd. 실무율(all-or-none)에 따라 알짜 전하가 0이 되는 구간을 탐색 : 위의 예시에서 6.00 < pH < 9.60
○ 3rd. pH에 따른 pI는 사실상 연속적이므로 구간의 경계를 이루는 두 pKa 값들의 평균을 취함
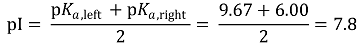
○ 방법 2. pH에 따른 아미노산 전하 그래프를 그려서 전하가 0이 되는 지점을 찾기
입력: 2019.01.03 23:16
수정: 2020.04.21 23:59
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 20강. 착물화학 (55) | 2018.12.27 |
|---|---|
| 【화학】 19강. 용해도와 착이온 평형 (0) | 2018.12.27 |
| 【화학】 17강. 화학평형 (3) | 2018.12.27 |
| 【화학】 15강. 전기화학 (48) | 2018.12.27 |
| 【화학】 14강. 산화환원반응 (0) | 2018.12.27 |







최근댓글