15강. 전기화학(electrochemistry)
추천글 : 【화학】 화학 목차, 【회로이론】 2강. 전원
a. 전기화학 문제
1. 기본 이론 [목차]
⑴ 전기적 일

① n : 전자의 몰수
② (주석) E의 단위 V(volts) ≡ J / C라는 사실을 알면 이해하기 어렵지 않음
③ 한 과정에서 수반되는 Gibbs 자유에너지 변화는 일정한 온도와 압력에서 계가 할 수 있는 최대 비팽창일
⑵ 전기분해에서의 패러데이 법칙(Faraday's law of electrolysis)

① n : 반쪽반응에 해당하는 전자의 몰당량
② F : 패러데이 상수(Faraday constant) ≒ 96500 C/mol
③ W : 석출된 금속의 질량
④ M : 석출된 금속의 원자량
⑤ 전자 1몰의 전하량 = N0e = 1F = 96485.33977 C/mol
○ 1 F = 6.02214179 × 1023개/mol × 1.602176487 × 10-19 C/개 = 96485.33977 C/mol
⑥ 이동한 전하량 = 전류(A) × 시간(s)
⑶ 금속의 이온화경향
① K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
② 무엇이 산화되고 무엇이 환원되는지 파악할 수 있음
⑷ 활동도(activity) : 전기화학 문제는 편의상 농도를 이용하지만, 엄밀하게는 활동도로 계산
2. 화학전지 [목차]
⑴ 정의
① 갈바니전지(galvanic cell) : 화학반응의 퍼텐셜을 이용하여 전압을 제공하는 전압원 → 자발적 반응
○ 특징 : 산화전극이 (-)극, 환원전극이 (+)극
○ 갈바니전지 자체가 전지 역할을 하므로 산화전극에서 전자를 공급하고 환원전극에서 전자를 회수
② 전해전지(electrolytic cell) : 외부 전원에 의해 전자가 전위에 역행해서 이동 → 전기 분해
○ 특징 : 환원전극이 (-)극, 산화전극이 (+)극
○ 전해전지 외부에 더 센 전지가 있어서 환원전극으로 전자를 강제적으로 공급하기 위해 (-)극과 연결
⑵ 4대 구성요소 : 환원전극, 산화전극, 전해질, 분리막을 지칭
① 환원전극(cathode) : 외부 도선으로부터 전자를 받아 환원되는 금속
② 산화전극(anode) : 산화되면서 외부 도선으로 전자를 방출하는 금속
③ 전해질(electrolyte) : 전극이 전기적으로 중성이 되도록 물질이동을 일으킴
④ 분리막(separator) : 양극이 음극의 직접적인 물리적 접촉 방지를 위한 격리막
⑤ 염다리(salt bridge) : 염다리가 없으면 전기화학반응이 진행됨에 따라 산화전극과 환원전극에서 전하가 축적됨
○ 전하의 축적은 추가적인 반응을 일으키는 것을 방해함
○ 염다리는 환원전극과 산화전극을 연결하여 전하의 축적을 완화하기에 적절한 염을 제공
⑶ cell diagram
① 예시 : Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s), Ecellº
② | : 상 경계(phase boundary)
③ || : 염다리
④ 「Zn(s) | Zn2+(aq)」 : 산화전극
⑤ 「Cu2+(aq) | Cu(s)」 : 환원전극
⑥ Ecellº = Erightº - Eleftº (단, Eº은 표준 환원전위)
⑦ Ecellº > 0이면 반응은 자발적으로 진행
3. 갈바니전지 [목차]
⑴ 표준 전극과 표준 전위
① 기준 전극
○ 필요성 : 전극 전위의 절댓값은 측정할 수 없고, 오직 두 전극 사이의 전위 차이만을 측정할 수 있으므로
○ 조건 : 기준 전극은 이상 비분극 전극(ideally non-polarizable electrode) 특성을 가져야 함
○ 종류 1. 표준 수소 전극(SHE, standard hydrogen electrode)
○ 25 ℃에서 활동도가 1인 수소이온 용액이 접촉하고 있는 1기압의 수소 기체로 이루어진 반쪽 전지
○ 백금(Pt)은 반응에 참가하지 않고 단순 전자 전달체로서 사용됨
○ 종류 2. 기준 수소 전극(NHE, normal hydrogen electrode)
○ 25 ℃에서 1 M의 H+ 용액이 접촉하고 있는 1기압의 수소 기체로 이루어진 반쪽 전지
○ 종류 3. 포화 칼로멜 전극(SCE, saturated Calomel electrode)
○ KCl의 농도를 포화 상태로 유지함
○ 이유 1. 전극 전위가 염화 이온의 농도에 영향을 받아서 그것을 고정하기 위함
○ 이유 2. 전위를 SHE와 유사하게 만들기 위함
○ 종류 4. 은/염화은 전극 (Ag/AgCl electrode)
② 표준 전극 전위 (E°)
○ 25 ℃, 1기압에서 반쪽 전지의 수용액의 농도가 1 M일 때, 표준 수소전극을 (-)극으로 하여 얻은 반쪽 전지의 전위, 환원 반응을 기준으로 한 표준 환원 전위
○ 표준 환원 전위가 (+)이면 수소 이온보다 환원하기 쉽고, (-)이면 수소 이온보다 환원되기 어려움
○ 표준 산화 전위는 표준 환원 전위와 절대값은 같고, 부호만 반대
Table. 1. 표준환원전위 표
③ 표준 기전력 산출 : 한 개의 산화 반쪽 반응(E1°)과 한 개의 환원 반쪽 반응(E2°)이 있을 때,
○ 표준 기전력 = 환원 반쪽 반응의 환원 전위 + 산화 반쪽 반응의 산화 전위 = E2° - E1°
○ 표준 기전력이 양의 값이면 정반응이 자발적으로 진행되고, 음의 값이면 역반응이 자발적으로 진행됨
○ 팁. 복잡한 전극 문제는 인접한 산화 전극과 환원 전극을 묶어 하나의 전지처럼 표시하자.
⑵ 네른스트 방정식(Nernst equation) : 실제 전위에 관한 공식
① 전지 전압과 열역학 : 반응지수 Q에 대하여,

② 네른스트 방정식
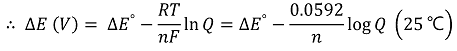
③ 전기 화학 장치를 이용한 평형상수의 측정

○ 평형상수의 정의
○ ΔG° < 0 ⇔ E° > 0 ⇔ K > 1
○ ΔG° < 0 ⇔ E° < 0 ⇔ K < 1
④ Eeq와 E°
○ 반쪽 전지에 대해서도 네른스트 방정식을 구성할 수 있음
○ An+ + ne- → A와 같은 형태를 고려할 때, 전자의 자유도 = 1이고 Q = [A] / [An+]로 설정
○ Eeq, E° 각각으로부터 예측한 두 반쪽 전지의 산화/환원 경향성이 서로 다름 : Eeq를 따라야 함
○ 예 : [Fe2+] = [Fe3+] = 0.1 M, [Ag+] = 10-5 M인 경우 Fe2+/Fe3+ 반쪽 전지는 환원, Ag/Ag+ 반쪽 전지는 산화
⑤ 응용 : 신경 휴지막 전위와 네른스트 방정식
⑶ 전극 내 반응
① 전극 간 반응
○ 예제 1. 반응지수 식의 구성
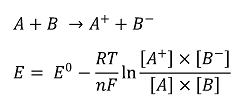
○ 예제 2. 전위차는 세기성질 : 환원전극 전위에서 산화전극 전위를 빼주면 됨
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s), ΔG = -212 kJ, Ecellº = +1.10 eV
2Zn(s) + 2Cu2+(aq) → 2Zn2+(aq) + 2Cu(s), ΔG = -424 kJ, Ecellº = +1.10 eV
② 전극 내 반응
○ 예제 1. Latimer diagram : 수학에서의 내분공식과 유사하게 전극 내 반응에서 환원전위 계산
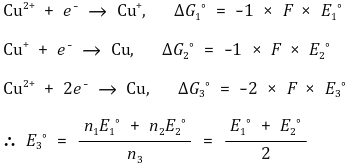
○ 예제 2. 리간드가 착물을 이루는 경우
○ 현상 1. 금속 이온과 리간드 사이에서 착물 형성을 잘할수록 (Kf가 클수록) E°complex는 더 음의 값을 가짐
○ 현상 2. 금속 이온과 리간드 사이에서 착물 형성을 잘할수록 전위가 감소함
○ 현상 2와 관련 [Au3+]의 양이 줄어들기 때문에 E = E° - (0.0592 / n) × log (1 / [Au3+])의 값이 감소하게 됨
○ 참고로, E° = 1.50 V인 상황과 Ecomplex° = 1.00 V인 상황은 동일한 상황이 아님

⑷ 배터리 임피던스 : EI(electrochemical impedance)라고도 함
① 개요 : 전기화학의 반응속도론적인 개념. 즉, 전류가 얼마인지에 대한 이론
○ electrolyte resistance (uncompensated resistance)
○ double layer capacitance (Cdl)
○ coating capacitance
○ Warburg impedance
○ charge transfer resistance (Rct)
○ constant phase element
○ virtual inductor
⑸ 실용전지
① 예 1. 연료전지 : 연속적으로 공급되는 연료로부터 전기에너지를 생산
○ 수소 연료전지
H2(g) + ½ O2(g) → H2O(ℓ), ΔH = -286 kJ
○ 메테인 연료전지
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ), ΔH = 561 kJ
② 실용전지의 용량(ampere-hour rating)
○ 각 화학전지의 전압은 일정하므로 전류량(단위 : Ah, mAh)으로 표시
○ 전지의 수명

○ 화학전지의 용량은 전류량이 많아지면 줄고, 상온보다 높거나 낮으면 줆 (상온 24 ℃ = 75.2 ℉)
Figure. 1. 온도, 방출시간, 방출전류에 따른 화학전지 용량
⑹ 농도차 전지
① 정의 : 산화전극과 환원전극이 동일한 화학반응을 이용하는 경우
② 엔트로피 해석 : 금속이온의 농도가 높은 전극은 환원하려고 하고, 낮은 전극은 산화해서 무질서도를 높임
③ 전압 계산 : 보통 다음과 같은 형태를 취함

4. 전기분해 [목차]
⑴ 물의 전기분해 : 표준조건 (pH 0)
① 양극 반응(산화전극)
○ 산 조건
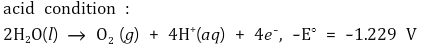
○ 염기 조건
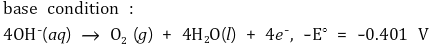
② 음극 반응(환원전극)
○ 산 조건
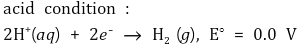
○ 염기 조건
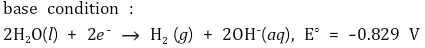
③ 물의 전기분해 반응식은 암기해야 하는 게 아니라 유도해야 하는 것임
④ 실제로는 두 전극 사이에 전위강하가 생겨서 과전위(overpotential)를 고려해야 함
○ 반응식 예
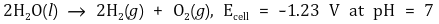
○ 1.23 V보다 약간 더 많은 전압을 인가해야 전기분해가 일어남
⑵ 수용액의 전기분해
① 염화나트륨(NaCl) 수용액의 전기분해
○ 염화나트륨과 물의 분해 반응

○ 양극 반응 : 산화 전위는 물 또는 수산화 이온이 높으나 실질적인 이유로 염소 이온이 산화함
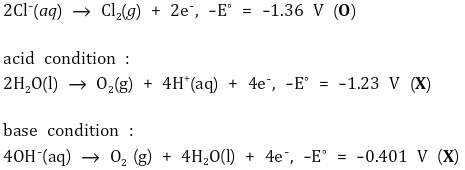
○ 실질적인 이유 : 반응속도론적 요인, 실험상의 요인 (예 : 과전위)
○ 음극 반응 : 환원 전위는 수소 이온이 나트륨 이온보다 높아 수소 이온이 환원함
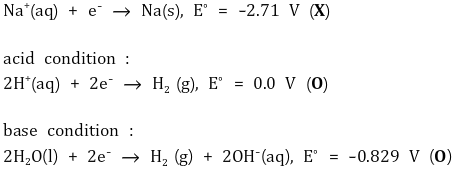
② 황산구리(CuSO4) 수용액의 전기분해
○ 황산구리와 물의 분해 반응
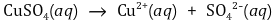
○ 양극 반응 : 황산 이온은 산화되기 어려워 수산화 이온이 산화됨

○ 음극 반응 : 구리 이온이 수소 이온보다 전자를 받아들이기 쉬움
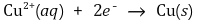
③ 부식(corrosion) : 원하지 않는 금속의 산화
○ 반응식
○ 물의 환원반응 1.
2H2O(ℓ) + 2e- → H2(g) + 2OH-(aq), Eº = -0.83 V
○ 물의 환원반응 2.
O2(g) + 4H+(aq) + 4e- → 2H2O(ℓ), PO2 = 0.2 bar, Eº = 1.23 V
○ 철의 산화반응 1.
Fe2+(aq) + 2e- → Fe, Eº = -0.44 V
○ 철의 산화반응 2.
Fe3+ + e- → Fe2+, Eº = 0.77 V
○ 혐기성 조건
○ 물의 환원반응 2는 일어나지 않음
○ pH = 7에서 물의 환원반응 1은 E = -0.42 V임
○ -0.42 V와 -0.44 V와의 전위차는 0.02 V에 불과하므로 철의 부식이 활발히 일어나지 않음
○ 호기성 조건
○ 물의 환원반응 2가 물의 환원반응 1보다 활발히 일어남
○ 1.23 V는 -0.44 V, 0.77 V보다 크므로 철의 산화반응 1과 2가 모두 일어남
○ 철의 부식이 활발히 일어나며 최종적으로 Fe3+로 산화함
○ 응용 1. 부식은 일반적으로 오래 걸림
○ 응용 2. 부식 방지책
○ coating : 페인트로 코팅
○ galvanization : 이온화가 잘 되는 금속으로 도금 (도금된 금속이 대신 산화하므로 시간을 벎)
○ sacrificial anode (cathodic protection)
⑶ 전기분해 반응 선택
① 반응 참가물질 : Ni2+, Zn2+, H2O, SO42-
② 산화반응 참가물질 : H2O (-1.23 V) , SO42- (-2.01 V)
○ 산화 우선순위 : H2O (-1.23 V) > SO42- (-2.01 V)
○ 산화반응 선택 : H2O
③ 환원반응 참가물질 : Ni2+ (-0.25 V), Zn2+ (-0.76 V), H2O (-0.83 V)
○ 환원 우선순위 : Ni2+ (-0.25 V) > Zn2+ (-0.76 V) > H2O (-0.83 V)
○ 환원반응선택 : Ni2+
⑷ 전기분해의 이용
① 전기도금(electropainting) : 금속의 부식을 막기 위해 금속의 표면을 다른 금속으로 얇게 입히는 것
○ (+)극 (산화전극) : 도금할 물체를 포함한 염의 수용액과 연결
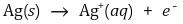
○ (-)극 (환원전극) : 전기도금이 될 물질을 연결
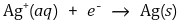
② 구리 정제 : Zn, Fe, Ag, Au, Pt의 불순물이 소량 섞여 있는 구리 금속을 정제하여 순수한 구리 금속을 얻을 때
○ (+)극 : 불순물이 포함된 구리
○ (-)극 : 순수한 구리 전극
○ 전해질 : 구리 이온이 포함된 용액
○ Zn, Fe는 이온화경향이 커서 음극에 석출되지 않고, Ag, Au, Pt는 물에 녹지 않고 바닥에 떨어짐
③ 수산화나트륨 제조 : 염화나트륨 수용액을 전기분해하면 음극 부근에서 수산화나트륨 생성

○ 양극에서 발생한 염소는 수산화나트륨과 반응을 일으켜 격리가 필요
④ 경금속 제련
○ 개요
○ 나트륨, 마그네슘, 알루미늄 등의 경금속(비중 4 이하)은 화학결합이 강함 → 바로 분리할 수는 없음
○ 그 화합물로부터 금속을 얻을 때는 용융상태로 한 다음, 이를 전기분해하여 금속을 분리함
○ 예 1. 홀-에루 공정(Hall-Héroult process) : 마그네슘 제련
○ 예 2. 다우 공정(Dau process) : 융해된 MgCl2로부터 마그네슘을 분리하는 상업적 공정과정
○ (+)극 (산화전극)
2Cl-(melt) → Cl2(g) + 2e-
○ (-)극 (환원전극)
Mg2+(melt) + 2e- → Mg(ℓ)
입력: 2018.12.28 15:01
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 18강. 산·염기 반응 (16) | 2018.12.27 |
|---|---|
| 【화학】 17강. 화학평형 (3) | 2018.12.27 |
| 【화학】 14강. 산화환원반응 (0) | 2018.12.27 |
| 【화학】 13-1강. 열역학 과정과 카르노 순환 (8) | 2018.12.27 |
| 【화학】 13강. 열역학 (42) | 2018.12.27 |







최근댓글