13-1강. 열역학 과정과 카르노 순환
추천글 : 【화학】 13강. 열역학
1. 등압과정, 등적과정, 등온과정, 단열과정 [본문]
2. 카르노순환 [본문]
1. 등압과정, 등적과정, 등온과정, 단열과정 [목차]
| 등압과정 | 등적과정 | 등온과정 | 단열과정 | |
| ΔU | (3/2) nRΔT = (3/2) P(V2 - V1) |
(3/2) nRΔT = (3/2) V(P2 - P1) |
0 | (3/2) nR(T2 - T1) |
| W | P(V2 - V1) | 0 | nRT ln(V2/V1) | (3/2)nR (T1 - T2) = -W |
| Q = ΔU + W | (5/2) P(V2 - V1) | (3/2) V(P2 - P1) | nRT ln(V2/V1) | 0 |
| dS = dQ/T | (3/2) nR (dT/T) + nR (dV/V) |
(3/2) nR (dT/T) | ΔS = ΔQ / T | 0 |
| ΔS | (5/2) nR ln(T2/T1) | (3/2) nR ln(T2/T1) | nR ln(V2/V1) | 0 |
Table. 1. 등압과정, 등적과정, 등온과정, 단열과정
⑴ 단, 단원자기체로 가정하여 Cv = 3/2, CP = 5/2
⑵ 단, Q > 0은 계가 밖으로 하는 일을 의미 (여기서는 화학적 부호 대신 물리적 부호를 채택)
⑶ 단열과정의 경우 "TV⅔ = 일정" 혹은 "PV(1+⅔) = 일정"을 통해서 계산
2. 카르노순환(Carnot cycle) [목차]
⑴ 카르노순환 : 가역반응으로만 이루어짐
Figure. 1. 카르노순환 P-V 선도
Figure. 2. 카르노순환 T-S 선도
① 등온과정은 매우 느린 반응(t → ∞)에 대해 가역반응
② 1단계. 등온가역팽창(TH, PA, VA → TH, PB, VB)
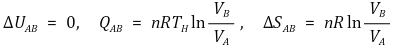
③ 2단계. 단열가역팽창(TH, PB, VB → TC, PC, VC)
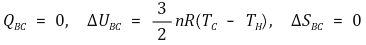
④ 3단계. 등온가역압축(TC, PC, VC → TC, PD, VD)
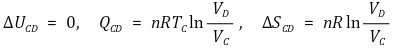
⑤ 4단계. 단열가역압축(TC, PD, VD → TH, PA, VA)
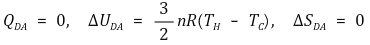
⑵ 엔트로피가 상태함수임을 확인
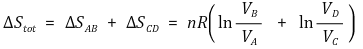
그런데, 2단계와 4단계의 단열과정 식을 적용하면 다음을 얻는다.
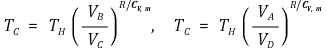
그 결과 다음이 성립한다.
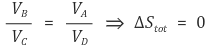
⑶ 카르노기관의 열효율
ε = 행해진 일 ÷ 열원으로부터 흡수된 열 = Wtot / QAB
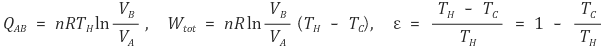
⑷ 카르노 정리
① 두 열원 사이에서 동작하는 모든 가역기관은 같은 효율을 가짐 (B, D가 임의적임을 상기하면 됨)
② 두 열원 사이에서 동작하는 순환 열기관 중 가역기관보다 높은 효율을 갖는 것은 없음
입력: 2019.03.30 14:15
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 15강. 전기화학 (48) | 2018.12.27 |
|---|---|
| 【화학】 14강. 산화환원반응 (0) | 2018.12.27 |
| 【화학】 13강. 열역학 (42) | 2018.12.27 |
| 【화학】 11강. 용액 (0) | 2018.12.27 |
| 【화학】 10강. 액체와 고체 (4) | 2018.12.27 |





최근댓글