2강. 전원(electric power source)
추천글 : 【회로이론】 회로이론 목차
1. 전원 [목차]
⑴ 전원(electric power source) : 실제 전원을 근사적으로 이상 전원으로 간주하여 회로를 해석
2. 전압원(voltage source) [목차]
⑴ 개요
① 정의 : 특정 조건을 만족하면 일정한 전압을 제공하는 전원
② 전압원은 내부 저항이 작을수록 좋음
⑵ 분류
① 독립전압원(independent voltage source) : 항상 일정한 전압을 제공하는 전압원

② 종속전압원(dependent voltage source) : 외부 회로 조건에 따른 전압을 제공하는 전압원
○ 예 : 일부 트랜지스터

○ VCVS(voltage-controlled voltage source) : 좌측
○ CCVS(current-controlled voltage source) : 우측
⑶ 실제 전압원(practical voltage source, non-ideal voltage source)

⑷ 화학전지(battery)
① 정의 : 화학반응의 퍼텐셜을 이용하여 일정한 전압을 제공하는 전압원
② 구성 요소, 용량, 갈바니 전지
③ 수은전지
○ 반응식
(-) Zn-Hg 아말감 | HgO + KOH | HgO, E0 = 1.3 V
(+) : HgO + H2O + 2e- → Hg + 2OH-
(-) : Zn + 2OH- → Zn(OH)2 + 2e-
○ 특징 : 단추 모양, 크기가 매우 작음, 전압 일정, 1차 전지
○ 단점 : 수은이 생성되므로 환경 오염을 발생
④ 볼타전지(Voltaic cell)
○ 반응식
(-) Zn | H2SO4(aq) | Cu (+), E0 = 1.10 V
(+) : Cu2+(aq) + 2e- → Cu(s)↓, E0 = 0.34 V
(+) : 2H+(aq) + 2e- → H2(g)↑
(-) : Zn(s) → Zn2+ + 2e-, E0 = -0.76V
○ 분극 현상 : 구리판에서 발생하는 수소 기체가 구리판을 둘러싸서 환원 반응을 방해하여 기전력이 급락
○ 감극제(소극제) : 분극 현상을 제거하기 위하여 사용하는 산화제, 수소 기체를 물로 산화
○ 예 : H2O2, MnO2, KMnO4, K2Cr2O7
⑤ 다니엘전지(Daniel cell)
○ 반응식
(-) Zn | ZnSO4(aq) | CuSO4(aq) | Cu (+), E0 = 1.10 V
(+) : Cu2+(aq) + 2e- → Cu(s)↓, E0 = 0.34 V
(-) : Zn(s) → Zn2+(aq) + 2e-, E0 = -0.76 V
○ 기체가 발생하지 않으므로 분극 현상이 나타나지 않음
○ 염다리
○ 다니엘 전지에서는 반드시 염다리로 연결해 주어야 함
○ KCl이나 KNO3 등을 한천과 함께 녹인 후 끓여서 U자관에 넣고 식혀 만든 것
○ 이온들의 이동통로가 되어 전체 회로를 연결시키고 전해질의 전하가 균형을 이루도록 함
⑥ 망간-아연전지
○ 반응식
(-) Zn | NHO4Cl 포화용액 | MnO2, E0 = 1.5 V
(+) C막대 : 2MnO2 + 2NH4+ + 2e- → Mn2O3 + 2NH3 + H2O
(-) 아연판 : Zn → Zn2+ + 2e-
○ 특징 : 염다리가 필요 없으며 기전력은 약 1.5 V로 약산인 전해질로 인해 수명이 짧음
⑦ 알칼리전지(alkaline-MnO2 cell) : 1차 전지, 가장 보편적
○ 반응식
(-) Zn | KON | MnO2, C (+), E0 = 1.43 V
(+) 아연판 : 2MnO2(s) + H2O(l) + 2e- → Mn2O3(s)↓ + 2OH-(aq), E0 = 0.15 V
(-) C막대 : Zn(s) + 2OH-(aq) → ZnO(s)↓ + H2O(l) + 2e-, E0 = -1.28 V
○ 최초로 일정한 전압을 출력하는 전지 : 생성물이 모두 고체이므로
○ 망간-아연 건전지보다 수명도 긺
○ 전압 : MnO2의 순도에 따라 새 알칼리 전지의 전압은 1.50 ~ 1.65 V 정도
○ 공칭전압 : 1.2 V/cells
○ 공칭용량 : 5 Ah
○ 배터리가 완전히 전력을 방출할 즈음의 전압은 0.90 ~ 1.0 V 정도
○ energizer의 구조와 종류, 가용범위
Figure. 2. Energizer의 구조와 종류, 가용범위
⑧ 납축전지(lead-acid cell) : 2차 전지, 자동차, 잠수함
○ 반응식
(-) Pb | H2SO4 | PbO2 (+), E0 = 2.05 V
(+) 산화납판 : PbO2(s) + HSO4-(aq) + 3H+(aq) + 2e- → PbSO4(s)↓ + 2H2O(l), E0 = 1.685 V
(-) 납판 : Pb(s) + HSO4-(aq) → PbSO4(s) + H+(aq) + 2e-, E0 = -0.365 V
○ 전압 : 산성도 등으로 다양한 cell이 있고, 대개 2.10 V, 방전 시 1.95 V이다.
○ 공칭전압 : 2.0 V/cells
○ 공칭용량 : 10 Ah
○ 여러 개를 직렬로 연결하여 12 V, 24 V로 만들어 사용
○ SG가 1.30이면 정상, 1.1정도면 충전 필요
○ 축전지의 전력을 전부 써 버리면 충전이 불가능할 수도 있음
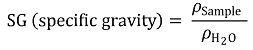
○ 충전하기 위해서는 직류 전원이 필요하고, 전압원, 전류원 모두 가능
○ 방전이 일어나면 두 전극의 질량은 점점 증가(방전)하고 황산용액의 농도는 묽어짐
○ 충전 : 외부에서 직류 전원으로 역반응이 진행되도록 전류를 흘려 주면 황산의 농도가 진해지며 기전력 회복
○ 축전지의 전압이 1.8 V 이하로 떨어지기 전에 충전을 해주어야 함
○ (+)극인 PbO2는 감극제의 역할도 겸하고 있음
○ 납축전지의 구조
⑨ 축전지 일반
○ 축전지 : 정류장치에 의해 변환된 직류 전력을 저장
○ 축전지 설비 구성 요소 : 축전지, 충전 장치, 보안 장치, 제어 장치
○ 축전지 용량 공식 : C = K × I / L
○ C : 축전지의 용량 (Ah), L : 보수율(경년용량 저하율), K : 용량환산 시간 계수, I : 방전 전류 (A)
○ 충전방식
○ 초기 충전 : 미충전 상태의 축전지에 전해액을 주입하는, 처음으로 행하는 충전
○ 보통 충전 : 필요할 때마다 표준 시간율로 소정의 충전을 하는 방식
○ 급속 충전 : 비교적 단시간에 보통 전류의 2 ~ 3배의 전류로 충전하는 방식
○ 부동 충전 : 충전기 - 축전지의 자기방전 보충, 부하 전력 공급, 축전지 - 일시적인 대전류 부하 등 부담
○ 부동 충전의 개선된 방법으로 세류 충전과 균등 충전이 있음
○ 충전기 2차 전류 (A) = 축전지 용량 (Ah) / 정격 방전율 (h) + 상시 부하 용량 (VA) / 표준전압 (V)
Figure. 4. 부동충전
○ 회복 충전
○ sulfation 현상 : 납축전지에 해당
○ 원인 : 방전 상태에서 장시간 방치, 방전 전류↑↑, 불충분한 충전 반복
○ 현상 : 극판이 회백색으로 변하고 휘어짐, 충전시 전해액 온도 상승↑, 비중 상승↓, 가스 발생↑
○ 알칼리 축전지의 특성
○ 장점 : 수명↑, 진동과 충격에 강함, 충·방전특성이 양호, 방전시 전압변동↓, 사용온도 범위↑
○ 단점 : 납축전지보다 공칭전압↓, 가격↑
⑩ Ni-Cad 전지(nickel-cadmium cell) : 2차 전지, 요즘 사용하지 않음 (∵ 중금속의 독성 때문)
○ 반응식
(-) Cd | KOH | NiO(OH) (+), E0 = 1.40 V
(+) : NiO(OH)(s) + H2O(l) + e- → Ni(OH)2(s) + OH-(aq), E0 = 0.52 V
(-) : Cd(s) + 2OH-(aq) → Cd(OH)2(s)↓ + 2e-, E0 = -0.88 V
○ 전압 : 알칼리전지의 1.5 V보다 작은 1.2 V를 지속적으로 유지
○ 4000 충전/방전 사이클을 지나면 사용할 수 없음
○ 메모리 효과 : Ni로 인해 100% 쓰지 않고 충전 시 고용체가 생겨 용량이 줆
○ Ni-Cad 전지는 충전할 때 정 전류원으로 충전해야 함
○ Ni-Cad 전지의 종류
⑪ 연료전지
○ 전체반응 : H2(g) + 1/2 O2(g) → H2O(l), E0 = 1.23 V
(+) : 1/2 O2(g) + H2O(l) + 2e- → 2OH-(aq)
(-) : H2(g) + 2OH-(aq) → 2H2O(l) + 2e-
○ 연료가 전기 화학적으로 반응하여 전기를 생산하는 과정에서 열도 발생하므로 총 효율을 80 % 이상으로 높임
○ 열기관의 효율은 전형적으로 25-30 %
○ 전지의 특징 : 소음 ×, 친환경
⑫ 리튬 이온 전지(lithium-ion battery)
○ 전체 반응 : LiCoO2(s) + 6C(s) → CoO2(s) + LiC6(s)
(+) : Li+(aq) + 6C(s) + e- → LiC6(s)
(-) : LiCoO2(s) → CoO2(s) + Li+(aq) + e-
○ 리튬(Li)의 장점 : 매우 가벼움. 표준 환원 전위가 낮음. 재충전이 용이함 → 2차 전지로 사용
○ 전지의 특징 : 3.6 V 정도로 높은 전압. 질량 에너지 밀도가 약 160 Wh/kg으로 매우 높음. 염다리가 필요하지 않음
○ Li+(aq)가 anode에서 cathode로 이동하기 위해서 전해질 및 분리막이 사용됨
○ 구성
○ 전극 (양극, 음극) : 두 전극의 재료로 주로 LiCoO2와 흑연(C흑연)을 사용
○ 전해질 : 리튬염을 석유에 녹여 사용
○ 충전 시 전해질을 통하여 리튬 이온이 이동하여 흑연의 층간에 삽입됨
○ 방전 시 충전의 역과정이 자발적으로 일어나며, 전자는 외부 회로를 통해 이동
○ 리튬이온 배터리 양극 활물질의 종류
○ 종류 1. LCO
○ 활물질 : LiCoO2
○ 타입 : 코발트계
○ 우수 특성 : 용량
○ 단점 : 출력/안전성
○ 적용 제품 : IT
○ 종류 2. NCM
○ 활물질 : Li[NiCoMn]O2
○ 타입 : 삼원계
○ 우수 특성 : 용량
○ 단점 : 출력/안전성
○ 적용 제품 : EV, ESS
○ 종류 3. NCA
○ 활물질 : Li[NiCoAl]O2
○ 타입 : 삼원계
○ 우수 특성 : 용량/출력
○ 단점 : 안전성
○ 적용 제품 : Non-IT, EV
○ 하이니켈 : NCA의 니켈 함유량이 90% 이상인 양극재로 원가 비중이 큰 코발트를 대체하기 위한 방법으로 주목됨
○ 종류 4. LMO
○ 활물질 : LiMn2O
○ 타입 : 망간계
○ 우수 특성 : 출력
○ 단점 : 용량
○ 적용 제품 : Non-IT, ESS
○ 종류 5. LFP
○ 활물질 : LiFePO4
○ 타입 : 인산철계
○ 우수 특성 : 안전성
○ 단점 : 용량
○ 적용 제품 : Non-IT, EV
⑬ 그 밖의 전지들
○ Lithium-MnO2 cell : 1차 전지, 메모리 백업 배터리
○ zinc air cell : 1차 전지, 공기가 전해질, 보청기, 의료 모니터링 장비
○ silver oxide cell : 1차 전지, 손목 시계
○ lithium-iodine cell : 1차 전지, 장기간 회로보드 전원, 인공심장에 있는 pacemaker
Figure. 7. lithium-iodine cell
○ nickel-metal hydride cell : 2차 전지, 휴대용 장치 (휴대용 컴퓨터, 휴대폰 등)
○ lithium ion & LiPo cell : 2차 전지, 음극(리튬)-양극(탄소), 전기자동차, 휴대폰, 드론
○ 전고체 배터리 : 액체 전해질을 고체로 만들어서 안정성을 높이는 것
○ 셀 밸런싱 : 직렬로 연결된 셀 간의 전압 차이를 맞추는 것
⑸ 태양전지(solar cell) : 광전효과(photovoltaic effect)를 이용
① 1st. P형과 N형 반도체를 맞붙이면 PN 접합 주위에 N → P의 전기장 발생
② 2nd. 반도체 내에 전자가 쌓이지 않고 흘러나올 수 있도록 도선을 연결
③ 3rd. N형 반도체 쪽으로 빛을 쬐어주면 PN 접합에서 전자가 P → N으로 이동
④ 4th. inverter로 직류 전류를 교류 전류로 바꾸어 줌
⑹ 직류 발전기(DC voltage generator) : 패러데이 전자유도 법칙을 이용
Figure. 9. 직류 발전기
Figure. 10. 직류 발전기
⑺ 전원 공급 장치(electronic power supplies by eectification)
① AC → DC
② 전원 공급 장치의 구조 : (오른쪽) 위에서부터 전압 조동나사, 전압 미동나사, Current Limit Checker, 스위치 배치
③ 단자의 종류
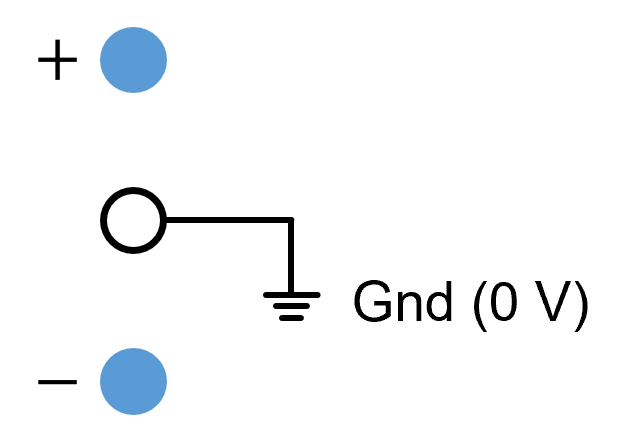
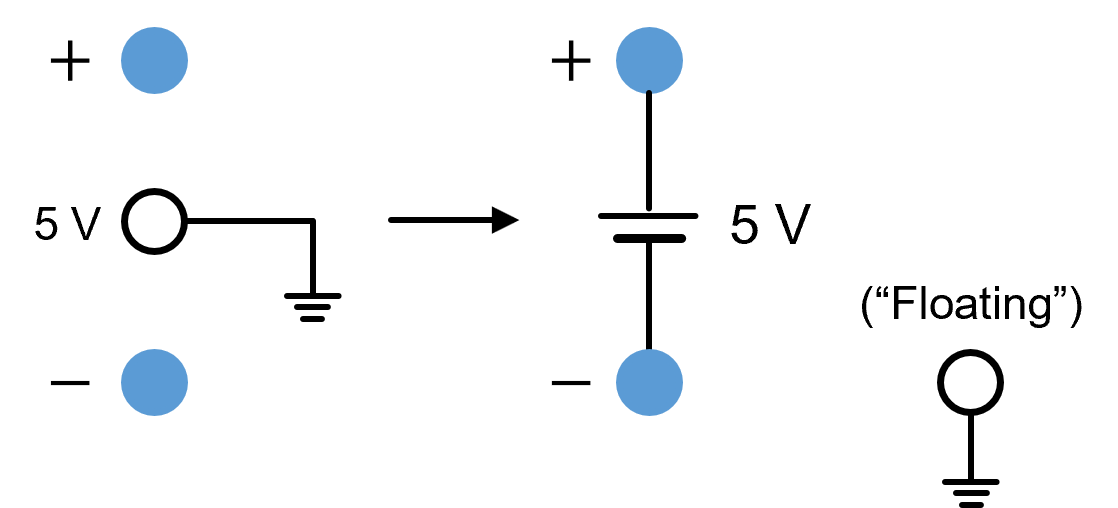
④ (-) 단자와 접지단자 연결 : 전압은 10 V로 조절

⑤ (+) 단자와 접지단자 연결 : 전압은 15 V로 조절

⑥ floating supply : 접지단자가 어느 단자와도 미 연결 시 각 단자로 감전의 위험
○ 공기 중의 전하로 인해 10 V로 조절해도 200 V/210 V처럼 될 수 있음
⑦ 무정전 전원공급장치(UPS, uninterruptible power supply)
○ UPS : 입력 전원에 이상 상태가 발생 시 정상적으로 부하측에 전력을 공급하는 설비
○ 블록 다이어그램
○ 컨버터(정류 장치, converter) : 교류를 직류로 변환
○ 인버터(역변환 장치, Inverter) : 직류를 상용 주파수의 교류 전압으로 변환
⑻ 열전지(써모커플, thermocouple)
① 제벡효과(열전현상, Seebeck effect) : 초전성이라고도 함
○ 정의 : 두 종류의 도체 또는 반도체의 한쪽 끝을 접합시킨 뒤 양 말단에 온도차를 가하면 기전력이 발생하는 현상
○ 유사 개념 : Peltier effect, Thomson effect
○ 원인 : 고온부의 전자 및 정공은 높은 에너지를 가지므로 해당 위치에서 이탈할 가능성이 높음
○ 각 물질은 서로 다른 전압값을 가지는 전지로 간주할 수 있음 → 알짜 전류가 생성됨
○ (주석) 저항이 낮은 물질은 퍼텐셜 차이가 작지 않을까 추정 (아닐 수도 있음)
○ 1821년 Thomas S. Seebeck에 의해 발견
② 대개 한 쪽 끝을 얼음물(0 ℃)에 담가 온도 센서로 이용함
○ 열기전력의 크기와 극성은 금속선의 굵기 또는 길이에 영향을 받지 않음
○ 제백계수 : 온도차 1 ℃당 열기전력
③ 종류
○ Bi와 Sb 박막 다결정 실리콘 등을 재료로 함
○ K type : chromel과 alumel
○ 그 외 : E, J, N, B, R, S
④ 실제 전원으로 사용하기에는 너무 약함
Figure. 13. 써모커플의 예
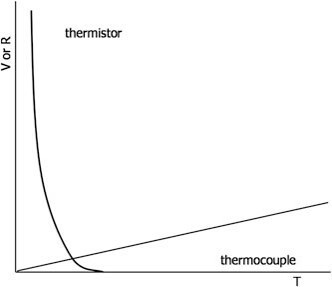
⑤ 써모커플은 써미스터보다 더 넓은 범위에 대해서도 사용할 수 있음
Figure. 14. 써모커플과 써미스터의 비교
⑼ 압전지(piezoelectric sensors)
① 압전효과(piezoelectric effect)
Figure. 15. 압전효과
○ 정의 : 압력을 받으면 특정 결정에 변형이 생겨 분극전압이 생기는 현상
○ 압전성이라고도 함
○ 예 : 석영(quartz), 세라믹(ceramic), 황화카드뮴, 갈륨비소화합물 반도체
○ 응용 : 가스레인지 검화, 로드셀, 마이크로폰, 스피커 등
② 압력센서, 힘 센서, 가속도계, 초음파 등에 사용됨
③ Sauerbrey equation
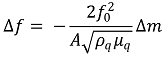
○ f0 : resonant frequency (Hz)
○ Δf : frequency change (Hz)
○ Δm : loaded mass (g)
○ A : piezoelectrically active area (electrode area) of crystal (㎠)
○ ρq : density of quartz (2.648 g/㎤)
○ μq : shear modulus of AT-cut quartz crystal (2.947 × 1011 g/㎠·s2)
○ vq : transverse wave velocity in quartz (m/s)
④ (참고) 압저항효과(piezo resistive phenomena)
○ 압력이나 응력에 의해 저항 값이 변하는 현상
○ 일반적으로 압력을 받으면 저항이 증가
3. 전류원(current source) [목차]
⑴ 개요
① 정의 : 특정 조건을 만족하면 일정한 전류를 제공하는 전원
② 전류원은 내부저항이 클수록 좋음 : 다른 저항이 와도 전류의 크기가 잘 변하지 않기 위해
⑵ 분류
① 독립전류원(independent voltage source) : 항상 일정한 전류를 제공하는 전류원

② 종속전류원(dependent voltage source) : 외부 회로 조건에 따른 전류를 제공하는 전류원

○ CCCS(current-controlled current source) : 좌측
○ VCCS(voltage-controlled current source) : 우측
⑶ 실제 전류원(practical current source, non-ideal current source)

⑷ 트랜지스터(transistor)
① 어떤 트랜지스터들은 특정 전압 이상에서 전류원으로서 기능한다.
② 전압-전류 그래프

③ 등가회로
Figure. 18. 전류원 등가회로
④ 응용 : 정전류 충전기(constant-current battery chargers)
○ 정류기를 이용해서 교류 전원을 직류로 바꾸어 주는 회로를 가지고 있음
○ 장점 1. 정전압의 경우 충전 시간이 굉장히 길어짐
○ 장점 2. 납축전지와 달리 휴대폰 배터리의 경우 전류가 요동치면 고장이 남
입력: 2015.12.29 18:57
수정: 2022.09.11 16:14
'▶ 자연과학 > ▷ 회로이론' 카테고리의 다른 글
| 【회로이론】 5강. 스위치, 퓨즈, 접지, d'Arsonval meter (0) | 2016.06.27 |
|---|---|
| 【회로이론】 3강. 저항 (0) | 2016.06.27 |
| 【회로이론】 1강. 회로이론의 기본 (0) | 2016.06.27 |
| 【회로이론】 센서의 종류 (0) | 2016.06.21 |
| 【회로이론】 6-7강. LC 회로의 진동 (0) | 2016.06.21 |

















최근댓글