28강. 분광학(spectroscopy)
추천글 : 【유기화학】 유기화학 목차
1. 개요 [본문]
2. 질량 분석법 [본문]
3. 적외선 분광법 [본문]
4. 자외선-가시광선 분광법 [본문]
5. 핵자기 공명 분광법 [본문]
6. 라만 분광법 [본문]
7. 기타 분광법 [본문]
8. 분광기기의 설계 [본문]
a. 분광학 예제
1. 개요 [목차]
⑴ 광전자 분광법 : X선에 의한 전자 전이를 관찰
⑵ 라만 분광법 : 가시광선 레이저를 쏘고 그 파장의 변화를 관찰
⑶ 적외선 분광법 : 적외선에 의한 분자의 진동을 관찰. 적외선을 입사한 후 동일한 파장의 적외선이 얼마나 흡수되는지 관찰
⑷ 마이크로파 분광법 : 마이크로파에 의한 분자의 회전을 관찰
⑸ 핵자기 공명법 : 라디오파에 의한 핵스핀 전이를 관찰
⑹ 분광학 문제 풀이 팁
① 불포화도부터 고려해야 함 : 불포화도가 4 이상이라면 벤젠 고리의 존재가 강하게 추정됨
② 1H NMR 위주로 문제를 푸는 게 권장됨 : 수학문제 풀듯이 풀 수 있고 상당히 많은 정보가 제공됨
③ 화학식을 통해 경우의 수를 추리는 식으로 푸는 게 권장됨
④ 좌우대칭성을 활용하여 문제를 정말 쉽게 풀 수 있음
⑤ 알켄의 cis / trans도 1H NMR 상에서 구별됨
⑥ 동일한 탄소에 붙어 있는 수소라도 입체배열에 따라 1H NMR에서 다른 chemical shift 값(ppm)을 가질 수 있음
2. 질량 분석법(mass spectroscopy, MS) [목차]
⑴ 원리
① 1st. entrance region
○ 1-1. 샘플 내 분자들을 입사함 : 분자들은 거의 다 중성
○ 1-2. 분자들은 양의 전위를 갖는 금속 판을 통과함
② 2nd. ionization region
○ 2-1. 질량분석기에서 전자빔(electron beam)을 통해 70 eV 에너지를 갖는 전자를 쏨
○ 2-2. 이온화 단계(ionization) : 고에너지 전자와 충돌한 유기분자는 전자를 하나 잃고 분자이온을 생성
○ 분자이온의 질량 = 분자량
○ 분자이온은 라디칼 형태를 취함 : M+ㆍ와 같이 표현할 수 있음
○ 2-3. 조각화(토막내기, fragmentation) : 분자이온은 매우 불안정하여 라디칼 부분과 양전하를 띠는 부분으로 분해
○ 작용기의 종류에 따라 선호하는 조각화 반응이 존재함
○ 폴리펩티드의 조각화 : b는 NH2가 말단인 fragment를 의미하고, y는 -COOH가 말단인 fragment를 의미함
○ 두 피크가 정확히 28 Da 만큼 차이나는 경우 a-b pair 혹은 x-y pair일 것으로 추정
○ a 이온은 b 이온보다 더 적은 빈도로 나타남 : C≡O+는 C=N+보다 불안정하기 때문
○ 2-4. 1가, 2가 등 여러 이온이 발생 : 대체로 1가 이온이 생성
③ 3rd. acceleration region
○ 3-1. 각각 0과 음의 전위를 갖는 금속판들 때문에 앞의 양의 전위를 띠는 금속판과 함께 전기장이 형성됨
○ 3-2. 양전하 분자들은 전기장에 따라 점점 가속화됨
○ 오직 양전하 화학종만이 recorder에 도달

④ 4th. drift region
○ 양전하 분자들이 음의 전위를 갖는 금속판을 통과하면 전기장이 걸리지 않는 drift region 상에서 직선으로 운동
⑤ 5th. detector region
○ 종류 1. reflectron mode : Figure. 1.이 해당
○ 원리 : 로렌츠 힘
○ 즉, 이온들을 자기장에 통과시키면 m/z에 따라 다르게 detector에 도달할 수 있음
○ 종류 2. linear mode
○ 대표적으로 QMS(quadruple mass spectrometry)가 있음
○ QMS에서는 RF를 통해 진동하는 전기장을 제공하여 m/z에 따라 다르게 detector에 도달할 수 있음
○ 원리 1. TOF(time-of-flight) mass analyzer
○ m/z에 따라 이온들이 detector에 도달하는 시간이 달라지는 원리를 이용
○ 즉, 질량이 작은 이온이 질량이 큰 이온보다 detector에 더 빠르게 도달함
○ 장점 : 염이나 다른 오염원의 영향이 적음
○ 단점 : m/z = 200일 때 질량 해상도를 60,000까지 할 수 있음
○ 원리 2. FT-ICR-MS(Fourier transform ion cyclotron resonance mass spectrometer)
○ Penning ion trap을 이용하여 m/z 값을 구할 수 있음
○ 사이클로트론에서 전하를 띤 입자가 자기장 하에서 특정 각진동수로 회전 운동을 하게 됨을 이용함 (원리 : 로렌츠 힘)
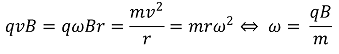
○ 시간에 따른 진동 신호를 FFT를 활용해 mass spectrum으로 변환
○ 장점 : 질량 해상도를 1,000,000까지 할 수 있음
○ 단점 : 해상도가 높아 direct sample infusion을 요하고 속도가 느림
○ 원리 3. orbitrap
○ FT-ICR-MS와 유사하게 ion trap (barrel 형태) 안에서 이온들을 진동시키며 시간에 따른 진동 신호를 FFT를 활용해 변환
○ FT-ICR-MS와 달리 자기장이 아닌 안쪽 전극과 바깥쪽 전극 사이에 형성된 전기장을 이용함
○ 질량 해상도를 240,000까지 할 수 있음
○ 원리 4. LC(liquid chromatography) analyzer
○ LC에서 retention time에 따라 혼합물을 분리한 후, 분리된 물질을 이온화해서 질량분석을 통해 m/z를 결정
○ retention time과 m/z 값을 통해 2차원 이미지를 구성해 더 정확한 분석을 할 수 있음
○ 종류 : LC Q-TOF, Orbitrap LC/MS, TQ LC/MS, DIA(data-independent acquisition)
○ 전체 m/z가 아니라 특정 m/z만을 선택적으로 받아들일 수도 있음 (예 : MS/MS)
○ 한 순물질도 여러 이온을 만듦으로 여러 m/z를 가질 수 있음 : deconvolution 알고리즘을 통해 single peak으로 만듦
⑵ 질량 분석의 해석
① 질량 분석에서 가장 높은 피크를 주 피크(base peak)라고 함
② 주 피크 세기를 100으로 정하고 나머지를 상대값으로 측정
③ m/z의 예시 : 양전하 화학종이 안정할수록 피크가 크게 나타남
④ 질소 규칙(nitrogen rule)
○ C, H, O의 원소들로 이루어진 탄화 수소는 항상 짝수의 분자량을 가지기 때문에 분자이온도 짝수임
○ 유기분자에서 홀수의 분자 이온의 수치가 나타났다면 홀수 개의 질소 원자를 포함한다고 볼 수 있음
○ 예시 : 위 그림에서 m/z가 홀수인 것은 proton transfer를 고려하지 않았기 때문 (MALDI-TOF 참고)
○ CH4 : 16
○ CnH2n+2 : 짝수
○ CnH2n : 짝수
○ CnH2n-2 : 짝수
○ -H를 -OH, -F, -Cl, -Br, -I, -SH, -SiH3 치환기로 대체한 경우 : 짝수
○ -H를 -NH2 치환기로 대체한 경우 : 홀수
⑶ 질량 분석과 동위원소
① 고해상도 spectrometer는 동위원소를 구별할 수 있음
| 원소 | 풍부도 | |
| 탄소 | 12C 98.89%, 13C 1.11% | |
| 수소 | 1H 99.99%, 2H 0.01% | |
| 질소 | 14N 99.64%, 15N 0.36% | |
| 산소 | 16O 99.76%, 17O 0.04%, 18O 0.20% | |
| 황 | 32S 95.0%, 33S 0.76%, 34S 4.22%, 36S 0.02% | |
| 플루오린 | 19F 100% | |
| 염소 | 35Cl 75.77%, 37Cl 24.23% | |
| 브롬 | 79Br 50.69%, 81Br 49.31% | |
| 아이오딘 | 127I 100% | |
Table. 1. 유기물에서 발견되는 동위원소의 풍부도 (natural abundance)
② Cl은 질량 35와 37이 3 : 1의 비율로 존재
③ Br은 질량 79와 81이 1 : 1의 비율로 존재
④ M과 M+2의 높이차로 어떠한 원소가 포함돼 있는지 판단할 수 있음
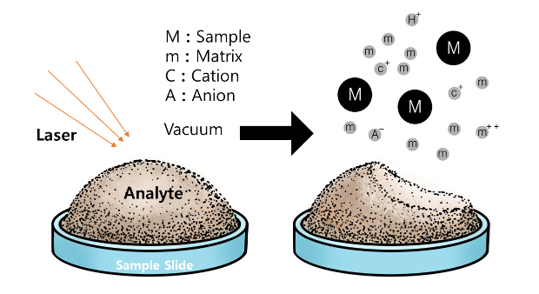
⑷ 종류 1. MALDI-TOF(matrix-assisted laser desorption/ionization) : 이와 관련해 Koichi Tanaka가 노벨상 수상
① 1st. 샘플(M)을 matrix와 섞은 뒤 matrix에 nitrogen laser lighter (337 nm)를 쬐면 열이 발생
② 2nd. 발생된 열로 인해 matrix가 샘플과 같이 기화함
③ 3rd. matrix는 기화함과 동시에 protonated됨 : M → MH+
④ 4th. A(anion)와의 proton transfer : MH+ + A → M + AH+
⑤ 고체 시료를 대상으로 함. 대략 1가, 2가, 3가 정도까지만 신호 갈라짐이 발생함
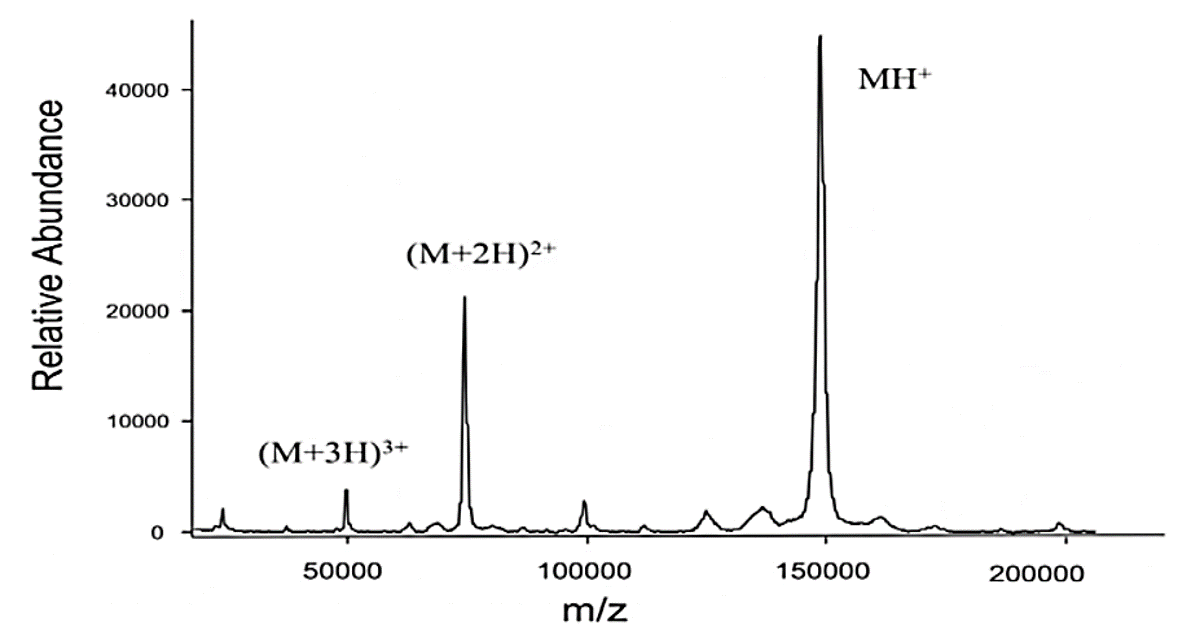
Figure. 6. IgG의 MALDI-TOF 질량분석 결과 (deconvolution 하기 전)
⑸ 종류 2. ESI(electron spray ionization) : 이와 관련해 John B. Fenn이 노벨상 수상
① HPLC를 거친 액체 시료가 nebulizer gas로 둘러싸인 고전압 관을 통과하면 spray 형태로 분사됨
② 액체 시료를 대상으로 함. 꽤 많은 신호 갈라짐이 발생함
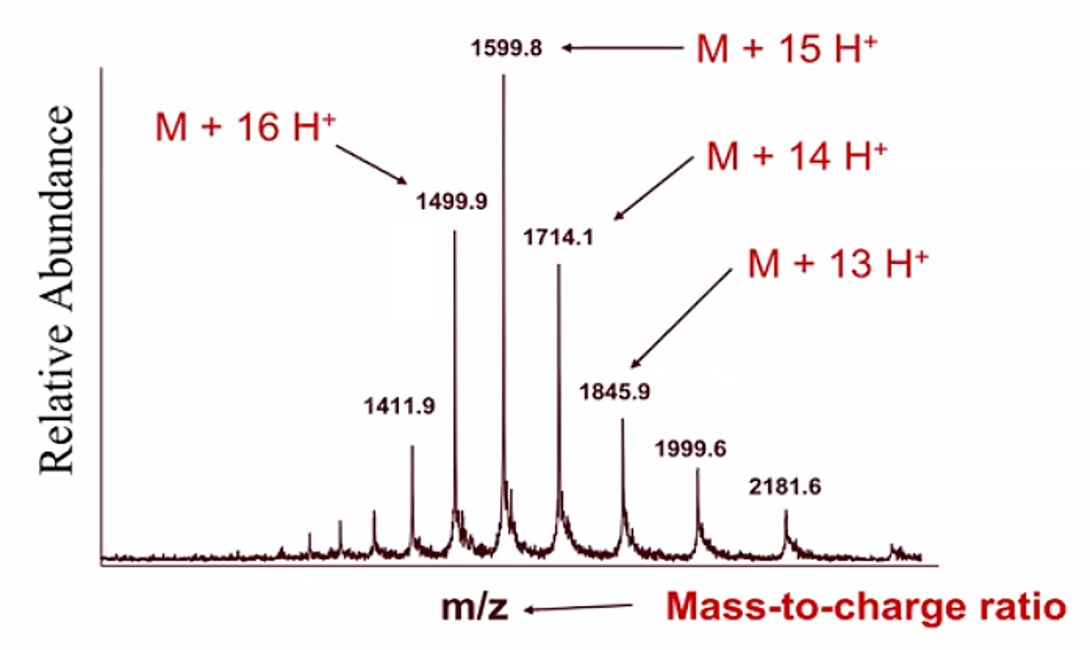
Figure. 7. 트립시노겐(Mw : 23983)의 ESI 질량분석 결과 (deconvolution 하기 전)
⑹ 응용 : 질량분석기의 정량 (단백질 분석을 중심으로)
① 배경 : 질량분석기는 그 자체로 정량적이지 않아 여러 기법이 개발됨
○ 이유 1. 측정 spot에 따라 laser power가 다를 수 있음
○ 이유 2. 물질마다 이온화 정도가 다르기 때문
② 종류 1. 상대적 정량
○ 1-1. labeling
○ ICAT(isotope-coded affinity tag) : chemical
○ 구조 : affinity tag (biotin) + linker region (light: 8 1H, heavy: 8 2H) + cysteine binding motif (iodoacetamide)
○ 가정 : target protein에 Cys가 포함돼 있음
○ 원리 : 실험 조건에 따라 선택적으로 light linker를 표지시키고 다른 조건에서 표지시킨 heavy linker와 비교
○ 1st. 한 실험군에는 light ICAT tag를 붙이고 다른 실험군에는 heavy ICAT tag를 붙임
○ 2nd. 각 실험군에서 얻은 단백질들을 한데 모아 avidin affinity chromatrography를 수행
○ 3rd. tagged protein 선별 수집 : tag는 Cys를 포함하는 protein에만 결합하므로 많은 단백질들이 제거
○ 4th. LC/MS를 수행
○ labeling이 일어나는 단계 : protein
○ 단점 1. target protin과 streptavidin을 분리하기 어려움
○ 단점 2. biotin 태크가 protein보다 쉽게 fragmentation이 되기 때문에 biotin으로 인한 신호간섭이 생김
○ SILAC(stable isotope labelling with amino acids in cell culture) : metabolic
○ 용도 : protein expression study, unbiased analysis of post-translational modificiation
○ 1st. heavy 측 cell culture : 13C, 15N-Arg, 13C-Lys를 제공
○ 2nd. light 측 cell culture : 12C, 14N-Arg, 12C-Lys를 제공
○ 3rd. 각각에서 얻은 추출물을 한데 모은 뒤 LC(liquid chromatography) / MS / MS를 수행
○ 4th. spectrum을 통해 식별 및 상대적 정량
○ labeling이 일어나는 단계 : cell
○ 장점 1. 동일한 단백질에서도 약간씩 신호가 달라지므로 데이터 분석시 신뢰성 있는 보정이 가능함
○ 장점 2. 별도의 labeling reaction을 하지 않아도 자연스럽게 labeling이 됨
○ 장점 3. cell 자체의 labeling, 즉 global scale에서의 분석이 가능함
○ 단점 1. multiplexing이 3개로 제한
○ 단점 2. 스펙트럼에서 신호가 겹치게 되면 heavy 측 신호인지 light 측 신호인지 구분할 수 없게 됨
○ BEMAD(β-elimination followed by Michael addition of DTT) : chemical
○ DTT는 환원제로 기능하여 단백질 내 이황화결합(-S-S-)을 제거 (-SH)
○ 원리 : DTT 대신 2H6-DTT를 처리한 후 스펙트럼에서 상대적 비교
○ labeling이 일어나는 단계 : protein
○ 16O / 18O : enzymatic
○ 원리 : 트립신이 있는 조건에서 물에서 hydration 시킬 때의 생성물들을 보고 분석하는 방식
○ labeling이 일어나는 단계 : protein
○ 15N : metabolic
○ labeling이 일어나는 단계 : protein
○ 1-2. label-free
○ peak intensity
○ spectral counting
○ spectral TIC
③ 종류 2. 절대적 정량
○ 2-1. labeling
○ iTRAQ(isobaric tag for relative and absolute quantitation) : chemical
○ iTRAQ reagent : reporter group (cationic) + balance group (neutral) + amine binding motif (NHS)
○ reporter group과 balance group를 통틀어 isobaric tag라고 함
○ 상대적 정량 원리 : reporter group, balance group를 달리 하여 스펙트럼에서 peak의 위치가 달라지게 함
○ 절대적 정량 원리 : 각각의 추출물 내 reporter group의 전하량을 측정함
○ labeling이 일어나는 단계 : peptide
○ 장점 : 비교적 자유롭게 multiplexing이 가능함. 상대적 정량과 절대적 정량이 모두 가능함
○ 단점 : 아민을 반드시 포함하는 물질에서만 사용 가능. SILAC과 달리 global scale에서 비교가 불가능함
○ MRM (multiple reaction monitoring)
○ TMT (tandem mass tags)
○ 2-2. label-free
○ APEX
④ 상대적 정량 방법이라고 해도 절대적 정량이 될 수 있음
○ 방법 1. 양을 알고 있는 labeling된 물질과 양을 알고자 하는 물질을 함께 섞은 뒤 상대적 정량
○ 방법 2. calibration curve를 그리는 방법
⑺ 응용 : MS/MS (MS2, tandem mass spectrometry)
① 정의 : 두 개의 mass spectrometer를 붙여 놓은 것
○ 일반적으로 triple-quadruple 구조를 이용함 (linear detector 모드)
○ 구성 1. MS1 (quadruple 구조; Q1) : 주어진 샘플을 이온화한 뒤 특정 m/z를 갖는 이온 X를 분리함
○ MS1을 통과한 이온을 precursor ion이라고 함
○ 구성 2. fragmentation part (quadruple 구조; Q2) : 특정 m/z를 갖는 이온 X를 더 작은 fragment들로 쪼갬
○ 구성 2에 있어 CID(collision-induced dissociation), ion-molecule reaction, photodissociation 등의 방법이 쓰임
○ 구성 3. MS2 (quadruple 구조; Q3) : 특정 m/z를 갖는 fragment를 분리함
○ MS2를 통과한 이온을 product ion이라고 함
○ MS/MS로 인해 얻을 수 있는 신호의 종류가 굉장히 다양해짐
○ 각 fragment들의 m/z의 신호를 재조합하여 이온 X의 m/z 값을 추산할 수 있음 : 알고리즘의 영역
② 종류 1. shotgun 기법
○ 정의 : MS1 및 MS2에서 filtering을 거치지 않고 모든 화학종의 스펙트럼을 알아내는 기법
○ 전체 단백질의 상대적 분포를 알아내는 shotgun proteomics 등에서 사용됨
○ 단점 : 시간이 오래 걸림. sensitivity가 낮음. 제한된 시간으로 인해 구체적인 m/z 값을 조사하지 못함
○ 1-1. DDA(data-dependent acquisition) 방식 : MS1으로부터 single peak를 고른 뒤 MS2를 하는 방식. 시간소요 큼
○ 1-2. DIA(data-independent acquisition) 방식 : MS1으로부터 peak range를 고른 뒤 MS2를 하는 방식
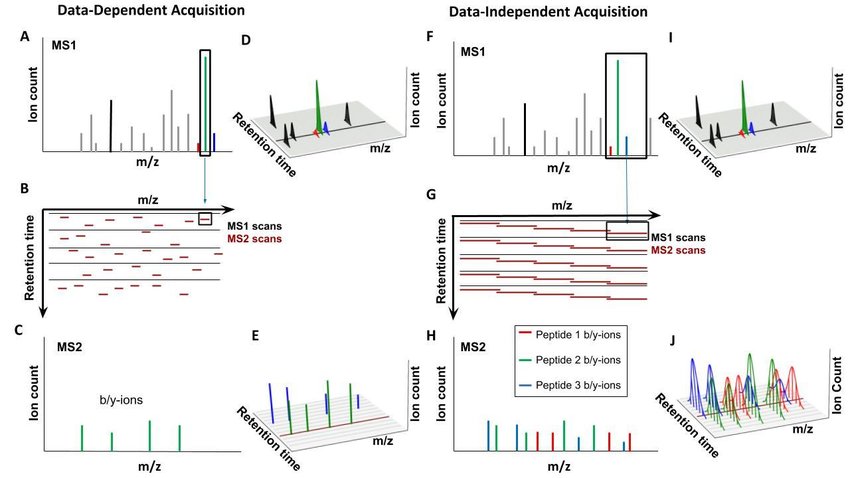
③ 종류 2. SRM(selected reaction monitoring)
○ 정의 : 특정 m/z를 갖는 fragment의 스펙트럼을 알아내는 기법
○ 장점 : 자동화, 항체 구입 불필요, sensitivity ↑ (background interference ↓), selectivity ↑, dynamic range ↑
○ 단점 : 절대적 정량에 한계가 있음
④ 종류 3. MRM(multiple reaction monitoring)
○ 정의 : 하나 또는 그 이상의 precursor ion으로부터 하나 또는 그 이상의 product ion의 스펙트럼을 알아내는 기법
○ SRM과 MRM을 넓은 의미의 SRM으로 포함시키기도 함
⑻ 응용 : McLafferty rearrangement
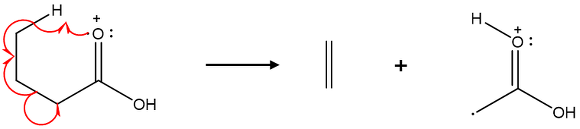
Figure. 9. McLafferty rearrangement
① 특징 1. hydrogen radical이 이동
② 특징 2. 6각 고리 전이상태
③ 특징 3. 중성인 알켄과 라디칼 양이온으로 분해
3. 적외선 분광법(infrared spectrum, IR spectrum) [목차]
⑴ 정의
① 적외선의 흡수파장을 분석하여 화합물의 작용기를 분석하는 실험방법
② pH 센서 등으로 이용됨
③ IR spectrum을 AI로 예측하는 모델이 개발되고 있음
⑵ 진동 : 전자의 출렁거림, 신축 진동과 굽힘 진동으로 구분
① 적외선 흡수파장은 중적외선(2,500-8,000 nm) 영역
② 중적외선은 흡수량이 많아 신호 세기가 약하므로 일반적으로 근적외선을 사용
③ 중적외선을 이용한 구현을 시도하고 있음
⑶ 유형 1. 신축 진동(stretching vibration)
① 정의 : 전기음성도가 큰 원자에서 전기음성도가 작은 원자로 전자가 일시적으로 이동하는 것
② 종류 : symmetric stretch, asymmetric stretch
③ IR 분광법은 대부분 신축 진동과 관련이 있음
④ 쌍극자 모멘트가 있는 원자는 적외선을 흡수하여 쌍극자 모멘트의 크기가 작아짐
○ 비슷하게 IR 분광법에서 쌍극자 모멘트의 변화량이 있어야 적외선을 흡수
⑤ 흡수하는 적외선 파장은 양자화되어 있음
⑥ IR에서는 적외선 흡수선을 파장 (cm)의 역수인 파수(cm-1)로 나타내며 일반적으로 4000-400 cm-1
○ (참고) 521 cm-1는 1 cm에 521개의 파동이 들어있는 경우를 지칭함
⑦ 요인 1. 결합이 강할수록 더 많은 에너지가 필요하므로 파수 증가
○ E = hν(단, ν는 파수)와 밀접한 관련
○ C≡C > C=C > C-C
○ 2-pentanone에서 C=O 결합은 이중결합이므로 1720 cm-1의 파수 관찰
○ 2-cyclohexenone에서 C=O 결합은 공명으로 인해 차수가 2보다 작으므로 1720 cm-1보다 작은 1680 cm-1 파수 관찰
⑧ 요인 2. 작은 원자일수록 전자의 분산이 덜하므로 파수 증가
⑨ 요인 3. 쌍극자가 클수록 결합이 강하므로 파수 증가
○ O-H > N-H > C-H
○ 이때 쌍극자는 단일 결합의 쌍극자를 말하는 것으로, 분자 전체의 쌍극자를 지칭하는 것은 아님
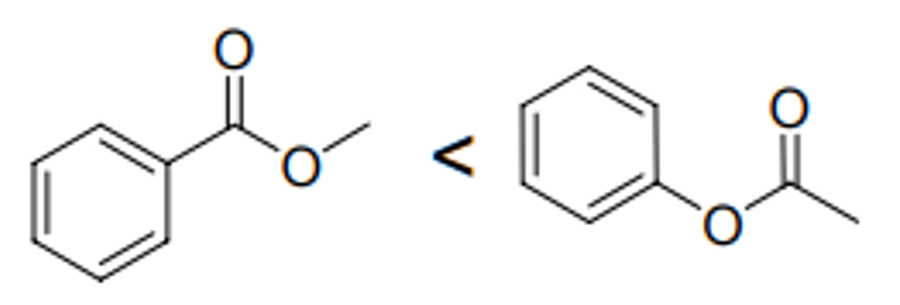
Figure. 10. C=O 신축 진동 파수 비교 예제
○ C=O 신축 진동 파수에 있어 오른쪽 구조가 더 파수가 큼
○ 이유 1. 혼성효과로 인해 메틸기(sp3)에서 케톤 탄소(sp2)로 전자 이동 → 결합에너지 증가 → 파수 (ν = E/h) 증가
○ 이유 2. 벤젠 고리에 의해 전자가 비편재화 되면 공명 파장이 길어지고, 파수는 짧아짐 (cf. 상자 속 입자)
○ 파수와 쌍극자 모멘트 간의 관계는 단일 결합에 국한된 것으로 보이는데, 그 이유는 왼쪽 구조가 1) 쌍극자 중간체가 안정화되고, 2) 쌍극자 간 거리가 더 멀어 궁극적으로 왼쪽 구조가 쌍극자 모멘트가 더 크기 때문
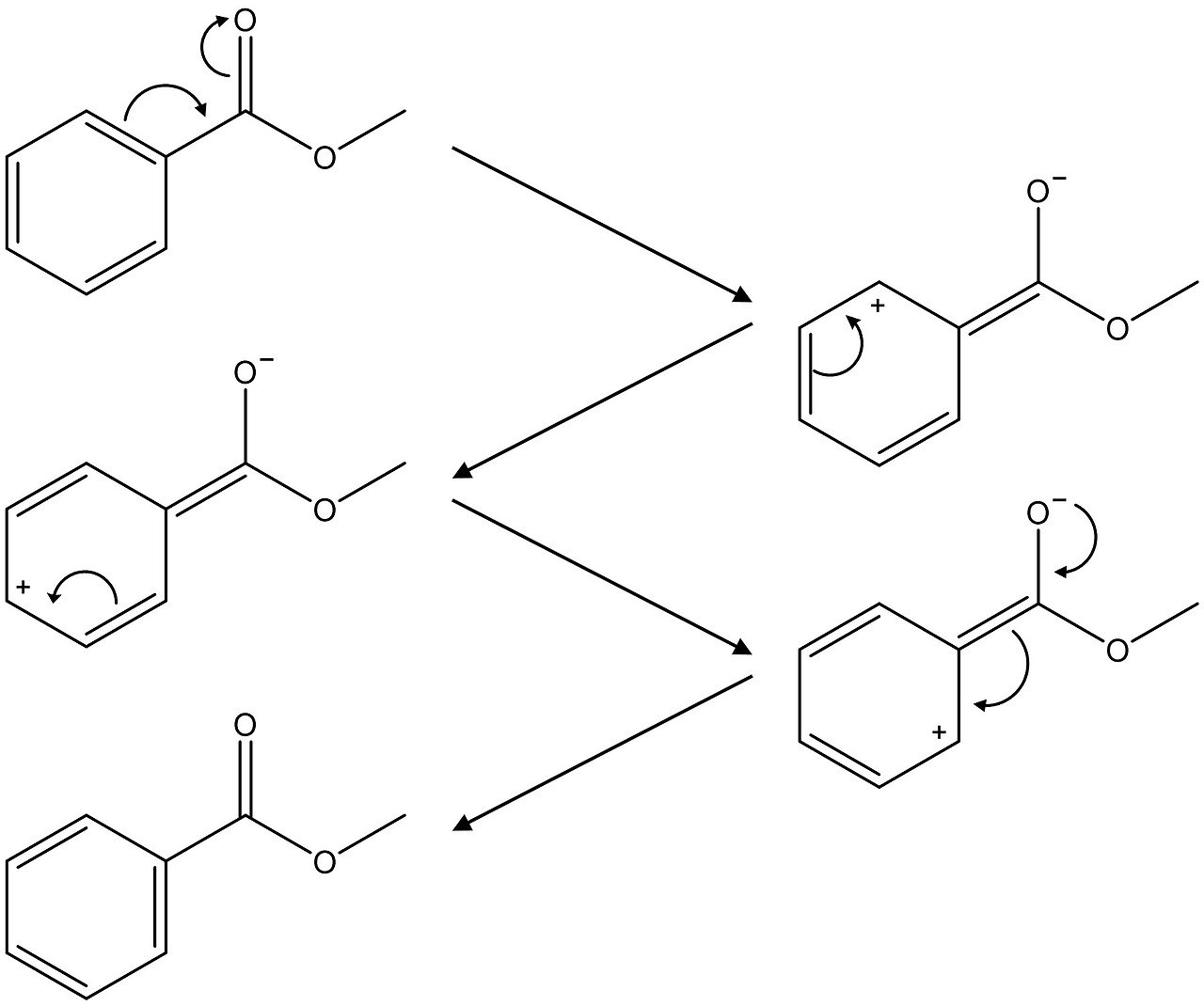
Figure. 11. 왼쪽 구조가 분자의 쌍극자가 더 큰 이유
⑩ 요인 4. 수소결합이 있으면 분자간 결합이 분자내 결합과 유사하고 수소결합의 형태가 다양하므로 흡수선이 매우 넓어짐
○ OH 결합은 수소결합으로 넓은 스펙트럼으로 관찰됨
⑪ 주요 작용기별 신축진동 흡수 파수
| 결합 종류 | 파수 (cm-1) | 강도 |
| C≡N | 2260-2220 | 중간 |
| C≡C | 2260-2100 | 중간-약함 |
| C=C | 1680-1600 | 중간 |
| C=N | 1650-1550 | 중간 |
| 벤젠 | ~1600, ~1500-1430 | 강함-중간 |
| C=O | 1780-1650 | 강함 |
| C-O | 1250-1050 | 강함 |
| C-N | 1230-1020 | 중간 |
| O-H (알코올) | 3650-3200 | 강함, 넓음 |
| O-H (카르복실산) | 3300-2500 | 강함, 매우 넓음 |
| N-H | 3500-3300 | 중간, 넓음 |
| C-H | 3300-2700 | 중간 |
| C≡C-H | ~3300 | |
| C=C-H | 3100-3020 | |
| C-C-H | 2960-2850 | |
| R-CHO | ~2820, ~2720 |
Table. 2. 주요 작용기별 신축진동 흡수 파수
⑷ 종류 2. 굽힘 진동(bending vibration, deformation vibration)
① 정의 : 결합각이 일시적으로 바뀌는 것
② 종류
○ symmetric in-plane bend (scissor)
○ asymmetric in-plane bend (rock)
○ symmetric out-of-plane bend (twist)
○ asymmetric out-of-plane bend (wag)
③ 주로 탄소-수소 결합에서 나타남
④ 굽힙 진동은 신축 진동보다 에너지를 덜 요구하기 때문에 파수가 작은 편
⑤ 주요 작용기별 굽힘진동 흡수 파수
| 결합 종류 | 명칭 | 파수 (cm-1) |
| CH3- | 1385-1365 | |
| -CH2- | 1450-1420 | |
| -CHR- | 1450-1420 | |
| HR-C=C-RH | trans | 980-960 |
| RH-C=C-RH | cis | 730-675 |
| R2-C=C-RH | trisubstituted | 840-800 |
| R2-C=C-H2 | terminal alkene (disubstituted) |
890 |
| RH-C=C-H2 | terminal alkene (monosubstituted) |
990, 910 |
Table. 3. 주요 작용기별 굽힘진동 흡수 파수
⑸ 종류 3. 회전에너지 : 회전에너지는 진동에너지 준위를 보다 세분화한 수준
⑹ 예시 : 예시의 나열 순서는 유기화학 목차에 따른 순서임
① 예시 1. 알코올(alcohol)
Figure. 12. 알코올의 IR 분광법
○ 3400 : -OH
○ 1060 : C-O
② 예시 2. 2-propyn-1-ol
Figure. 13. 2-propyn-1-ol의 IR 분광법
○ 3300 : OH기
○ 2950 : sp3 CH
○ 2100 : 알카인
③ 예시 3. 디에틸에테르(diethyl ether)
Figure. 14. 디에텔에테르의 IR 분광법
④ 예시 4. 케톤(ketone)
○ 1720 : C=O
○ finger region
⑤ 예시 5. 알데하이드(aldehyde)
Figure. 16. 알데하이드의 IR 분광법
○ 2700, 2800 : C-H
○ 1720 : C=O
⑥ 예시 6. 벤즈알데히드(benzaldehyde)
Figure. 17. 벤즈알데히드의 IR 분광법
○ 3050 : sp2 CH
○ 2810, 2730 : 알데하이드의 특징적인 twin peaks
○ 1700 : partial single-bond character carbonyl
○ 1600, 1460 : 벤젠 고리
⑦ 예시 7. 카르복실산(carboxylic acid)
Figure. 18. 카르복실산의 IR 분광법
○ 3200, 2600 : -OH
○ 3000 : C-H
○ 1700 : C=O
○ 1200 : C-O
⑧ 예시 8. 에스터(ester)
Figure. 19. 에스터의 IR 분광법
○ 1760 : C=O
○ 1100, 1200 : C-O
○ finger region
⑨ 예시 9. 아마이드(amide)
Figure. 20. 아마이드의 IR 분광법
○ 1660 : C=O
○ finger region
⑩ 예시 10. N-methylethanamide
Figure. 21. N-methylethanamide의 IR 분광법
○ 3300 : N-H 신축진동
○ 2950 : sp3 CH
○ 1660 : amide carbonyl
○ 1560 : N-H 굽힘진동
⑪ 예시 11. 아민(amine)
Figure. 22. 아민의 IR 분광법
○ 3400, 3300 : N-H 신축진동
○ 1600 : N-H 굽힘진동
○ finger region
⑺ 응용 1. vibrational-rotational spectrum
① 정의 : IR 분광법 혹은 라만 분광법을 통해 얻은 vibration, rotation에 관한 정보를 도식화 한 것
② R-branch : ΔJ = 1. Δv = 1
4. 자외선-가시광선 분광법(UV-vis spectrum) [목차]
⑴ 원리 1. 흡수파장의 결정
① π 결합은 자외선-가시광선을 흡수할 수 있으며 conjugation 길이가 길어지면 흡수파장이 길어짐
② π 결합 전자가 자외선-가시광선을 흡수하면 π* 오비탈로 이동
⑵ 원리 2. 비어-램버티 법칙(Beer-Lambert law)
① 증명
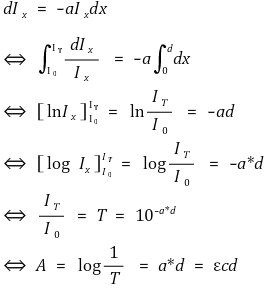
○ I : 빛의 세기
○ d : 빛이 투과하는 경로의 길이
○ a : 매질에 따른 흡광계수
○ T : 투과율
○ A : 흡광도 (단위 : OD(optical density))
○ c : 몰농도
○ ε : 몰 흡광계수
② 결론 : 흡광도는 물질의 농도에 비례
⑶ 흡수파장에 따른 흡수색, 관찰색
| 흡수파장 (nm) | 흡수색 | 관찰색 |
| 380-460 | blue-violet | yellow |
| 380-500 | blue | orange |
| 440-560 | blue-green | red |
| 480-610 | green | purple |
| 540-650 | orange | blue |
| 380-420, 610-700 | purple | green |
Table. 4. 흡수파장에 따른 흡수색, 관찰색
⑷ 흡수파장 예시
① 화학물질
○ methyl vinyl ketone : 219 ㎚
○ 3,5-hexadien-2-one : 249 ㎚
○ anilinium ion : 254 ㎚
○ benzene : 255 ㎚
○ phenol : 270 ㎚
○ aniline : 280 ㎚
○ phenolate ion : 287 ㎚
② 생체 유래 물질
○ 핵산의 질소 염기 : 260 ㎚
○ Phe, Trp, Tyr에만 있는 페닐기 : 280 ㎚
○ NADH : 340 ㎚
○ 닌히드린(ninhydrin) : 405 ㎚. 닌히드린은 아미노산과 반응하여 흡수파장이 570 ㎚인 보라색 산물을 형성
○ β-carotene : 455 ㎚
○ lycopene : 474 ㎚
○ 카로티노이드 : 500 ㎚
○ 헤모글로빈 : 560 ㎚
○ 엽록소 : 680 ㎚, 700 ㎚
○ 광합성 세균(예 : 홍세균)의 색소분자 : 840 ㎚, 870 ㎚
5. 핵자기 공명 분광법(nuclear magnetic resonance, NMR) [목차]
⑴ 원리
① 1H, 13C, 15N, 19F, 31P와 같이 스핀양자수가 0이 아닌 화학종은 NMR의 대상이 될 수 있음
② 위와 같은 화학종은 외부 자기장이 인가되면 몇 가지의 양자화된 상태를 가짐
③ 각 상태 간에 에너지 차이에 해당하는 전자기파는 라디오파임
④ NMR을 통해 알 수 있는 정보 : 특정 화학종의 종류와 개수
⑤ 일반적으로 MRI에서 voxel 사이즈는 1 × 1 × 5 ㎣인 반면 MRS는 15 × 15 × 15 ㎣로 비교적 큼
⑵ 1H NMR (proton NMR)
① 1H는 자기장 B0에 대해 α-spin state와 β-spin state의 두 가지 양자화된 상태를 가짐
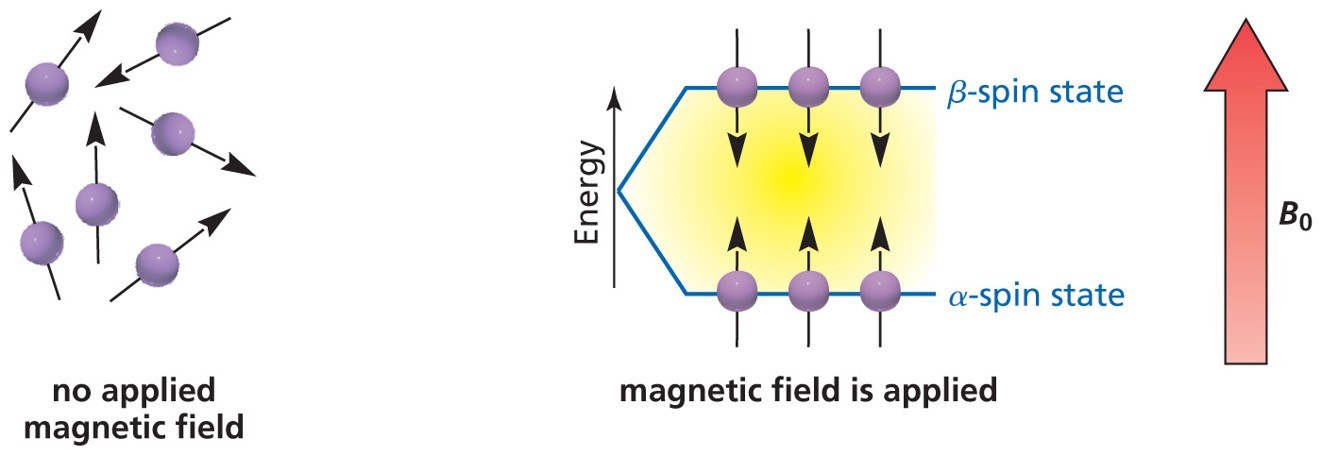
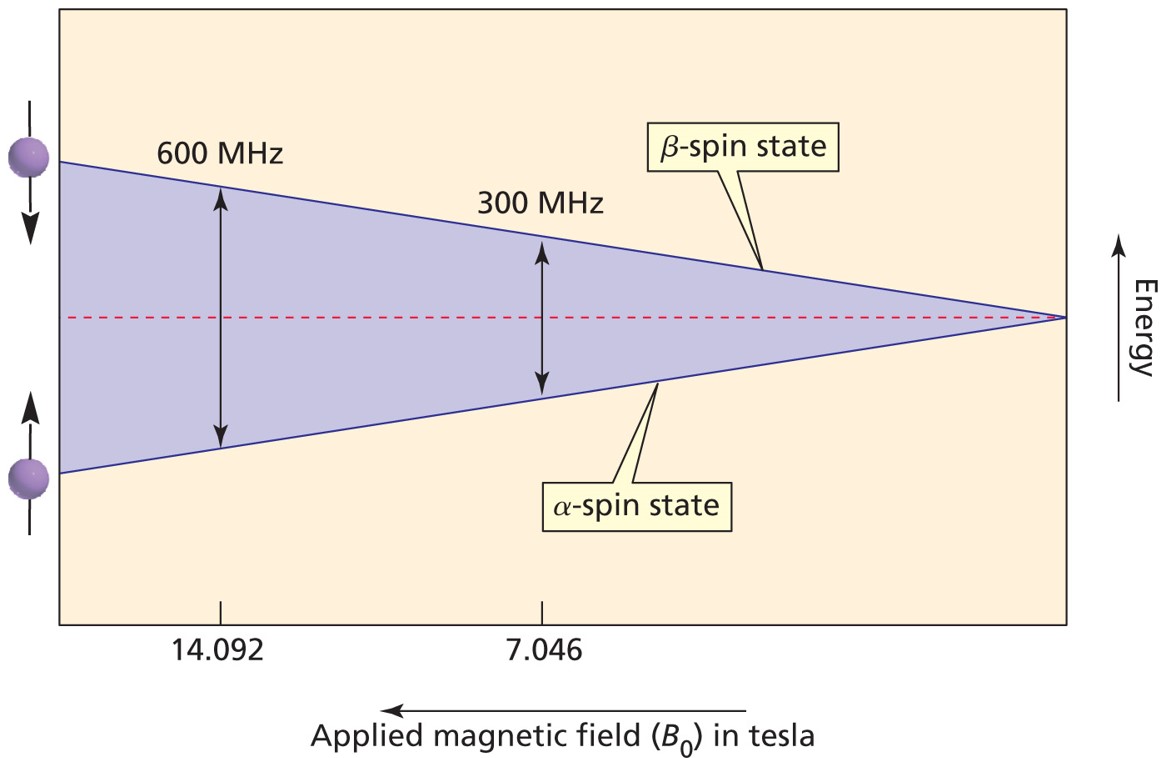
Figure. 23. 자기장에 대한 두 가지 양자화된 상태
② 스핀 반전(spin flip) : 1H는 자기장의 크기에 비례하는 에너지를 흡수하면 α-spin state에서 β-spin state로 흥분됨
③ 원리 1. 적분비(integral ratio)
○ NMR 신호의 적분비는 해당 equivalent 1H의 개수비를 나타냄
○ 이유 : 신호는 equivalent 1H의 개수에 선형 비례함. 다른 요인에는 크게 영향을 받지 않음
④ 원리 2. 화학적 이동(chemical shift)
○ 렌츠의 법칙 : 외부 자기장의 변화가 있으면 전자는 그 자기장을 상쇄하는 방향으로 유도 자기장을 형성함
○ 화학적 가리움(chemical shielding) : 국소적인 자기장 변화로 기본 자기장 B0에 비례

○ Bi : 국소 자기장
○ σi : 양성자 i에 대한 가리움 효과를 반영하는 인자
○ 가리움 인자는 일반적으로 작기 때문에(10-4 ~ 10-6), 자기장의 차이는 매우 작음
○ 자기장 차이를 반영하기 위해 절대적인 값을 이용하는 것보다 비율을 이용
○ 지수 계산 : 국소 자기장과 기준 주파수의 차이를 기준 주파수로 나눈 것. ppm 단위를 흔히 사용
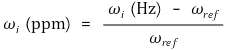
○ 자기장 차이를 표현한 이 항을 화학적 이동(chemical shift)이라고 부름
○ ωref의 값은 임의적이지만, 대개 transmitter의 ωTR를 선택
○ 주된 장점 : B0에 독립적
○ 예제 : 어떤 300 MHz 1H 핵자기공명(NMR) 스펙트럼에서 아세톤은 트라이메틸실레인(TMS) 기준으로부터 화학적 이동 δ 값이 2.0인 단일 공명선(single resonance line)으로 나타났다. 이 아세톤의 단일 공명선은 TMS 기준으로부터 몇 Hz 떨어져 있는가? 600 Hz
○ 전자 결핍 환경에 있는 1H는 알짜 자기장이 크므로 공명주파수 및 δ 값이 큼
○ (참고) 전자 결핍 환경에 있는 1H를 deshielded proton 또는 downfield proton이라고 함
○ 벗겨짐 효과(deshielding effect)와 관련 있음
○ 전자 풍부 환경에 있는 1H는 알짜 자기장이 작으므로 공명주파수 및 δ 값이 작음
○ (참고) 전자 풍부 환경에 있는 1H를 shielded proton 또는 upfield proton이라고 함
○ 가리움 효과(shielding effect)와 관련 있음
○ 전기음성도가 큰 원자에 가까운 1H일수록 더 많이 deshield되어 δ값이 커짐
○ 예 : CH3CH2CH2NO2에서 H는 1.04 ppm, H는 2.07 ppm, H는 4.37 ppm임
○ 예 : methyl proton은 0.85 ppm, methylene proton은 1.20 ppm, methine proton은1.55 ppm임
⑤ 원리 3. 스핀-스핀 갈라짐(spin-spin splitting) : 짝지움, 커플링(coupling), 다중도(multiplicity)라고도 함
○ 특정 1H 주변에 n개의 equivalent 1H가 있을 때 그 1H에 의한 NMR 신호는 n+1개로 갈라지고 이항분포를 따름
○ 배경 1. 주변에 있는 각 1H가 α-spin state와 β-spin state 중 하나의 상태를 취할 수 있으므로
○ 배경 2. 주변에 있는 각 1H의 상태에 따라 그 특정 1H에 의한 NMR 신호가 영향을 받음
○ ortho 배향 수소 > meta 배향 수소 > para 배향 배향 수소 순으로 갈라짐에 영향을 줌 : 가까울수록 갈라짐이 증가
○ ortho 배향 수소만 있는 경우
○ 그 1H에 의한 NMR 신호는 총 n+1개로 구분돼고 k번째 신호의 크기비는 nCk에 비례함
○ 갈라짐의 개수에 따라 singlet, doublet, triplet, quartet, quintet, sextet, septet, octet, nonet 등으로 구분됨
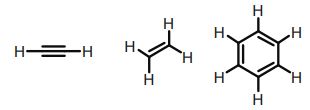
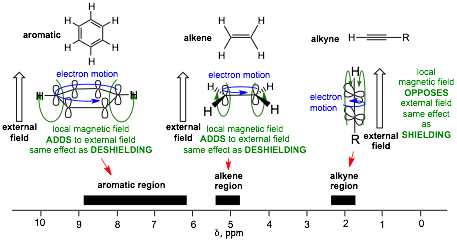
⑥ 응용 1. 다중 결합과 1H NMR : 다음 화합물에 대하여 각 화합물의 양성자의 화학적 이동(δ) 값이 큰 것부터 나열하라.
Figure. 25. 다중결합과 1H NMR
○ 오른쪽 (6.5-8 ppm) > 가운데 (5.3 ppm) > 왼쪽 (2.4 ppm)
○ benzyl proton : circulating electron이 외부 자기장과 같은 방향의 자기장을 형성 → 공명 주파수 및 δ 값이 큼
○ alkene proton : electon motion이 외부 자기장과 같은 방향의 자기장을 형성 → 공명 주파수 및 δ 값이 큼
○ alkyne proton : 렌츠의 법칙에 따른, 외부 자기장과 반대 방향의 유도 자기장만 존재 → 공명 주파수 및 δ 값이 작음
Figure. 26. 주어진 화합물에 대한 1H-NMR δ 값 및 그 원리
⑦ 실제 1H NMR
○ TMS(tetramethylsilane) : 참조 물질로 사용되어 이 물질의 신호를 0 ppm으로 설정함
○ CDCl3, acetone, methanol, DMSO, benzene 또한 NMR solvent로 사용되기도 함
○ 다른 1H NMR의 신호의 δ 값은 TMS에 대해 상대적으로 나타냄

○ 이유 1. 주파수 값 자체가 큼
○ 이유 2. δ 값은 자기장에 비의존적임 (∵ 주파수가 자기장에 비례하기 때문)
○ chemical shift의 예시 : 벤질 수소 = 6.5-8, 알데하이드 수소 = 9.0-10을 암기할 것
Figure. 27. 1H의 chemical shift의 예시
⑧ 1H NMR 예제 (ref)
⑶ 13C NMR
① 원리 1. 적분비(integral ratio)
② 원리 2. 화학적 이동(chemical shift) : 220 ppm 이후
③ 원리 3. 스핀-스핀 갈라짐(spin-spin splitting)
④ 실제 13C NMR
○ TMS(tetramethylsilane) : 참조 물질로 사용되어 이 물질의 신호를 0 ppm으로 설정함
○ CDCl3, acetone, methanol, DMSO, benzene 또한 NMR solvent로 사용되기도 함
○ 여러 물질의 13C NMR : R-CH3 = 0-35, C-O = 50-90, 벤젠 = 110-170, C=O = 205-220을 암기할 것
Figure. 28. 13C NMR의 chemical shift의 예시
⑤ 13C NMR 예제 (ref)
답은 ①임
○ A : Cl 자리(2개), Cl 옆 자리(2개), Cl 옆옆 자리(2개) 등 총 세 개의 탄소 자리가 존재함
○ B : Cl 자리(2개), 오른쪽 Cl 옆 자리(1개), 왼쪽 Cl 옆 자리(2개), Cl 옆옆 자리(1개) 등 총 네 개의 탄소 자리가 존재함
○ C : Cl 자리(2개), Cl 옆 자리 (4개) 등 총 두 개의 탄소 자리가 존재함
6. 라만 분광법(Raman spectroscopy) [목차]
⑴ 정의 : 가시광선 레이저를 쏘고 그 파장의 변화를 관찰하는 것
Figure. 30. FTIR(위)과 라만 분광법(아래)의 차이
⑵ (참고) 비탄성 산란(inelastic scattering) : 라만 산란(Raman scattering)이라고도 함
① 정의 : 산란 시 에너지 변화가 있는 경우. 입사 파장과 산란 파장이 다름
② 레일리 산란에 대하여 얼마만큼 shift 됐는지에 따라 Raman shift로 표시함
○ 적외선 분광법과 같이 직접적으로 진동 에너지를 측정할 수 없음
○ Raman shift의 단위는 cm-1
③ 양자역학적 이해 : 라만 산란 전후의 에너지 차이가 분자의 진동 에너지와 대응함
○ 물질이 에너지를 얻는 경우를 Stokes 산란이라고 함
○ 물질이 에너지를 잃는 경우를 anti-Stokes 산란이라고 함
○ 바닥 상태에 있는 분자가 진동 여기 상태에 있는 분자보다 많기 때문에 Stokes 산란이 anti-Stokes 산란보다 많음
⑶ Raman spectrum fingerprint region
Figure. 31. Raman spectrum fingerprint region
⑷ 분광 과정
① 1st. 샘플에 단색광을 쬐어줌
② 2nd. 라만 산란광과 레일리 산란광을 모두 notch filter에 통과사킴 : 산란광은 대부분 레일리 산란광임
③ 3rd. notch filter는 레일리 산란광을 선택적으로 차단함
④ 4th. notch filter를 통과한 라만 산란광은 grating을 통해 파장에 따라 분리됨
⑤ 5th. 이렇게 분리된 특정 파장의 라만 산란광을 CCD로 읽어 들임
⑸ 가시광선 파장을 인체 피부에 사용하면 형광이 심해 형광 피크에 가려 라만 산란에 의한 스펙트럼을 관찰할 수 없음
① 대책 1. 긴 파장을 사용하여 형광간섭을 감소시키는 것
○ 예 1. Nd:YAG 레이저를 이용한 near-IR FT 라만 분광법 : 파장이 1064 nm
○ 예 2. CCD (charge coupled device) 검출기를 이용한 분산형 라만 분광학
② 대책 2. 짧은 파장을 사용하여 형광 영역이 라만 스펙트럼 영역 밖에서 분리되도록 함
○ 예 1. 자외선 공명 라만 분광(UVRR, ultraviolet-resonance Raman spectroscopy)
7. 기타 분광법 [목차]
⑴ surface plasmon resonance spectroscopy
① 표면 플라즈몬 공명(SPR, surface plasmon resonance)의 원리
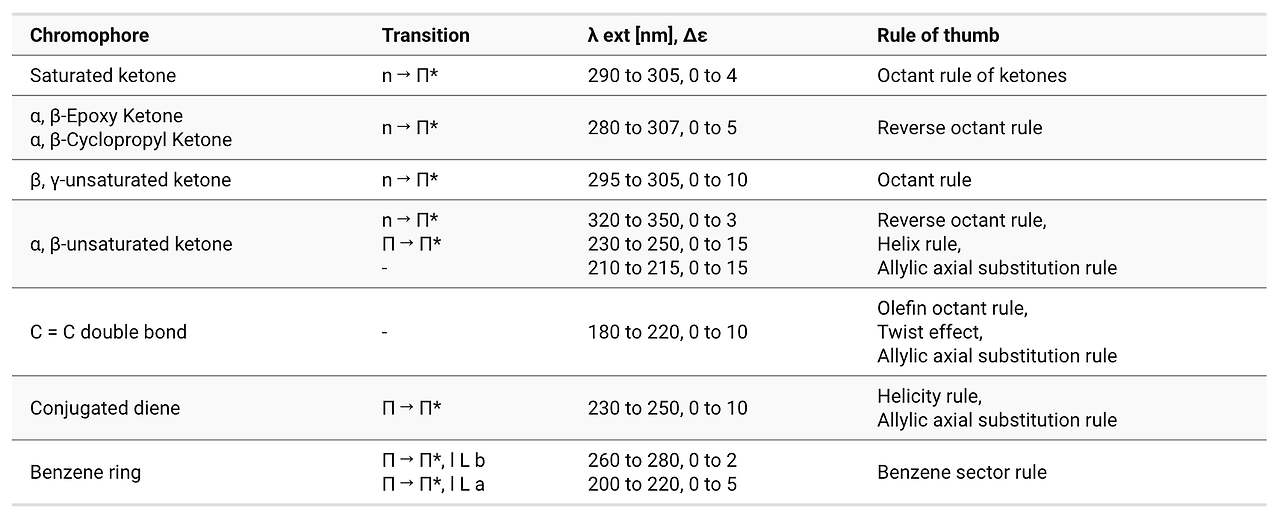
⑶ CD(circular dichroism spectroscopy)와 ORD(optical rotary dispersion)
① CD/ORD의 특징
Table. 5. CD/ORD의 특징
② Cotton effect : UV 스펙트럼 범위에서 ORD 스펙트럼과 CD의 피크가 관찰됨
○ 정보 1. sign (±) : CD (+), ORD (long-wavelength maximum)
○ 정보 2. magnitude : CD peak value, ORD peak, valley amplitude
○ 정보 3. position : CD peak wavelength = ORD inflection point
③ 응용 1. 우회전성, 좌회전성 판단
○ 입체화학에서 우회전성이면 (+), 좌회전성이면 (-)로 표시
○ CD가 양의 피크를 가지면 (+), 음의 피크를 가지면 (-) 배향
○ ORD의 최댓값이 변곡점보다 파장이 큰 영역에서 형성돼 있으면 (+), 그렇지 않으면 (-) 배향
④ 응용 2. 작용기별 Cotton effect
Table. 6. 작용기별 Cotton effect
⑴ 정의 : 주어진 대상체에 복사선을 쪼였을 때 대상체의 반사, 투과, 흡수, 산란, 형광을 파장별로 측정하기 위한 장치
⑵ 구성 1. 광원(light source)
⑶ 구성 2. 파장 선택기 : 프리즘, 회전발, 광학 필터 등이 있음
⑷ 회전발(diffraction grating)
① 정의 : 매끈하게 연마된 금속면에 톱니 모양의 홈을 파서 만든 것
○ 자외선과 가시광선 영역에 사용되는 반사 회전발은 1 mm 당 홈의 수가 300 ~ 6,000개임
○ 적외선 영역에 사용되는 반사 회전발은 1 mm 당 홈의 수가 10 ~ 200개임
○ 홈들은 모두 크기가 같고 평행하며 등 간격이어야 함
② 에셀레트형 회전발(echellette type diffraction grating)
○ 평행화 된 복사선이 회전발의 반사면에 닿으면 각 면에서 반사법칙이 일어남
○ 반사된 복사선들 사이에 상호 간섭이 일어남
○ 인접하는 복사선의 진행거리의 차이가 복사선 파장의 정수배가 되면 보강간섭이 일어남
Figure. 32. 에셀레트형 회전발의 보강간섭 조건
⑸ 광학 필터
① 간섭 필터(interference filter)
○ 반투명한 2개의 박막 사이에 채워진, 얇고 투명한 유전체 층으로 구성됨
○ 브래그 회절(Bragg diffraction) : 유전체 층 두께가 작을수록 입사각이 클수록 복사선의 파장이 증가
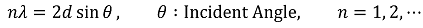
○ 브래그 회절은 XRD(X-ray diffraction)의 원리가 됨
○ 특징 : 유효파장 폭(FWHM, full width at half magnitude)이 작음
② 흡수 필터(absorption filter)
○ 전체적으로 입사광을 약하게 하는 필터
○ 특징 : 유효파장 폭(FWHM, full width at half magnitude)이 큼
○ 예 : UV cut-off filter, NIR 흡수 필터
⑹ 종류 1. 홑살 분광광도계(single-beam spectrophotometer)
① 다색광 → 단색화 장치(monochromator) → 단색광
② 투과율 P/P0을 측정
③ 시료와 용매를 번갈아 측정 : 광원의 세기 및 검출기의 감도가 변함에 따라 오차가 발생함
⑺ 종류 2. 겹살 분광광도계(double-beam spectrophotometer)
① 빛이 시료와 레퍼런스 용기를 번갈아 가며 통과함
② 시간에 따른 광원의 세기 및 검출기의 감도 변화에 따른 오차를 최소화할 수 있음
입력: 2019.05.02 09:32
수정: 2024.07.27 20:24
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 유기화학 목차 (149) | 2024.12.27 |
|---|---|
| 【유기화학】 알케인의 구조이성질체와 그래프 이론 (0) | 2024.06.20 |
| 【유기화학】 11-1강. 방향족성 판단 예제 (2) | 2024.05.28 |
| 【유기화학】 혼성효과와 산도 비교 예제 (2) | 2024.05.19 |
| 【유기화학】 1-1강. 물리화학적 성질 예제 (6) | 2024.03.26 |

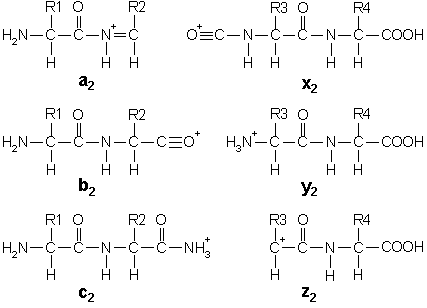

























최근댓글