29강. 유기화학 실험
추천글 : 【유기화학】 유기화학 목차
a. 일반화학 실험
b. 유기화학 실험 예제
1. 반응용기 [목차]
⑴ 증류장치(aspirator)
① 감압여과장치
⑵ 뷰흐너 깔때기(뷔후너 깔때기, Büchner funnel)
① 깔때기 자체에 펌프가 있어 감압여과 가능
⑶ Claisen 관
⑷ 딘 스탁 트랩(Dean-stark trap)
① 반응 결과 생긴 물 또는 저비점을 효율적으로 제거
② 조건 1. azeotropic mixture 사용 : 용매와 co-solvent를 함께 섞어 끓는점을 일정하게 함
③ 조건 2. azeotropic mixture의 끓는점이 저비점 용매보다 높을 것
④ 딘 스탁 트랩에 사용하는 용매의 예 : 벤젠 (80.1 ℃), 톨루엔 (110.6 ℃), 자일렌 (139.3 ℃)
⑸ 적하 깔때기(dropping funnel)
① 액체 상태의 반응물을 일정하고 천천히 첨가 시 사용

⑹ 분별증류(fractional distillation)
① 끓는점이 다른 화합물을 분리
② 분별증류관 : 관에 홈이 많은 관
③ 분별증류관의 홈이 표면적을 넓혀 증기상 화합물이 쉽게 열을 뺏기기 때문에 분별 감도를 높임
⑺ 환류 냉각기(reflux condensor)
① 용매 증발 방지
② 증기상 화합물이 냉각수로부터 최대한 많이 열을 뺏기도록 설계. 즉, 관이 구불구불함
⑻ 회전 증발기(rotatory evaporator)
① 감압 + 약한 가열 + 회전 (∵ 증발면적 증가)
⑼ 분별깔때기(separatory funnel)
① 극성 용액과 비극성 용액을 분리할 때 사용

⑽ 단순 증류 장치(simple distillation)
① 끓는점 차이가 큰 액체 혼합물을 분리 시 사용
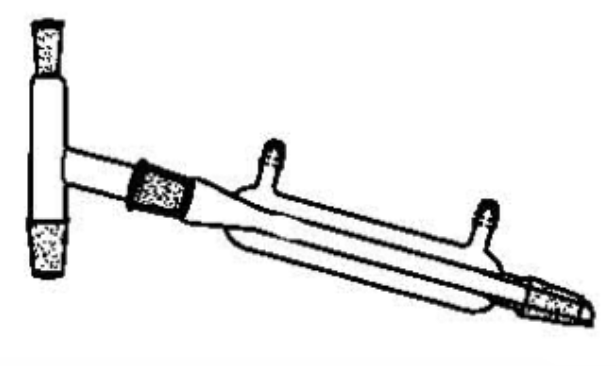
⑾ 감압여과(suction filtration)
① 감압하여 고체 여과물을 거르는 데 사용
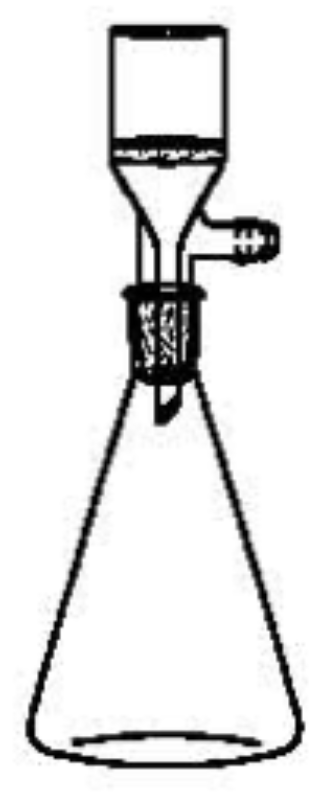
3. 실험시약 [목차]
⑴ 추출용매
① 극성 무기용매 : 물
② 극성 유기용매 : CH2Cl2, 아세톤
③ 무극성 유기용매 : 벤젠, 헥산, dichloromethane, diethyl ether
⑵ 물보다 밀도가 큰 유기용매 : CS2, CCl4, CHCl3, CH2Cl2, CH3Cl, DMSO
① 목적 1. 분별깔때기와 함께 사용
⑶ 물보다 밀도가 작은 유기용매 : 에틸 아세테이트, 에테르(diethyl ether), 벤젠, ···
⑷ 건조제 : CaCl2, MgSO4, Na2SO4, CaSO4, K2CO3, MS, 제올라이트(zeolite)
① 수화물을 잘 생성하는 염 무수물
② 목적 1. drying tube
③ 목적 2. Dean-Stark trak과 함께 사용
④ 목적 3. 분별깔때기와 함께 사용
⑤ 목적 4. 분자체 : 무수 용매 정제 후 용매를 보관할 때 사용
4. 실험기법 [목차]
⑴ 재결정(recrystalization) : 용해도 차이 이용
① 과정 1. 녹을 때까지 용액을 가열한 뒤 천천히 식힘
○ 과냉각 상태를 방지하기 위해 천천히 식힘
② 과정 2. 결정이 생기는 것을 기다림
○ 결정핵 제공 : 결정이 생성되지 않을 경우 유리막대로 비커 안의 벽을 긁어줌
③ 과정 3. 감압여과장치(예 : 뷰후너 깔때기)로 여과
④ 경우 1. 침전물을 EtOH로 닦고 건조한 후 무게를 측정 : 침전물에 관심 있는 경우
○ 소량의 용매를 결정에 골고루 뿌리는 이유 : 결정 표면의 불순물을 제거하기 위해
⑤ 경우 2. 감압회전 증발기를 이용해 용매를 추출 : 용액에 관심 있는 경우
⑥ 좋은 용매는 온도에 따라 용해도가 많이 변하는 것
⑵ 층분리 : 극성 차이를 이용
① 분별깔때기를 일반적으로 사용
② NaCl의 첨가는 물층의 이온 세기를 증가시켜 추출과정 중 유기층과 물층의 층 분리가 잘 일어나게 해 줌
⑶ 분별증류 : 끓는점 차이를 이용
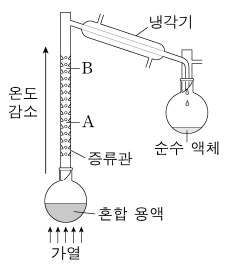
Figure. 1. 분별증류 장치
⑷ 크로마토그래피 : 극성 차이를 이용
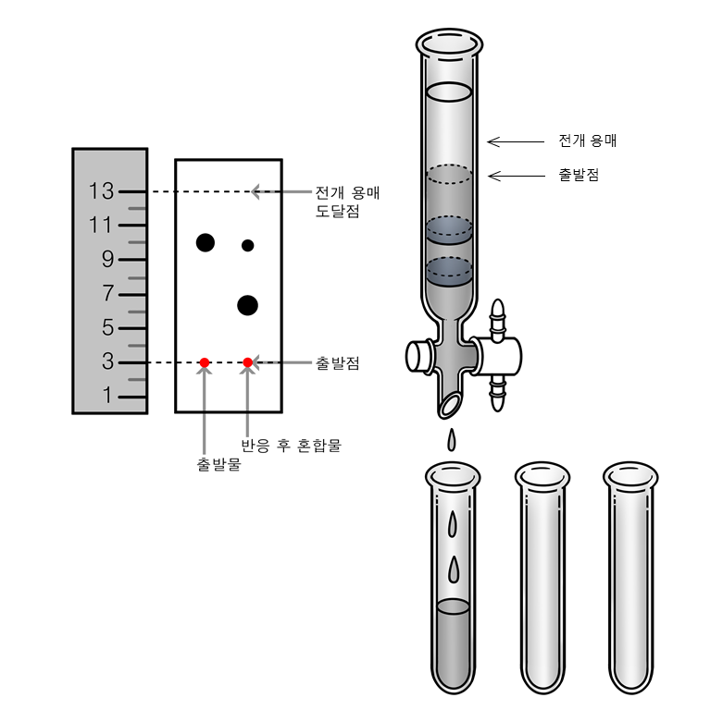
Figure. 2. TLC 크로마토그래피(왼쪽)와 관 크로마토그래피(오른쪽)
① 종류 1. 얇은 막 크로마토그래피(TLC, thin layer chromatography) : 반응의 진행 정도를 확인하기 위해 사용
○ 원리 : 시료와 실리카 겔 간의 상호작용 차이
○ 목적 : 반응의 진행 여부 확인, 반응의 종결 판단
○ 정상 실리카 젤(normal phase silica gel) : 강한 극성. 시료의 극성이 증가할수록 젤과의 친화력 증가
○ 정지상은 실리카 겔(가장 극성이 강함), 이동상은 전개용매(비극성)
○ Rf 의 정의 : 시료가 이동한 거리 ÷ 용매가 이동한 거리
○ 시료에 따른 Rf 비교
○ 산, 염기, 금속염 < 카르복실산, 아민, 아마이드 < 알코올 < 알데하이드, 케톤 < 알킬 할라이드 < 에스터 < 알켄 < 알카인 < 알케인
○ 경향 1. 시료의 극성이 클수록 실리카 겔과 상호작용을 잘하기 때문에 Rf가 작아짐
○ 경향 2. 아민기, 히드록시기는 니트로기에 비해 극성이 덜하지만 수소결합을 하므로 Rf가 작음
○ 경향 3. trans 알켄이 cis 알켄보다 Rf가 작음 (∵ 상호작용을 잘 하므로)
○ 예 : 종이크로마토그래피와 엽록소 분리 실험에서 Rf는 카로티노이드 > 크산토필 > 엽록소 a > 엽록소 b 순
○ 유기용매에 따른 Rf 비교
○ 물 < 아세트산 < 알코올 < 에틸 아세테이트 < CH2Cl2 < 톨루엔 < CCl4 < n-헥세인
○ 경향 1. 전개용매의 극성이 클수록 시료가 같이 움직이기 때문에 Rf 증가
○ 에틸 아세테이트(ethyl acetate) : 극성 용매 대표
○ n-헥세인(n-hexane) : 비극성 용매 대표
② 종류 2. 관 크로마토그래피(column chromatography) : 혼합물을 분리하기 위해 사용
○ (주석) TLC는 간이 크로마토그래피라고 생각하면 됨
○ 요인 1. 관의 상호작용이 작을수록 이동속도가 빠름 : 관은 일반적으로 극성임
○ 요인 2. 전개 용매와의 상호작용이 클수록 이동속도가 빠름 : 전개 용매는 비극성임
○ 물질이 비극성일수록 이동속도가 빠름. 중력은 크게 관련이 없음
⑸ 정성 분석법 : 유기화합물 내 특정 작용기가 존재하는지를 확인하기 위해 육안 식별 가능한 요소를 활용하는 것
① Br2 : 적갈색 용액
○ 탈색반응 : 할로젠 첨가 반응 결과 무색이 됨
② FeCl3(aq) : 노란색 용액
○ 페놀과 반응하여 Fe(OPh)3를 생성하며 정색반응 (적자색)
○ Fe(OH)2 : green rust
○ Fe(OH)3 : dark orange
③ AgNO3(aq) : 무색 용액
○ 이탈기가 Cl-인 경우 AgCl이 석출되어 흰색 침전물이 생성됨
○ 이탈기가 I-인 경우 AgI가 석출되어 노란색 침전물이 생성됨
④ KMnO4(aq) : 보라색 용액
○ MnO2가 되면 갈색 침전이 됨
⑤ AgNO3, KOH, NH4OH 또는 Ag2O, NH4OH : 무색 용액
○ 은거울 반응 또는 Tollens test : 케톤과는 반응하지 않고 알데하이드와 반응하여 금속 은이 석출됨
○ Ag2O는 Ag+ donor로 작용 : 물에 있는 산소가 알데하이드로 이동하여 카르복실산이 생성됨
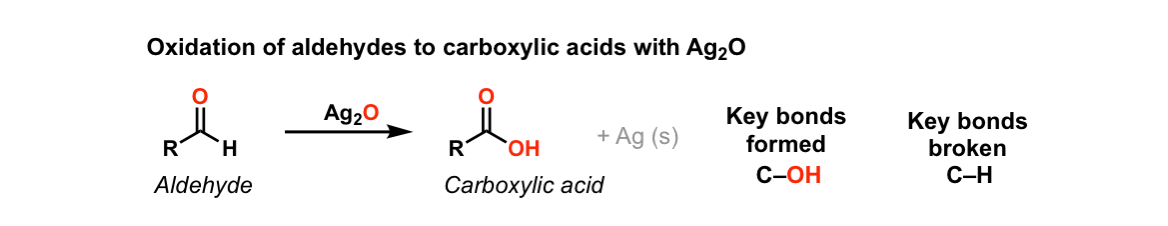
Figure. 3. 은거울 반응 또는 Tollens test
⑥ 진한 HCl, ZnCl2 : 무색 용액
○ 알코올과 반응하여 염화 알킬이 생성되면서 현탁 용액이 되거나 층 분리가 일어남
○ (참고) 알코올의 SN1 첨가반응에 있어 X- 중 Cl-는 반응성이 약하기 때문에 ZnCl2와 같은 촉매가 필요함
⑦ 은(Ag)
○ 황화수소(H2S)와 반응하여 검정색 황화은(Ag2S) 석출물을 생성함
⑧ 크로뮴(Cr)
○ K2Cr2O7은 주황색이고 Cr2(SO4)3은 청녹색
○ K2Cr2O7은 산화제로서 COD를 측정할 때 많이 사용됨
⑨ 염화암모늄(NH4Cl)
○ 염산 기체(HCl)와 암모니아 기체(NH3)가 만나면 흰색 고리가 생성됨
⑹ 광학분할(optical resolution)
① 라세미 혼합물을 특정 절대배열 광학이성질체와 반응시켜 부분입체이성질체로 만드는 것
② 물리화학적 특성이 달라지므로 분리해낼 수 있음
③ 응용 1. 산·염기반응 : 강산 또는 강염기를 첨가하여 반응물과 첨가물 간 이온결합을 분리
④ 응용 2. 거울상 크로마토그래피
⑺ 분광학
입력: 2019.03.29 15:18
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 옥시수은화-탈수은화에 의한 수화반응 (0) | 2019.01.30 |
|---|---|
| 【유기화학】 수소화 붕소에 의한 수화 (0) | 2019.01.30 |
| 【유기화학】 3-1강. 사이클로알케인, 사이클로알켄의 구조 (0) | 2019.01.16 |
| 【유기화학】 22강. 주요 반응 메커니즘 요약 (3) | 2019.01.12 |
| 【유기화학】 20강. 산화환원반응 및 유기금속시약 (4) | 2019.01.12 |




최근댓글