추천글 : 【환경화학】 환경화학 목차
a. 용액
수수 님 지적사항 수정 (23.05.09)
당근 님 지적사항 수정 (23.12.24)
Q. 콜로이드와 응집에 대하여 다음 물음에 답하시오.
Q1. 응집제(coagulant, flocculant)로 알루미늄(Ⅲ) 염의 첨가 시 소수성 콜로이드가 탈안정화되는 메커니즘을 설명하시오.
A1.
약 125년 전에 제안된 Schulze-Hardy (S-H) rule에 따르면, 응집력은 용질 간의 정전기적 인력에 비례한다.
따라서 용질의 농도가 많을수록 용질의 원자가가 클수록 응집이 빠르게 일어난다.
응집은 염과 용질이 같이 침전되고 염석은 용질만 침전된다는 점에서 응집과 염석은 구별된다.
소수성 콜로이드는 표면에 hydration layer가 생성되어 물에 녹을 수 있고 다음 과정에 의해 탈안정화될 수 있다.
일반적으로 동종의 입자는 같은 전하를 띠기 때문에 척력이 발생하여 응집되지 않는다 (0단계).
그러나 알루미늄 염이 첨가되면, 콜로이드 표면의 hydration layer에 전하가 유도되어 염과 결합한다 (1단계, coagulation).
이때 염-콜로이드의 전체 전하는 0에 가깝기 때문에 더 큰 입자를 형성한다 (2단계, flocculation).
그러면서 micro-floc을 형성하게 되고 (3단계), 반데르-발스 인력도 커져서 더 큰 덩어리를 형성한다 (4단계, macro-floc).
이렇게 큰 덩어리가 되면 쉽게 제거할 수 있다 (5단계).
Q2. 정수과정에서 응집제로 Al2O3(alum)을 첨가한 경우, 응집제 1 mg / L 당 알칼리도 소모량(mg / L as CaCO3)을 계산하시오. (단, 원자량 Al = 27, O = 16이다.)
A2.
○ 경우 1. 용액 내 중탄산염이 존재하지 않는 경우
alum을 물에 첨가하면 0.01 ~ 1.0 초 이내에 metal hydroxide의 형태로 활성화되고, alkalinity와 pH를 떨어트린다.
Al2O3 + 3H2O + 2OH- → 2[Al(OH)4]-
alum의 화학식량은 27 × 2 + 16 × 3 = 102 g/mol이다.
그러므로 응집제 1 mg은 1 mg × 1 mol/102 g × 2 = (2/102) mmol OH-에 대응된다.
CaCO3 1몰당 2몰의 OH-와 대응하므로, (1/102) mmol의 CaCO3를 고려해야 하고 최종 정답은 다음과 같다.
(1/102) mmol CaCO3 × 100 g CaCO3 / mol / 1 L = 0.98 mg / L as CaCO3
○ 경우 2. 용액 내 중탄산염이 존재하는 경우
Al2O3는 보통 알루미늄 황산염의 분해반응을 통해 얻어진다.
Al2(SO4)3 → Al2O3 + 3SO3
이렇게 얻어진 Al2O3는 중탄산염(HCO3-)과 반응하여 알칼리도를 떨어트릴 수 있다.
Al2O3 + 3Ca(HCO3)2 → 2Al(OH)3 + 3CaCO3 + 3CO2
alum의 화학식량은 27 × 2 + 16 × 3 = 102 g/mol이다.
그러므로 응집제 1 mg은 1 mg × 1 mol/102 g × 6 = (6/102) mmol HCO3- = (3/102) mmol CaCO3와 대응된다.
최종 정답은 다음과 같다.
(3/102) mmol CaCO3 × 100 g CaCO3 / mol / 1 L = 2.94 mg / L as CaCO3
* 참조 : 17% w/w Al2O3 1 mg/L = 0.17 * 2.94 = 0.51 mg/L as CaCO3
* 참조 : 8% w/w Al2O3 1 mg/L = 0.08 * 2.94 = 0.24 mg/L as CaCO3
○ 결언 : 위 참조 링크에서도 알 수 있듯 본 문제는 보통 경우 2를 암시한다.
Q3. 제타전위를 설명하고, 응집효율 평가에 제타전위 값이 어떻게 사용될 수 있는지를 설명하시오.
A3.
⑴ 제타 전위 또는 제타 포텐셜(zeta potential)
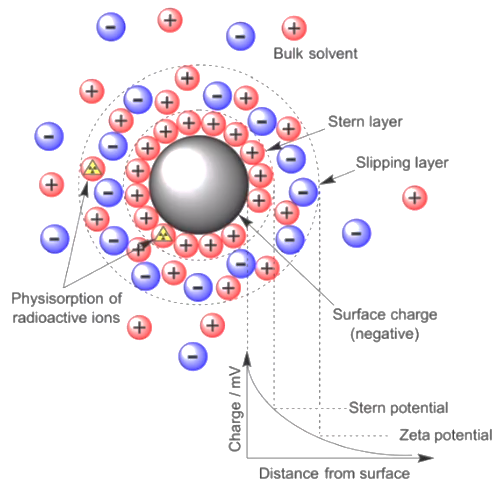
① 배경이론
○ 하전된 입자 주위로 반대 극성의 입자가 모여 1차적인 껍질을 형성함
○ stern layer : 1차적인 껍질
○ 1차적인 껍질 주위로 관련된 극성의 입자가 모여 2차적인 껍질을 형성함
○ stern layer는 입자를 따라 움직임
○ double layer : 2차적인 껍질. DEL(double electrode layer)라고도 함
○ 2차적인 껍질은 처음 입자와 같은 극성일 수도 있고 다른 극성일 수도 있음
○ 입자보다 용매의 영향에 의해 움직임
② 제타전위(zeta potential)
○ 정의 : double layer의 표면의 전위
○ surface potential, stern potential과 달리 측정 가능
○ 전위를 가했을 때 입자의 이동속도의 차이를 통해 제타전위를 측정할 수 있음
○ 그 결과 입자의 polarity를 측정할 수 있음
⑵ 응집효율 평가와 제타전위 : 제타 포텐셜은 전하 상태뿐만 아니라 입자 분산 정도도 반영함
① 두 입자가 같은 부호이고 충분히 큰 제타전위를 가지면 서로 응집하지 않음
② 제타 전위의 절대값이 30 mV를 넘으면 입자들 간에 반발력이 우세하게 작용하여 응집하지 않음
○ 참고 : H. Liu, R. Tang, X.X. He, Y. Zhang Acta Pharm Sin, 37 (2002), p. 563
입력: 2019.04.01 16:31
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2014 국가공무원 5급(기술) 제4문 (0) | 2019.04.01 |
|---|---|
| 【환경화학】 2014 국가공무원 5급(기술) 제3문 (2) | 2019.04.01 |
| 【환경화학】 2014 국가공무원 5급(기술) 제1문 (2) | 2019.04.01 |
| 【환경화학】 2015 국가공무원 5급(기술) 제5문 (0) | 2019.03.31 |
| 【환경화학】 2015 국가공무원 5급(기술) 제4문 (0) | 2019.03.31 |

최근댓글