추천글 : 【환경화학】 환경화학 목차
a. 산·염기 반응
Q. 완충용액(buffer solution)은 어떤 반응을 최적인 상태로 진행시킬 때 일정한 pH를 유지하도록 도와준다. 다음에 답하시오.
Q1. pKa와 연관하여 완충용액을 정의하고, 자연수에서의 완충작용 사례를 두 가지 이상 설명하시오.
A1.
○ 완충용액
○ 소량의 산이나 염기를 첨가할 때 pH가 거의 일정한 용액
○ 약산과 짝염기로 돼 있어야 하므로 평준화 효과를 고려하여 짝산의 pKa가 H3O+의 pKa인 -1.74보다 넉넉히 커야 함
○ 그리고 짝산의 pKa가 H2O의 pKa인 14보다 넉넉히 작아야 함
○ 자연수 내 완충용액
○ 탄산수 : 주로 해양에서 관찰할 수 있으며 pH = 8에서 거의 HCO3-가 존재. 2가 양이온이므로 완충구간이 2개
○ 인산수 : 자연수에서 탄산수 다음으로 많이 관찰되는 완충계. 3가 양이온이므로 완충구간이 3개나 있음
○ (참고) 실험실 완충용액
○ PBS
○ DPBS
○ 트리스 버퍼
○ HEPES 버퍼
○ STE
○ NaAc
○ NH4Ac
○ MES
○ 리파 버퍼
○ 로딩 버퍼
○ 트랜스퍼 버퍼
○ sodium cacodylate buffer
Q2. CH3COOH와 CH3COONa로 완충용액을 만들었다. 이 용액에 소량의 H+을 첨가할 때 일어나는 반응을 기술하시오.
A2.
○ 1단계. 일시적으로 A-가 H+를 만나 HA가 됨
○ 2단계. HA가 많아져서 화학평형이 깨졌으므로 약간의 HA가 H+와 A-로 해리됨 : 1단계보다 훨씬 적은 양
○ 3단계. 1 ~ 2단계가 진동하면서 핸더슨-하셀바흐 방정식에 따라 다음이 성립하게 됨
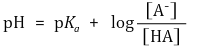
○ 따라서 1단계에 의해 결정된 HA, A-의 비율에 따라 pH가 결정됨
Q3. 0.2 M CH3COOH 15 ml와 0.1 M CH3COONa 20 ml를 섞어서 만든 용액의 pH를 계산하시오. (단, CH3COOH의 pKa = 4.80이고, 답은 소수둘째자리까지 구하시오)
A3.
○ pH = pKa + log ([CH3COO-] / [CH3COOH]) = 4.80 + log (2 / 3) = 4.62
입력: 2022.11.12 10:26
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2007 국가공무원 5급(기술) 제4문 (10) | 2022.11.12 |
|---|---|
| 【환경화학】 2007 국가공무원 5급(기술) 제3문 (0) | 2022.11.12 |
| 【환경화학】 2007 국가공무원 5급(기술) 제1문 (14) | 2022.11.12 |
| 【환경화학】 2008 국가공무원 5급(기술) 제2문 (1) | 2022.09.23 |
| 【환경화학】 2008 국가공무원 5급(기술) 제1문 (8) | 2022.09.23 |



최근댓글