추천글 : 【환경화학】 환경화학 목차
a. 산화환원반응
풀이항상감사해요 님 지적사항 반영 (23.01.28)
당근 님 지적사항 반영 (23.12.16)
Q. 중크롬산칼륨을 산화제로 사용하여 COD를 측정하는 실험과 관련된 문제이다. 아래 주어진 화학식을 참고하여 물음에 답하시오.
○ 미생물에 의한 유기물의 산화반응
C6H12O6 + 6O2 → 6CO2 + 6H2O - ①
○ 산성조건에서 K2Cr2O7가 유기물을 산화시킬 때의 반응식
C6H12O6 + 4K2Cr2O7 + 16H2SO4 → 4Cr2(SO4)3 + 4K2SO4 + 6CO2 + 22H2O - ②
Q1. 식 ②에서 K2Cr2O7의 당량을 구하시오. (단, K2Cr2O7의 g 분자량은 294이다)
A1.
○ K2Cr2O7에서 Cr의 산화수 : +6
○ Cr2(SO4)3에서 Cr의 산화수 : +3
○ 1 g의 K2Cr2O7이 반응할 때 환원되는 전자의 몰 수 = 1 g × 1 mol / 294 g × 2 × 3 = 0.02040816 mol
○ 산화∙환원 반응에서 gram equivalent란 1몰의 전자를 제공하거나 1몰의 전자와 반응하는 물질의 양
○ ∴ K2Cr2O7의 g 당량 = 49 g
Q2. 식 ①과 ②를 비교하여, 유기물과 반응하는 산소와 중크롬산칼륨 사이의 관계를 당량이란 관점에서 설명하시오.
A2.
○ O2에서 O의 산화수 : 0
○ CO2에서 O의 산화수 : -2
○ 1 g의 O2가 반응할 때 환원되는 전자의 몰 수 = 1 g × 1 mol / 32 g × 2 × 2 = 0.125 mol
○ ∴ O2의 g 당량 = 8 g
○ 따라서 COD를 계산할 때 간접적으로 K2Cr2O7를 쓰는데, 이때 K2Cr2O7 49 g이 반응하면 O2가 8 g 반응한 것으로 간주
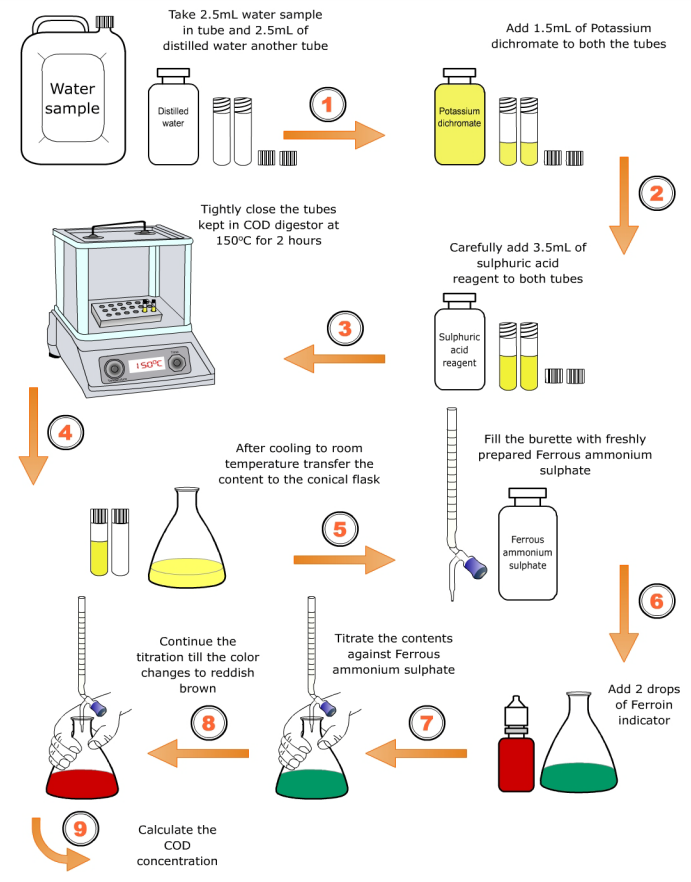
Q3. 수질오염공정법에 제시된 대로 실험을 하는 도중 용액의 색이 주황색에서 청녹색으로 바뀌었다면, 그 이유는 무엇이며 어떤 조치를 해야 하는가?
A3.
Figure. 1. 수질오염공정법
○ 단계 1. 샘플에 중크롬산칼륨을 첨가
○ 단계 2. 만약 첨가한 중크롬산칼륨의 양이 적은 경우 용액의 색이 주황색에서 청녹색으로 변할 수 있음
○ 답안 1.
○ 배경지식 : K2Cr2O7는 주황색이고 Cr2(SO4)3은 청녹색
Figure. 2. 왼쪽은 K2Cr2O7, 오른쪽은 Cr2(SO4)3
○ 이유 : K2Cr2O7이 모두 반응하여 Cr2(SO4)3만 남게 되면 용액은 Cr2(SO4)3의 색인 청녹색이 될 수 있음
○ 조치 : 만약 반응이 완전히 끝나지 않았다면 추가적인 중크롬산칼륨이 필요할 수 있음
○ 단계 3. 만약 첨가한 중크롬산칼륨의 양이 과량인 경우, 이를 정량하기 위한 추가적인 스텝이 필요함
○ 단계 4. 과량의 중크롬산칼륨이 있는 용액에 1~2 방울의 Ferroin [(1,10-phenanthroline-iron (Ⅱ)] 지시약과 과량의 표준 Mohr 염(ferrous ammonium sulphate)을 첨가
○ 단계 5. 이때 용액은 청록색이 됨
○ 답안 2.
○ 배경지식
[Fe(C12H8N2)3]3+ (bluish green) + e- ↔ [Fe(C12H8N2)3]2+ (deep red)
○ 이유 : Ferroin 지시약이 산화된 Fe (Ⅲ) 상태일 때는 청록색, 환원된 Fe (Ⅱ) 상태일 때는 진한 빨간색을 띰
○ 조치 : 수질오염공정법을 제대로 잘 수행하고 있으므로, 마지막 산화환원적정 과정을 통해 Mohr 염, 더 나아가 중크롬산칼륨 및 유기물의 농도를 정량
입력 : 2022.11.12 10:26
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2005 국가공무원 5급(기술) 제1문 (4) | 2023.01.13 |
|---|---|
| 【환경화학】 2006 국가공무원 5급(기술) 제4문 (9) | 2022.12.24 |
| 【환경화학】 2007 국가공무원 5급(기술) 제3문 (0) | 2022.11.12 |
| 【환경화학】 2007 국가공무원 5급(기술) 제2문 (0) | 2022.11.12 |
| 【환경화학】 2007 국가공무원 5급(기술) 제1문 (14) | 2022.11.12 |




최근댓글