추천글 : 【환경화학】 환경화학 목차
a. 산화환원반응
당근 님 지적사항 수정 (23.03.27)
당근 님 지적사항 수정 (23.04.28)
Q. 폐수에 포함된 NO3-를 종속영양균에 의한 탈질반응에 의해 N2로 제거하기 위하여 메탄올을 탄소원 및 전자공여체로 이용하고자 한다. 전자공여체가 미생물 합성으로 이용된 분율(fs)과 에너지로 이용된 분율(fe)이 각각 0.28 및 0.72라고 가정하고, 미생물 합성에 대한 반쪽반응식은 다음과 같다.
〈미생물 합성에 대한 반쪽 반응식〉
1/5 CO2 + 1/20 HCO3- + 1/20 NH4+ + H+ + e- = 1/20 C5H7O2N + 9/20 H2O ... ⒜
1/28 NO3- + 5/28 CO2 + 29/28 H+ + e- = 1/28 C5H7O2N + 11/28 H2O ... ⒝
Q1. NO3- / N2 및 CO2 / CH3OH 각각에 대한 반쪽 반응식을 만드시오.
A1.
○ 2NO3- + 10e- + 12H+ → N2 + 6H2O ... ⒞
○ CO2 + 6e- + 6H+ → CH3OH + H2O ... ⒟
Q2. 폐수의 NO3- 농도가 5 mM이라면, NO3-를 완전히 제거하기 위해서 필요한 최소 메탄올 농도는 몇 mM인가? (단, 폐수에 암모니아성 질소는 존재하지 않는다)
A2.
○ 배경 : 탈질화세균은 호흡 전자전달계에서 최종 전자수용체로 산소 대신 아질산(HNO2)과 질산(HNO3)을 사용. 이 문제의 경우, 질산염(NO3-)이 에너지 대사에서 최종전자수용체로 사용되며 그 반응식은 ⒞와 같음
○ 상황 : 메탄올에 의해 공여된 전자 중 28%는 미생물 합성에 쓰이고, 72%는 에너지로 이용됨. 28%의 전자는 암모니아성 질소와 반응하거나 (⒜), NO3-와 반응함 (⒝). 폐수에 암모니아성 질소가 존재하지 않으므로, 28%의 전자는 오로지 NO3-와 반응한다고 보아야 함
○ 메탄올의 농도 = C mM
○ 메탄올에 의해 공여되는 전자의 농도 (⒟) = 6C mM
○ 에너지로 이용되는 전자의 농도 = 6C × 0.72 mM
○ 에너지로 이용되는 전자와 관련되어 제거되는 NO3-의 농도 (⒞) = 6C × 0.72 / 5 mM
○ 미생물 합성에 이용되는 전자의 농도 = 6C × 0.28 mM
○ 미생물 합성에 이용되는 전자와 관련되어 제거되는 NO3-의 농도 (⒝) = 6C × 0.28 / 28 mM
○ 결론 : 6C × 0.72 / 5 + 6C × 0.28 / 28 = 5 ⇔ C = 5.411255 mM
○ 검토 : 메탄올에 의해 공여되는 탄소원의 농도 = 5.411255 mM > 5/28 × 6 × 5.411255 × 0.28 = 1.623377 mM. 따라서 전자공여체의 농도로만 계산한 위 최소 메탄올 농도 하에서 필요한 탄소원의 양은 충분히 제공돼 추가적인 계산이 필요하지 않음
Q3. 만일 폐수에 암모니아성 질소가 존재한다면, 암모니아성 질소가 존재하지 않는 경우에 비하여 단위 메탄올 당 미생물 합성량이 어떻게 변화할 것인지 그 근거를 들어 답하시오. (단, 두 경우에 암모니아 농도를 제외한 모든 조건은 동일하다)
A3.
○ 전제 : 메탄올 1개당 6개의 전자가 공여되고, 그 중 1.68개의 전자가 미생물 합성에 이용됨
○ ⒜와 ⒝ 반응의 전자 요구량은 동일하지만, ⒜ 반응이 더 많은 미생물 합성량을 산출하므로 암모니아성 질소가 존재함으로 인해 단위 메탄올 당 미생물 합성량이 증가함
○ 검토 : ⒝보다 더 많은 탄소원을 요구하는 ⒜ 반응만 일어나더라도, 메탄올에 의해 공여되는 탄소원은 충분하므로 탄소원은 한계 반응물이 아님
Q4. 만일 메탄올 대신 황 원소(Sº)를 전자공여체로 이용하는 미생물을 이용한다면 제거된 NO3- 당 미생물 합성량은 메탄올을 이용하는 경우에 비하여 어떻게 변화할 것인지 그 근거를 들어 설명하시오.
A4.
○ 가정 1. fs, fe가 변하지 않는 경우
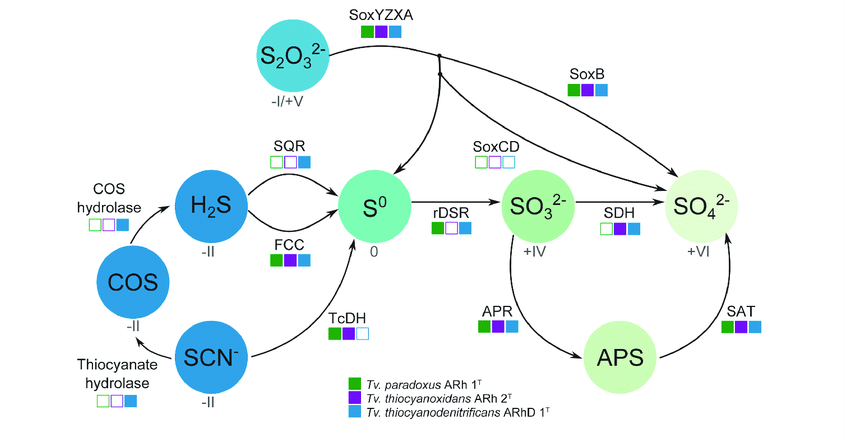
○ 황 원소는 H2S, SCN-, S2O32- 등으로 환원(electron acceptor)할 수 있고, SO32- 등으로 산화(electron donor)할 수 있음
○ S + 3H2O → HSO3- + 5H+ + 4e-와 같은 반응으로 황 원소가 전자 공여체로 이용될 수 있음
○ 결론 1. 전자원으로만 따지면 NO3- 당 미생물 합성량은 메탄올과 다를 이유가 없음
○ 결론 2. 그런데, 황 원소는 탄소원을 제공하지 않으므로 메탄올과 달리 별도 탄소원이 없으면 미생물 합성량이 0이 될 수도 있음
○ 가정 2. fs, fe가 변하는 경우
○ 아래 파일 11페이지를 보면, "독립영양생물은 종속영양생물에 비해 세포 합성에 더 많은 에너지를 소비하기 때문에 일반적으로 세포합성량과 성장속도가 낮음"을 알 수 있음 (ref.)
○ 제거된 NO3- 당 미생물 합성량은 fs / 28 / (fe / 5 + fs / 28)이고, 이 값은 fs가 감소하면 덩달아 같이 감소하는 값임
○ 메탄올 대사는 종속영양탈질이고, 황 대사는 독립영양탈질일 것
○ 그러므로 제거된 NO3- 당 미생물 합성량은 황(S°)으로 전자원이 대체되면서 감소하게 됨
입력: 2022.12.24 14:31
수정: 2023.04.28 21:14
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2018 국가공무원 5급(기술) 제2문 (4) | 2019.03.30 |
|---|---|
| 【환경화학】 2018 국가공무원 5급(기술) 제1문 (3) | 2019.03.30 |
| 【환경화학】 2006 국가공무원 5급(기술) 제2문 (4) | 2019.03.14 |
| 【환경화학】 환경화학 목차 (3) | 2019.01.21 |
| 【전자회로】 전자회로 목차 (0) | 2016.06.26 |



최근댓글