2015 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
1. 표는 3주기 원소인 Si, P, S의 이온화 에너지를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제


⑵ 풀이 : ④
○ ㄱ. 일반적으로 1차 이온화 에너지는 같은 주기에서 족이 증가할수록 증가하지만, 2족 vs 13족 비교와 15족 vs 16족 비교에서는 이것과 반대 경향성이 관찰됨. 따라서 15족인 P보다 16족인 S의 1차 이온화 에너지가 더 작음
○ ㄴ. 14족인 Si와 15족인 P 간의 3차 이온화 에너지 비교는 2족과 13족의 1차 이온화 에너지 비교와 유사함. 그래서 Si보다 P에서 3차 이온화 에너지가 더 낮음
○ ㄷ. | P+의 전자 친화도 | = | E(P+) - E(P) | = 1060 kJ/mol
2. 다음은 S를 중심 원자로 하는 세 가지 화합물이다.
(CH3)2S, (CH3)2SO, (CH3)2SO2
가장 타당한 루이스 구조를 근거로, 위의 세 화합물에 원자가 껍질 전자쌍 반발 이론과 원자가 결합 이론을 적용하여 설명한 것으로 옳지 않은 것은?
⑴ 문제

⑵ 풀이 : ⑤
○ (CH3)2S, (CH3)2SO, (CH3)2SO2의 구조
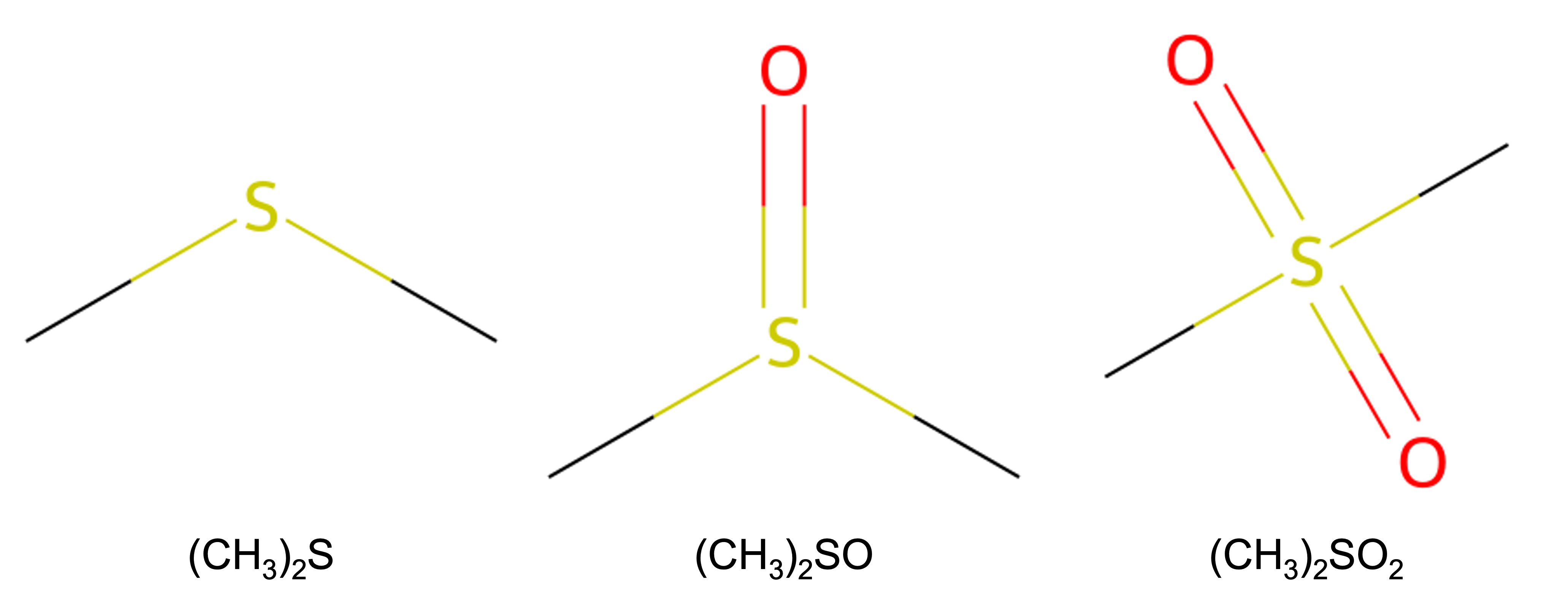
① S는 비공유 전자쌍 2개, 메틸기 2개로 구조수가 4이므로 sp3 혼성
② S의 원자가 전자가 6이므로 비공유 전자쌍은 1개 : S는 3주기 원소이므로 d 오비탈이 있어 옥텟 규칙의 예외를 만듦
③ 보통 (CH3)2S2+O-2와 같이 되어 O의 형식 전하는 -1이 됨
④ (CH3)2SO에 비해 (CH3)2SO2의 경우 O가 하나 더 붙어 있으므로 S의 산화수가 더 증가함
⑤ (CH3)2S의 경우 비공유 전자쌍에 의한 반발이 커서 ∠ (C-S-C)가 가장 작음
3. 그림은 원자 오비탈을 조합하여 만든 분자 오비탈의 에너지 준위 중 일부를 도표로 나타낸 것이며 CN과 CO 분자에 적용될 수 있다. 이 도표를 이용하여 바닥 상태의 CN과 CO에 대해 설명한 것으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
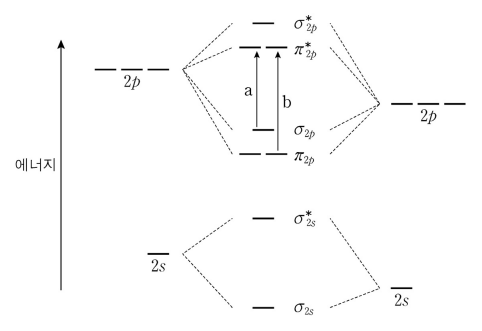

⑵ 풀이 : ①
○ ㄱ : 분자 X의 전자 친화도 = EN = E(X) - E(X-). CN은 σ2s2 σ*2s2 π2p4 σ2p1이므로, CN의 전자 친화도의 절대값은 | E∞ - Eσ2p |. 이에 반해 CO은 σ2s2 σ*2s2 π2p4 σ2p2이므로, CO의 전자 친화도의 절대값은 | E∞ - Eπ*2p |.
○ ㄴ. CN에서 전자 전이 a가 일어나면, 결합차수 = (결합 전자 수 - 반결합 전자 수) / 2가 감소하여 결합세기는 감소하므로 결합 거리는 증가함
○ ㄷ. CO에서 전자 전이 b가 일어나면, C-O 간 π 결합 사이에 노드가 0개에서 1개가 됨. 이로 인해 π electron이 conjugated에서 delocalized 상태가 되므로 전자 밀도가 C, O에서 모두 증가함
4. 그림 ㈎는 고정된 두 막에 의해 영역 (Ⅰ), (Ⅱ), (Ⅲ)으로 분리된 밀폐 용기에 기체 A와 B를 채운 초기 상태를 나타낸 것이다. 그림 ㈏는 두 분리막을 A와 B가 모두 통과할 수 있는 투과막과 B만 통과할 수 있는 반투막으로 각각 변환시킨 후 평형에 도달된 최종 상태를 나타낸 것이다. 이 과정에서 온도는 일정하게 유지하였다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 모든 기체는 이상 기체로 거동한다.)
⑴ 문제
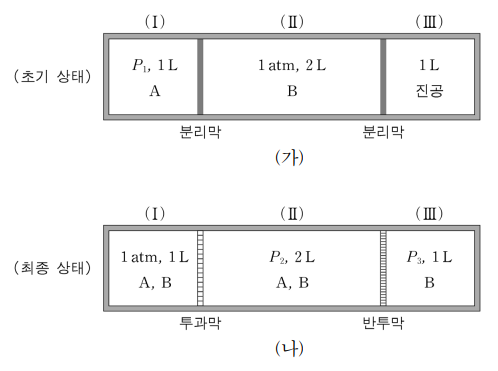

⑵ 풀이 : ④
○ P(Ⅰ), B = P(Ⅱ), B = P(Ⅲ), B = 0.5 atm
○ P(Ⅰ), A = 1 - 0.5 = 0.5 atm = P(Ⅱ), A
○ ㄱ. P1 × 1 L = P(Ⅰ), A × 1 L + P(Ⅱ), A × 2 L = 1.5 atm·L ⇔ P1 = 1.5 atm
○ ㄴ. P3 = P(Ⅲ), B = 0.5 atm
○ ㄷ. 영역 (Ⅰ) 과 (Ⅱ)는 전체 압력이 동일하므로 최종 상태에서 혼합 기체의 몰수는 부피에 비례함
5. 그림은 물의 상평형 도표를, 표는 물의 열역학 상수를 나타낸 것이다. 고립된 10 L의 진공 용기에 0 ℃인 물과 얼음을 각각 3몰씩 넣은 후 평형 상태에 도달되게 하였다. 평형 상태에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 얼음과 수증기의 비열은 물의 비열과 같다.)
⑴ 문제
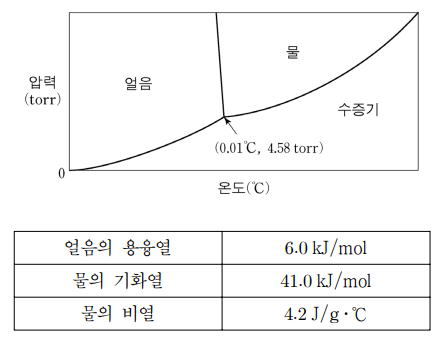

⑵ 풀이 : ⑤
○ 계에 있는 얼음, 물, 수증기의 무게의 합 = 6 mol × 18 g / mol = 108 g
○ 맨 처음에는 진공 용기이므로 물과 얼음이 모두 수증기가 되려는 경향이 나타남 : 즉, 평형 상태가 아님
○ 우선 물 3 L가 모두 수증기가 되었다고 가정 : 41.0 kJ/mol × 3 mol = 4.2 J/g·℃ × T ℃ × 108 g으로부터 하강된 온도 T는 0.27 ℃를 얻음. 즉, -0.27 ℃, 얼음 3 몰, 수증기 3 몰인 상태. 이 상태에서 수증기의 압력은 P = nRT / V = 3 × 0.082 × (273.15 - 0.27) / 10 = 6.71 atm = 5101.8 torr
○ 5101.8 torr는 너무 큰 값이므로 수증기는 다시 최대한 많이 응축시켜야 함 : 만약 수증기가 100퍼 응축되어 물이 된다면 다시 원점이므로 이는 무의미. 수증기가 적당히 응축되고, 물이 다시 얼음으로 응축되어야 무게, 온도, 압력 조건을 모두 만족하는 평형점이 될 것임. 이때 얼음, 물, 수증기가 모두 공존하므로 삼중점이어야 함
○ ㄱ. 삼중점이므로 얼음, 물, 수증기가 모두 공존
○ ㄴ. 삼중점이므로 온도는 0.01 ℃, 압력은 4.58 torr
○ ㄷ. 물 중 일부가 수증기가 되고, 다른 일부가 얼음이 되므로 (단, 전부는 아님), 얼음의 양은 처음보다 많아짐
6. 그림은 25 ℃에서 액체 A와 액체 B가 혼합된 용액의 증기압을 A의 몰분율(xA)에 대해서 나타낸 것이다. xA가 a인 혼합 용액과 평형을 이루고 있는 증기에서 A의 부분 압력과 B의 부분 압력은 같다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 혼합 용액은 이상 용액이고 증기는 이상 기체이다.)
⑴ 문제
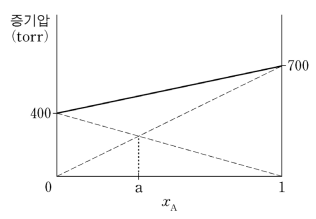

⑵ 풀이 : ①
○ ㄱ. A의 증기압은 700 torr이고, B의 증기압은 400 torr이므로 분자간 인력은 증기압이 작은 B가 더 큼
○ ㄴ. 닮음의 법칙을 이용. 왼쪽 직각삼각형으로부터 구한 점선의 길이 = 400 (1 - a) = 오른쪽 직각삼각형으로부터 구한 점선의 길이 = 700a ⇔ a = 4/11
○ ㄷ. 증기압 = 400 + 300 xA = 550 ⇔ xA = 0.5. 이때 A의 부분 압력은 700 xA = 350 torr.
7. 표는 25 ℃ 표준 상태에서 4가지 물질의 생성 및 연소 엔탈피를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
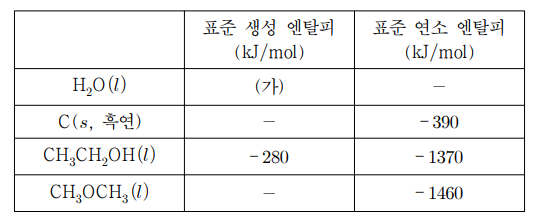

⑵ 풀이 : ⑤
○ ㄱ. C (s, 흑연) + O2 (g) → CO2 (g)의 반응 엔탈피가 -390 kJ/mol로 주어져 있는데, 반응물의 생성 엔탈피가 모두 0이므로 CO2 (g)의 표준 생성 엔탈피도 -390 kJ/mol
○ ㄴ. CH3CH2OH (ℓ) + 3O2 (g) → 2CO2 (g) + 3H2O (ℓ)의 반응 엔탈피가 -1370 kJ/mol로 주어짐. 2 Hf (CO2) + 3 Hf (H2O) - (-280) = -1370을 얻을 수 있어, Hf (H2O) = -290 kJ/mol이 도출됨
○ ㄷ. CH3OCH3 (ℓ) + 3O2 (g) → 2CO2 (g) + 3H2O (g)의 반응 엔탈피가 -1460 kJ/mol로 주어짐. 2 Hf (CO2) + 3 Hf (H2O) - Hf (CH3OCH3) = -780 - 870 - Hf (CH3OCH3) = -1460을 얻을 수 있어, Hf (CH3OCH3) = -190을 얻을 수 있음. 이로 인해 CH3CH2OH → CH3OCH3의 표준 반응 엔탈피는 -190 - (-280) = 90 kJ/mol.
8. 다음은 I-과 (S)-2-iodooctane이 반응해서 (R)-2-iodooctane과 I-이 되는 화학 반응식이고, 그림은 반응 좌표에 따른 에너지를 나타낸 것이다. 반응이 평형에 도달한 후 온도를 올려도 그 값이 변하지 않는 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
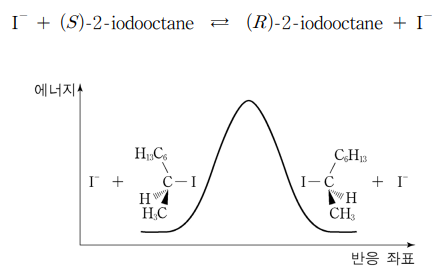

⑵ 풀이 : ③
○ 반응속도의 요인
○ RS 판별법
○ ㄱ. 평형 상수는 반응물과 생성물의 농도를 결정하는데, 반응물과 생성물의 물리·화학적 성질이 사실상 동일하여 온도에 따라 (R)형 혹은 (S)형을 더 선호하게 될 이유가 없음. 그러므로 평형 상수는 일정함
○ ㄴ. (R)형, (S)형까지 포함하는 넓은 의미의 엔트로피에 따르면 반응이 진행됨에 따라 R/S 비율이 변화하여 계의 엔트로피가 달라질 수는 있지만 (즉, S = k ln W에서 R/S 비율이 상태수 W에 영향을 줄 수 있다는 의미), 온도에 따라 반응에서의 엔트로피가 달라질 이유는 없음
○ ㄷ. 온도를 높이면 정반응 속도 상수와 역반응 속도 상수 모두 증가하여 빠르게 동적 평형에 도달함
9. 그림은 R → P 반응에서 일정량의 촉매 X와 촉매 Y를 사용했을 때 280 K와 300 K에서 시간에 따른 R의 농도 변화를 각각 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
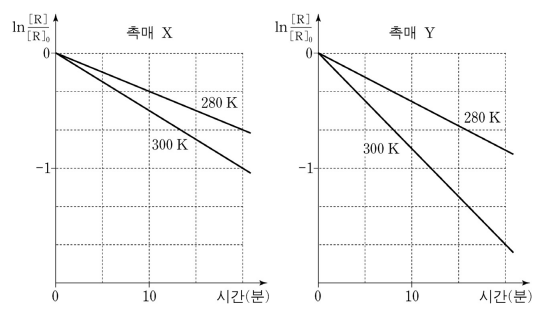

⑵ 풀이 : ⑤
○ ㄱ : ln [R] = ln [R]0 - kt 는 1차 반응의 전형적인 수식
○ ㄴ : 촉매가 X일 때의 기울기가 촉매가 Y일 때의 기울기보다 작으므로 맞는 설명
○ ㄷ : 아레니우스 식 k = A exp (-Ea / RT)로부터, Ea가 클수록 동일한 ΔT에 대해 Δk가 상대적으로 더 작아짐
10. 알라닌(H2NCHCH3COOH)은 수용액에서 H3N+CHCH3COO- 형태로 존재한다. 25 ℃에서 알라닌의 해리 반응식과 평형 상수는 다음과 같다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
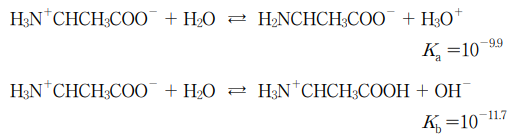

⑵ 풀이 : ④
○ ㄱ. 알라닌의 산 해리 반응이 염기 해리 반응보다 더 선호되므로 (∵ Ka > Kb), 알라닌 수용액은 산성
○ ㄴ. ( [H2NCHCH3COO-][H3O+] / [H3N+CHCH3COO-] ) ÷ ( [H3N+CHCH3COOH][OH-] / [H3N+CHCH3COO-] ) = [H3O+] / [OH-] = 10-9.9 ÷ 10-11.7 = 101.8 - (식 1). [H3O+][OH-] = 10-14 - (식 2). 이로부터 [H+] = 10-6.1임을 알 수 있음
○ ㄷ. [H3N+CHCH3COOH] / [H3N+CHCH3COO-] = 10-11.7 / [OH-] = 10-11.7 / 10-14+3.3 = 10-11.7+14-3.3 = 0.1
11. 다음은 황산 수용액에서 KH(IO3)2와 KI의 반응에 대한 불균형 반응식이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
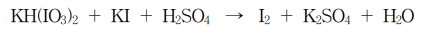

⑵ 풀이 : ③
○ ㄱ. K : +1, H : +1, IO3 : -1, O : -2 → I : +5
○ ㄴ. KI에서 I의 산화수는 -1이고 1/2 I2에서 I의 산화수는 0이므로, KI 1몰당 전자 1몰이 이동
○ ㄷ. 1/2 KH(IO3)2 → 1/2 I2에서 I의 산화수 변화는 -5이고, KI → 1/2 I2에서 I의 산화수 변화는 +1. 그러므로 1 : 5의 개수비로 합쳐주어, 1/2 KH(IO3)2 + 5KI → 3I2와 같은 중간 계산 과정을 얻을 수 있음
12. 표는 25 ℃에서 세 가지 다양성자산의 산 해리 상수를 나타낸 것이고, 그림 ㈎ ~ ㈐는 농도가 0.10 M인 세 가지 산 수용액 25.0 mL를 각각 0.10 M NaOH 표준 용액으로 적정할 때 얻어지는 적정 곡선을 임의의 순서로 나타낸 것이다. 적정 곡선 ㈎ ~ ㈐와 산 용액이 옳게 짝을 지은 것은?
⑴ 문제
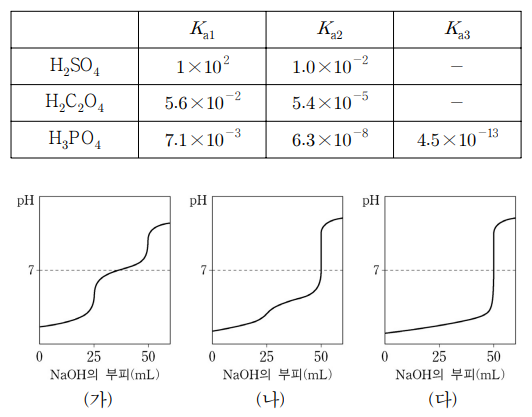
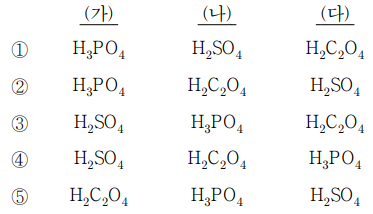
⑵ 풀이 : ②
○ H2SO4 : 이론상 완충 구간이 두 개이나, pH = pKa1은 실험 조건에서 벗어나고 pH = pKa2 = 2는 실험 초기 특유의 완만한 pH 구간과 구분되지 않아 그래프 상에서 완충 구간이 없는 것처럼 보임 → ㈐
○ H2C2O4 : 이론상 완충구간이 두 개이나, pH = pKa1과 pH = pKa2가 비슷해서 7보다 확실히 높은 pH 구간에서 다소 섞인 듯한 하나의 완충 구간이 나옴 → ㈏
○ H3PO4 : 이론상 완충구간이 세 개이나, pH = pKa1은 실험 초기 특휴의 완만한 pH 구간과 구분되지 않고 pH = pKa3는 실험이 끝날 때 완만한 pH 구간과 구분되지 않음. 따라서 그래프 상에서 pH = 8 - log 6.3 ≒ 7 주변에 완충구간 한 개가 관찰됨 → ㈎
13. 그림은 갈바니 전지를 나타낸 것이다. 왼쪽 반쪽 전지에서 Cr2+ (aq)과 Cr3+ (aq)의 농도는 각각 0.2 M과 0.002 M이고, 오른쪽 반쪽 전지에서 Pb2+ (aq)의 농도는 0.1 M이다. 다음 화학식은 각 반쪽 전지의 반응식과 표준 환원 전위(Eº)를 나타낸 것이다. 25 ℃에서 이 전지에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
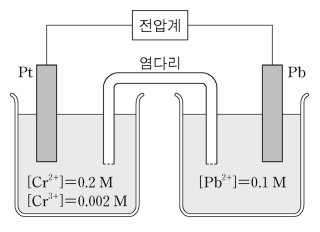
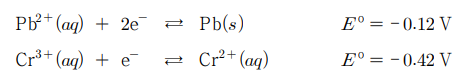

⑵ 풀이 : ③
○ 갈바니 전극
○ ㄱ. Pb2+/Pb 반응의 표준 환원 전위가 Cr3+/Cr2+ 반응의 표준 환원 전위보다 크므로 Pb는 환원하고, Cr2+은 산화함. 따라서 Pb 전극은 환원 전극
○ ㄴ. E = Eº - (0.0592 / n) log ([Cr3+]2 / [Cr2+]2 [Pb2+]) = 0.30 - (0.0592 / 2) log (0.0022 ÷ 0.22 ÷ 0.1) = 0.30 + 3/2 × 0.0592
○ ㄷ. 기전력이 0.30 V인 때는 표준상태일 때이지 전지 반응이 지속될수록 기전력은 감소함
14. 그림은 [Co(NH3)5NO2]2+을 합성하는 과정을 나타낸 것이고, 표는 각 착물의 가시 영역의 최대 흡수 파장(λ최대)과 자기적 성질을 나타낸 것이다. 이에 대한 설명으로 옳은 것은?
⑴ 문제
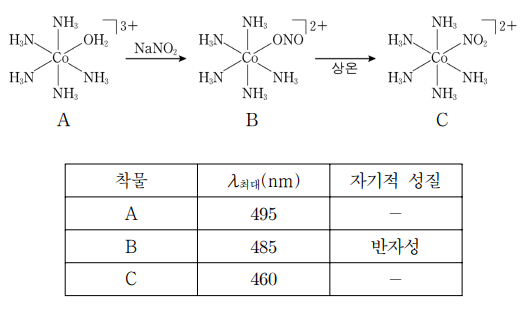

⑵ 풀이 : ②
① B가 반자성인데, ONO-보다 NO2-가 더 강한 장 리간드이므로 C도 반자성
② A와 B에서 Co의 산화수는 모두 +3. 또한 Co의 3d 오비탈 전자는 7개이므로, 세 화합물 모두 Co에서 4s 전자 2개와 3d 전자 1개가 이탈됨
③ B와 C는 구조 이성질체 : 원자의 배열이 다르므로
④ -NO2에서 N은 sp2 혼성이므로 ∠ (Co-N-O)는 120°

⑤ -ONO에서 N도 sp2 혼성
15. 그림은 유기 염소 화합물(RCl)로 오염된 지하수가 철(Fe) 입자로 채워진 다공성 반응벽을 통과하면서 처리되는 과정과 철 표면에서 RCl이 염소가 제거된 유기 화합물(RH)로 변환되는 반응을 나타낸 것이다. 이에 대해 기술한 내용 중 옳지 않은 것은?
⑴ 문제
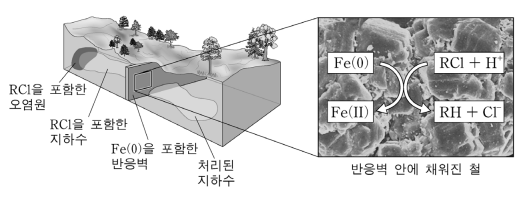

⑵ 풀이 : ②
① RCl에서 R의 산화수는 +1이고, RH에서 R의 산화수는 -1
② 산성 환경에서 2H+ + 2e- → H2 반응이 일어나 Fe → Fe2+ + 2e- 반응이 촉진됨
③ 용존 산소가 낮은 경우 부식되지 않은 intact iron content가 증가해 RCl을 제거할 가용 철 농도가 증가함
④ 일반적으로 금속의 이온화 경향이 클수록 표준 환원 전위가 낮음
○ 금속의 이온화 경향 : K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
⑤ 크기가 작은 입자일수록 단위 질량당 표면적이 큼. 특히 나노 입자 중에서도 다공성 입자가 특별히 고안되기도 함
16. 다음은 수산화 칼슘(Ca(OH)2)의 물에 대한 용해 반응식이다.
Ca(OH)2 (s) ⇄ Ca2+ (aq) + 2OH- (aq)
Ca(OH)2의 용해도곱 상수(Ksp)와 공통 이온 효과를 알아보기 위해 다음과 같은 실험을 하였다. 이에 대한 설명으로 옳은 것은? (단, 실험 과정에서 온도는 일정하게 유지되었다.)
⑴ 문제
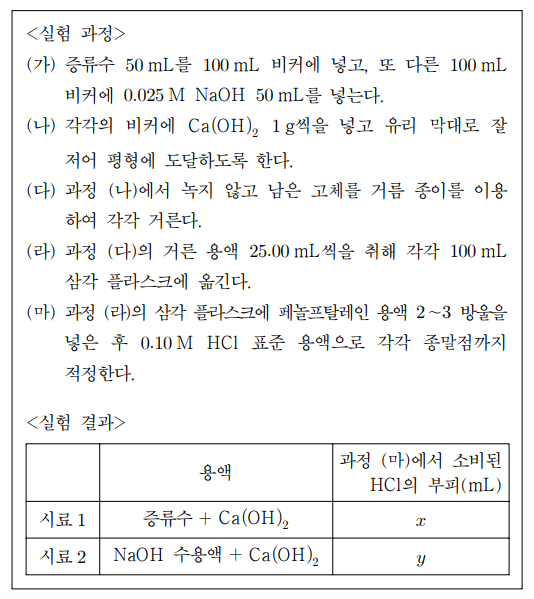

⑵ 풀이 : ③
① 당연히 증류수가 아니라 염기성 용액에 시작하는 경우에 적정에 필요한 HCl의 부피가 더 큼
② Ksp = [Ca2+][OH-]2은 시료 1과 시료 2가 동일함 : 시료 2는 이미 OH-가 높으므로, 시료 1에서 [Ca2+]가 높아야 함
③ 시료 2에서 OH-의 농도 = 0.10 M HCl 표준 용액 × y mL / 25 mL이므로 맞는 설명
④ 반응하지 않고 남은 Ca(OH)2 (s)의 양은 증가함
⑤ Ca(OH)2의 양이 충분하다면, 적정에 소비되는 HCl의 부피에는 전혀 영향이 없음 : 고체의 자유도는 1이므로 용해 반응의 화학평형 식에서 고체인 반응물의 양을 고려하지 않음. 그것이 용해도곱 상수의 원리
입력: 2024.02.24 14:54
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【유기화학】 2022 PEET 유기화학 (0) | 2024.02.04 |
|---|---|
| 【유기화학】 2024 MEET/DEET 유기화학 (0) | 2023.08.13 |
| 【화학】 2024 MEET/DEET 화학 (7) | 2023.08.11 |
| 【유기화학】 2023 PEET 유기화학 (11) | 2023.08.06 |
| 【화학】 2019 MEET/DEET 화학 (2) | 2023.03.16 |




최근댓글