2강. 제2류 위험물
추천글 : 【위험물산업기사】 위험물산업기사 목차
1. 개요 [본문]
2. 황화린 [본문]
3. 적린(P) [본문]
4. 유황(S) [본문]
5. 마그네슘·철분·금속분 [본문]
6. 인화성 고체 [본문]
1. 개요 [목차]
| 유별 | 등급 | 품명 및 품목 | 지정 수량 |
| 제2류 가연성 고체 |
Ⅱ | 1. 황화린 | 100 kg |
| Ⅱ | 2. 적린 | 100 kg | |
| Ⅱ | 3. 유황 | 100 kg | |
| Ⅲ | 4. 마그네슘 | 500 kg | |
| Ⅲ | 5. 철분 | 500 kg | |
| Ⅲ | 6. 금속분 | 500 kg | |
| Ⅱ~Ⅲ | 7. 그밖에 | 100 kg, 500 kg | |
| 8. 1~7 포함 물질 | |||
| Ⅲ | 9. 인화성고체 | 1,000 kg |
Table. 1. 제2류 위험물 표
⑴ 제2류 위험물 특징
① 연소 속도가 빠르다.
② 이온결합 화합물은 상온 ~ 100 ℃ 정도의 녹는점을 가진다.
○ 결합의 세기 : 원자결정 > 이온결합 > 금속결합 > 공유결합
③ 운반용기 및 포장 외부표시
○ 마그네슘·철분·금속분, 인화성 고체 제외 제2류 위험물 : 화기주의
○ 마그네슘·철분·금속분 : 화기주의, 물기엄금
○ 인화성 고체 : 화기엄금
⑵ 혼재 가능 위험물
4류 + 2류, 4류 + 3류, 5류 + 2류, 5류 + 4류, 6류 + 1류
⑶ 암기팁
① 맨 처음 3개는 황적유. 이때 황은 황적유의 3글자처럼 황린(2글자)이 아니라 황화린(3글자)이다.
② 핫팩의 주성분이 철분이고 그것의 지정수량이 500 kg임을 상식적으로 알고 있자.
③ 황적유와 인화성고체의 지정수량은 500의 전후 단계이므로 각각 100 kg과 1,000 kg이 적당
④ 팁. 제2류 위험물은 덜 위험한 제3류 위험물 같다.
2. 황화린 [목차]
⑴ 삼황화린(P4S3)
① 삼황화린의 구조식
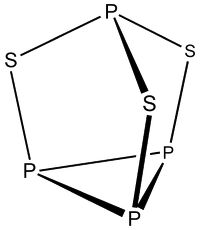
Figure. 1. 삼황화린의 구조식
② 조해성 無 : 삼황화린 내 인의 산화수는 (+3)이 1개, (+1)이 3개이므로 H2O 내 산소의 친핵체 공격이 약함
③ 오산화인(P2O5)은 안정하므로 최종 연소생성물이 되기 쉬움
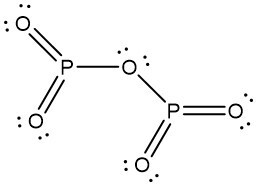
Figure. 2. 오산화인의 구조식
④ 이산화황(SO2)는 양 말단에 공명구조가 있어 안정하므로 최종 연소생성물이 되기 쉬움
○ 반응식 예.
○ P4S3 + 8O2 → 2P2O5 + 3SO 2
⑵ 오황화린(P2S5)
① 오황화린의 구조식

Figure. 3. 오황화린의 구조식
② 조해성 有 : 오황화린 내 원자 중 (+5)의 산화수를 갖는 인이 노출돼 있어 H2O 내 산소의 친핵체 공격이 강함
○ 한 번 친핵체 공격이 이뤄지면 최종적으로 공명으로 인한 안정성을 갖는 인산이온(PO43-) 생성
○ 반응식 예.
○ P2S5 + 8H2O → 5H2S + 2H3PO4
③ 오산화인(P2O5)은 안정하므로 최종 연소생성물이 되기 쉬움
④ 이산화황(SO2)는 양 말단에 공명구조가 있어 안정하므로 최종 연소생성물이 되기 쉬움
○ 반응식 예.
○ 2P2O5 + 15O2 → 2P2O5 + 10SO2
⑶ 칠황화린(P4S7) : 조해성 有
① 칠황화린의 분자식
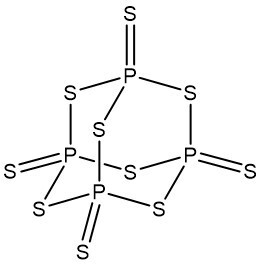
Figure. 4. 칠황화린의 구조식
② 조해성 有 : 오황화린 내 원자 중 (+5)의 산화수를 갖는 인이 노출돼 있어 H2 O 내 산소의 친핵체 공격이 강함
○ 한 번 친핵체 공격이 이뤄지면 최종적으로 공명으로 인한 안정성을 갖는 인산이온(PO43-) 생성
③ 오산화인(P2O5)은 안정하므로 최종 연소생성물이 되기 쉬움
④ 이산화황(SO2)는 양 말단에 공명구조가 있어 안정하므로 최종 연소생성물이 되기 쉬움
3. 적린(P) [목차]
⑴ 황린(P4)의 동소체지만 황린에 비하여 대단히 안정하며 독성이 없음
① 착화점 비교 : 황린 P4 (50 ℃) < 삼황화린 P4S3 (100 ℃) < 황 S (232.2 ℃) < 적린 P (260 ℃)
⑵ 오산화인(P2O5)은 양 말단에 공명구조가 있어 안정하므로 최종 연소생성물이 되기 쉬움
① 반응식 예.
○ 6P + 5KClO3 → 5KCl + 3P2O5
○ 4P + 5O2 → 2P2O5
4. 유황(S) [목차]
⑴ 정의 : 순도 60 % 미만은 위험물에서 제외
① 사방정계 황 : 노랑, H2O·CS2에 녹음
② 단사정계 황 : 노랑, H2O·CS2에 녹음
③ 비정계 황(고무상황) : 흑갈색, H2O·CS2에 녹지 않음

Figure. 5. 황의 상도표
⑵ 이산화황(SO2)는 양 말단에 공명구조가 있어 안정하므로 최종 연소생성물이 되기 쉬움
① 반응식 예.
○ S + O2 → SO2 (푸른색 불꽃반응)
⑶ 황은 가끔 원자가전자가 4개인 탄소처럼 행동
① 반응식 예.
○ SO2 + H2O → H2SO4
⑷ 황(S)은 원자가전자가 같은 산소(O)처럼 행동
① 반응식 예.
○ SO2 + H2O → H2SO4
○ S + H2 → H2S
○ S + Fe → FeS
○ 2S + C → CS2
5. 마그네슘·철분·금속분 [목차]
⑴ 정의
① 철분 : 53 ㎛의 표준체를 통과하는 철의 분말이 50 wt% 미만인 것은 위험물에서 제외
② 마그네슘 : 2 mm의 체를 통과하지 않는 덩어리 및 직경 2 mm 이상의 막대 모양의 것은 위험물에서 제외
③ 금속분 : 150 ㎛ 표준체를 통과하지 않는 기타 금속이 50 wt% 미만인 것은 위험물에서 제외
○ 예. 기타 금속 : 알칼리금속, 알칼리토금속, 마그네슘, 철을 제외한 나머지, 알루미늄분, 아연분 등
⑵ 이온화경향이 큰 염류가 이온으로 해리된 뒤 산 등의 수소를 포함한 물질에서 수소의 자리를 뺏어 수소분자 생성
① 물과도 강렬히 반응하기 때문에 금수성임
② 반응식 예.
○ 2Fe + 6HCl → 2FeCl3 + 3H2
○ Fe + 2HCl → FeCl2 + H2
○ 2Al + 6HCl → 2AlCl 3 + 3H2
○ 2Al + 6H2O → 2Al(OH)3 + 3H2
○ 2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
○ 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
○ Zn + 2H2O → Zn(OH)2 + H2
○ Zn + 2HCl → ZnCl2 + H2
○ Zn + H2SO4 → ZnSO4 + H2
○ Zn + 2CH3COOH → (CH3COO)2Zn + H2
○ Mg + 2H2O → Mg(OH)2 + H2
○ Mg + 2HCl → MgCl2 + H2
○ Mg + H2SO4 → MgSO4 + H2
⑶ 산화환원반응 : 수소뿐만 아니라 이온화경향이 차이나는 다른 금속류와 반응을 할 수 있다.
① 반응식 예.
○ 8Al + 3Fe3O4 → 4Al2O3 + 9Fe
○ 테르밋 반응(Thermite Reaction) : 2Al + Fe2O3 → 2Fe + Al2O3
○ 주변에서 쉽게 구할 수 있는 물질로 상당한 열을 만드는 특징

○ 은행강도 관련 영화에서 자주 등장
⑷ 연소반응 : 산소와 반응하면 원자가전자에 따라 적절하게 최종 생성물이 결정된다.
① 반응식 예.
○ 4Fe + 3O2 → 2Fe2O3
○ 4Al + 3O2 → 2Al2O3
○ 2Mg + O2 → 2MgO
⑸ 마그네슘은 반응성이 강하기 때문에 이산화탄소로부터 연소반응을 하거나 물로부터 MgO를 생성한다.
① 워낙 이온화경향이 강해 이산화탄소의 공유결합을 끊고 이온결합을 한다.
② 반응식 예.
○ 2Mg + CO2 → 2MgO + C
○ Mg + H2O → MgO + H2
6. 인화성고체 [목차]
⑴ 인화성고체 : 고형 알코올 또는 1기압에서 인화점이 40 ℃ 미만인 고체
⑵ 예 : 고형 알코올
입력: 2018.03.07 23:50
'▶ 자연과학 > ▷ 위험물기능장∙산업기사' 카테고리의 다른 글
| 【위험물산업기사】 5강. 제5류 위험물 (2) | 2018.01.21 |
|---|---|
| 【위험물산업기사】 4강. 제4류 위험물 (17) | 2018.01.21 |
| 【위험물산업기사】 3강. 제3류 위험물 (0) | 2018.01.21 |
| 【위험물산업기사】 1강. 제1류 위험물 (147) | 2018.01.21 |
| 【위험물산업기사】 위험물산업기사 노트 (0) | 2018.01.12 |

최근댓글