추천글 : 【환경화학】 환경화학 목차
a. 화학의 기초
풀이항상감사해요 님 지적사항 수정 (2023.03.23)
Q. 다음의 농도를 계산하시오.
Q1. 물 속에서 톨루엔(C6H5CH3)이 0.001 mg/L 검출되었다. 이 물 1.0 L 안에 있는 톨루엔을 모두 기화시켜 10 L의 테들러백(Tedlar bag)에 담았을 때 농도를 ppm 단위와 g / ㎥의 단위로 나타내시오. (0 ℃, 1기압에서 계산)
A1.
⑴ 공통 풀이
물 1 L에 톨루엔은 0.001 mg이 함유돼 있다.
g / ㎥ 단위로 나타내면 다음과 같다.
0.001 × 10-3 ÷ 10 × 1,000 = 100 μg / ㎥
⑵ 질량 분율로 푸는 경우
ppm 단위로 나타내면 다음과 같다.
10 L × 1.293 g air / L = 12.93 g air
따라서 0.001 × 10-3 ÷ 12.93 × 106 = 0.07734 ppm
⑶ 부피 분율로 푸는 경우
톨루엔의 분자량은 12 × 7 + 1 × 8 = 92 g / mol이다.
ppm 단위로 나타내면 0.0243 ppm을 얻는다.
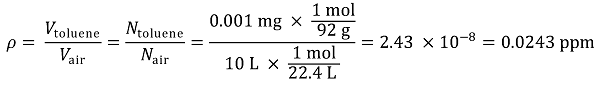
⑷ 수중에서는 질량분율을 따르는 반면, 대기중에서는 부피분율을 따르므로 ⑶의 풀이를 따라야 함
Q2. 물속의 Ca (m.w. = 40) 농도가 10 μM일 때 이를 ppm으로 계산하시오.
A2.
물 1 L (1,000 g)에 Ca가 10 μmol이 녹아 있다.
10μ × 40 ÷ 1000 × 106 = 0.4 ppm
Q3. 토양 10 kg에서 벤젠(C6H6)이 50 μmol이 검출되었다. 이는 몇 ppm인가?
A3.
벤젠의 분자량은 78이다.
50μ × 78 ÷ 10,000 × 106 = 0.39 ppm
입력: 2019.04.04 09:02
수정: 2023.03.03 23:33
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2011 국가공무원 5급(기술) 제4문 (2) | 2019.04.04 |
|---|---|
| 【환경화학】 2011 국가공무원 5급(기술) 제3문 (3) | 2019.04.04 |
| 【환경화학】 2011 국가공무원 5급(기술) 제1문 (7) | 2019.04.03 |
| 【환경화학】 2012 국가공무원 5급(기술) 제5문 (5) | 2019.04.02 |
| 【환경화학】 2012 국가공무원 5급(기술) 제4문 (0) | 2019.04.02 |


최근댓글