1강. 화학의 기초
추천글 : 【화학】 화학 목차
a. 유기화학의 기초
1. 화학이란 [목차]
⑴ 화학 : 물질(matter)을 다루는 학문
① 물질의 구성, 성질, 구조
② 물질의 변화
⑵ 물질의 상(phase)
① 고체(solid)
○ 단단한 모양과 고정된 부피를 가지고 있음
② 액체(liquid)
○ 고체보다 불규칙
○ 움직임이 비교적 자유롭기 때문에 흐르는 성질이 있음
○ 일정한 모양이 없어서 담는 그릇의 모양에 따라 모양은 변하지만 부피 일정
③ 기체(gas)
○ 액체보다 훨씬 불규칙
○ 분자 사이의 거리가 매우 멀기 때문에 분자 간 영향력 전무
○ 같은 부피의 고체나 액체에 비해 매우 가벼움
○ 압축하면 모양과 부피가 달라짐
○ 공간 차지
⑶ 물질의 분류
① 순물질 : 홑원소 물질과 화합물로 구분
② 혼합물 : 균일 혼합물과 불균일 혼합물로 구분
③ 홑원소 물질
○ 한 가지의 원소로만 이루어진 물질
○ 예 : 구리(Cu), 질소(N2), 철(Fe), 다이아몬드(C), 알루미늄(Al)
④ 화합물
○ 두 가지 이상의 다른 원소들이 일정 비율로 구성된 물질
○ 예 : 이산화탄소(CO2), 황산구리(CuSO4), 물(H2O)
⑤ 균일 혼합물(용액)
○ 두 가지 이상의 순물질이 균일하게 섞여서 모든 부분의 조성이 같은 혼합물
○ 예 : 공기, 설탕물, 소금물, 합금
⑥ 불균일 혼합물
○ 두 가지 이상의 순물질이 불균일하게 섞여서 취하는 부분에 따라 조성이 다른 혼합물
○ 예 : 흙탕물, 우유, 화강암, 혈액, 연기
⑷ 물질의 성질
① 물리적 성질
○ 어떤 물질의 화학적 조성의 변화 없이 물질의 상이나 형태만의 변화가 일어나는 것
○ 예 : 색깔, 녹는점, 끓는점, 밀도, 용해도 등
② 화학적 성질
○ 어떤 물질이 화학적 반응을 통해 새로운 물질로 변환하는 것
2. 화학식의 문법 [목차]
⑴ 원자, 원소, 분자, 이온
① 원자 : 대부분의 화학반응에 있어 구조의 단위. 1900년대 이후 원자보다 더 작은 단위가 관찰됨
② 원소 : 같은 특징을 갖는 원자들의 집합
③ 분자 : 원자가 모여 기능의 단위를 이루는 것
④ 이온 : 원자가 전자를 얻거나 잃어서 전하를 띠는 것
⑤ 원자 또는 이온의 표시
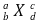
○ a : 양성자 수 + 중성자 수
○ b : 양성자 수
○ c : X의 하전 상태를 표시. -2, -, +, +2 등
○ d : X가 몇 개 있는지를 표시
⑥ 동위원소(isotope) : 원자번호는 같지만 중성자의 수가 달라 질량수가 다른 관계의 원소
⑵ 몰(mole)
① 몰 : 원자나 분자의 수를 헤아리는 단위
② 아보가드로수(NA, Avogadro number) : 1몰에 포함된 원자의 수. 즉 12C 12.00 g에 포함된 원자의 수
NA = 6.02 × 1023개
③ 기체 1몰의 부피는 기체의 종류에 관계없이 일정, STP(0 ℃, 1 기압)에서 기체 1몰의 부피는 22.4 L
○ 이상기체 상태방정식으로부터 유도
④ 사람은 약 10,000 몰로 구성돼 있음
⑶ 화학식, 화학반응식과 반응수득률
① 화학식 : 물질을 표현하는 수단
○ 실험식(empirical formula) : 원자들의 가장 간단한 정수비로 표시
○ 예 : 포도당의 실험식은 CH2O
○ 분자식(molecular formula) : 하나의 분자를 이루는 실질적인 원자들의 개수비를 표시
○ 예 : 포도당의 분자식은 C6H12O6
○ 실험상 화학식의 결정 : 질량 백분율 조성 조사 → 실험식 결정 → 분자식 결정(mass spectrometry 이용)
② 구조식
⑷ 화학량론(stoichiometry)
① 질량
○ 원자량 : 원자 1개의 상대적인 질량. 12C = 12.00을 기준으로 하여 정한 상댓값 (단위 없음)
○ 분자량 : 분자 1개의 상대적인 질량. 분자에 포함된 원자의 원자량을 모두 더한 값 (단위 없음)
○ 실험식량 : 실험식에 포함된 원자의 원자량을 모두 더한 값
○ 평균 원자량 : 존재비율에 따른 산술 평균값. 다음은 탄소의 평균원자량을 계산하는 과정
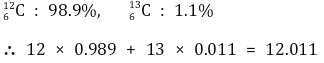
② 농도(concentration)
○ 몰 농도(molar concentration) : 용질의 몰수(mol) ÷ 용액의 부피(L)
○ 몰랄 농도(molal concentration) : 용질의 몰수(mol) ÷ 용매의 질량(kg)
○ 끓는점 오름, 어는점 내림 등과 관련
○ 몰 분율(mole fraction) : 특정 용질의 몰수(mol) ÷ 전체 몰 수(mol), 무차원량
○ 질량퍼센트 : 용질의 질량(kg) ÷ 용액의 질량(kg) × 100 (%)
○ ppm (parts per million), ppb (parts per billion)
○ 1 ppm X = 10-6 kg X / 1 kg 용액
○ 1 ppb X = 10-9 kg X / 1 kg 용액
○ ppmv (pars per million by volume), ppbv (parts per billion by volume)
○ 1 ppmv X = 10-6 L X / 1 L 용액
○ 1 ppbv X = 10-9 L X / 1 L 용액
③ 그램 당량(gram equivalent)
○ 원자량 혹은 분자량을 당량으로 나눈 것
○ 즉, 1몰 당량에 해당하는 양이 특정 물질의 몇 그램인지를 의미함
3. 화학 반응식 [목차]
⑴ 화학 반응식 : 화학반응을 화학식을 이용해 표시한 식
① 반응물(reactant)
② 생성물(product)
③ 시약(reagent) : 실험실에서 사용 가능한 화학물질
④ 방관자 이온(spectator ion) : 반응에 참가하진 않지만 존재하는 것을 나타내기 위해 표시한 이온
○ 방관자 이온을 제외한 반응식을 알짜 이온 반응식(net ionic equation)이라고 함
⑤ 화학 반응식의 작성 방법
○ 1단계. 반응물과 생성물을 화학식으로 나타냄
○ 2단계. skeletal equation : 어떤 화학종이 반응하는지만 적어 놓은 화학 반응식
○ 3단계. balanced chemical equation : skeletal equation에서 각 계수를 계산한 화학 반응식
○ 4단계. detailed chemical equation : 각 화학종의 상태(예 : g, l, s, aq) 및 조건(예 : Δ, hν)도 기입한 화학 반응식
○ 기체 상태 : (g)
○ 액체 상태 : (l)
○ 고체 상태 : (s)
○ 수용액 상태 : (aq)
⑵ 화학 반응식의 법칙
① 질량 보존의 법칙 : 핵반응이 아닌 이상 각 원자에 대해 수가 보존돼야 함
② 전하 보존의 법칙 : 반응물들의 전하량 합과 생성물들의 전하량 합이 일치해야 함
③ 일정 성분비의 법칙(law of definite proportions) : 한 원소와 다른 원소가 결합할 때 일정한 정수비를 이룸
④ 배수비례의 법칙(law of multiple proportions) : 한 원소의 일정량과 결합하는 다른 원소의 질량의 종류는 일정한 정수비를 이룸
○ 단, 두 원소가 두 종류 이상의 화합물을 생성할 때
⑶ 화학 반응식의 계수 계산
① 산화환원 반응의 경우 산화 화학종과 환원 화학종의 산화수 변화비의 역수비가 곧 계수비가 됨
○ 일반적으로 산화환원반응은 산화수가 변하는 화학종의 계수를 정한 뒤 H2O, H+의 계수를 적당히 맞춰줌
② 예시
○ C6H14 + O2 → CO2 + H2O
○ 1C6H14 + O2 → CO2 + H2O
○ 1C6H14 + O2 → 6CO2 + H2O (∵ C)
○ 1C6H14 + O2 → 6CO2 + 7H2O (∵ H)
○ 1C6H14 + 19/2O2 → 6CO2 + 7H2O (∵ O)
○ 2C6H14 + 19O2 → 12CO2 + 14H2O
⑷ 한계 반응물(limiting agent) : 한계시약(limiting agent)이라고도 함
① 반응에서 모두 소모되는 물질
② 반응 후 생성물의 양은 한계 반응물의 양에 비례
⑸ 수득율(percentage reaction yield)(%) = 실제 수득량 / 이론 수득량 × 100
① 실제로는 반응이 완전히 일어나지 않고 역반응으로 인해 중간에 화학평형을 이룸
⑹ 반응의 분류
① 모든 반응은 전자의 이동을 통해 반응물의 결합이 분해되고 생성물의 결합이 생성되면서 이뤄짐
② 전자의 이동이 있어 산화수 변화가 있는 경우 : 산화환원반응
③ 전자의 이동은 있으나 산화수 변화가 없는 경우 : 산염기반응. 침전반응과 그렇지 않은 반응으로 세분화
입력: 2019.01.08 21:46
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 4강. 양자역학 1부 - 물질파의 도입 (0) | 2018.12.24 |
|---|---|
| 【화학】 3강. 원자가 전자쌍 반발 이론(VSEPR) (3) | 2018.12.20 |
| 【화학】 5강. 양자역학 2부 - 슈뢰딩거 방정식 (12) | 2018.12.20 |
| 【화학】 2강. 고전원자론 (0) | 2018.12.20 |
| 【화학】 백금 배위화합물 합성 (0) | 2016.06.25 |




최근댓글