추천글 : 【환경화학】 환경화학 목차
a. 산·염기 반응
b. 용액과 헨리의 법칙
우엉 님 지적사항 수정 (22.09.24)
굿 님 지적사항 수정 (23.03.23)
당근 님 지적사항 수정 (23.04.28)
Q. 25 ℃에서 오염되지 않은 공기와 평형을 이루는 순수한 물에 대한 다음 물음에 답하시오. (단, 건조한 공기 중 CO2의 농도는 350 ppm(0.035 %)이며, [H+] = [HCO3-]라고 가정한다)
H2O (l) ↔ H+ (aq) + OH- (aq), Kw = 1 × 10-14
CO2 (aq) + H2O (l) ↔ HCO3- (aq) + H+ (aq), Ka1 = 4.45 × 10-7
HCO3- (aq) ↔ CO32- (aq) + H+ (aq), Ka2 = 4.69 × 10-11
CO2 (g) ↔ CO2 (aq), KH = 3.38 × 10-2 (M atm-1)
Q1. 물의 pH 값을 계산하시오.
A1. pH는 5.64이다.
⑴ 질량분율로 구한 경우

⑵ 부피분율로 구한 경우
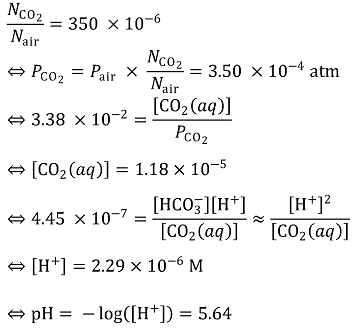
⑶ 수중에서는 질량분율을 따르는 반면, 대기중에서는 부피분율을 따르므로 ⑵의 풀이를 따라야 함
⑷ 중요. 물과 공기가 평형을 이루는 점, 이산화탄소 분율은 건조한 공기 기준이라는 점으로부터 위 풀이는 비슷해도 다음과 같이 수정돼야 함
350 × 10-6 → 350 × 10-6 × (1 - 0.0313)
(단, 0.0313 atm은 25 ℃ 하에서 수증기의 증기압)
Q2. 공기 중 CO2의 농도가 5배가 되었을 경우 순수한 물의 pH 값을 구하시오.
A2.
CO2 (g)의 농도가 5배가 되면 CO2 (aq)의 농도 또한 5배가 된다.
CO2 (aq)의 농도가 5배가 되면 H+ (aq)의 농도는 √5 = 2.236배가 된다.
H+ (aq)의 농도가 √5배가 되면 pH는 log √5만큼 감소한다. 즉, pH는 5.38이 된다.
입력: 2019.11.04 20:52
수정: 2023.04.28 21:30
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【환경화학】 2019 국가공무원 5급(기술) 제5문 (2) | 2019.11.04 |
|---|---|
| 【환경화학】 2019 국가공무원 5급(기술) 제4문 (17) | 2019.11.04 |
| 【환경화학】 2019 국가공무원 5급(기술) 제2문 (8) | 2019.11.04 |
| 【환경화학】 2019 국가공무원 5급(기술) 제1문 (11) | 2019.11.04 |
| 【전자회로】 2018 국가공무원 5급(기술) 제1문 (9) | 2019.07.30 |



최근댓글