추천글 : 【환경화학】 환경화학 목차
a. 이론 : 산·염기 반응, 산화환원 반응, 전기화학
b. 비슷한 문제 : 2013년 2문, 2017년 3문, 2022년 2문
Q. 다음은 25 ℃에서 pE 값과 pH 값에 따른 질소의 물속 주 화학종 유형을 나타낸 도표이다. (단, 농도와 활동도는 동일하다고 가정한다)
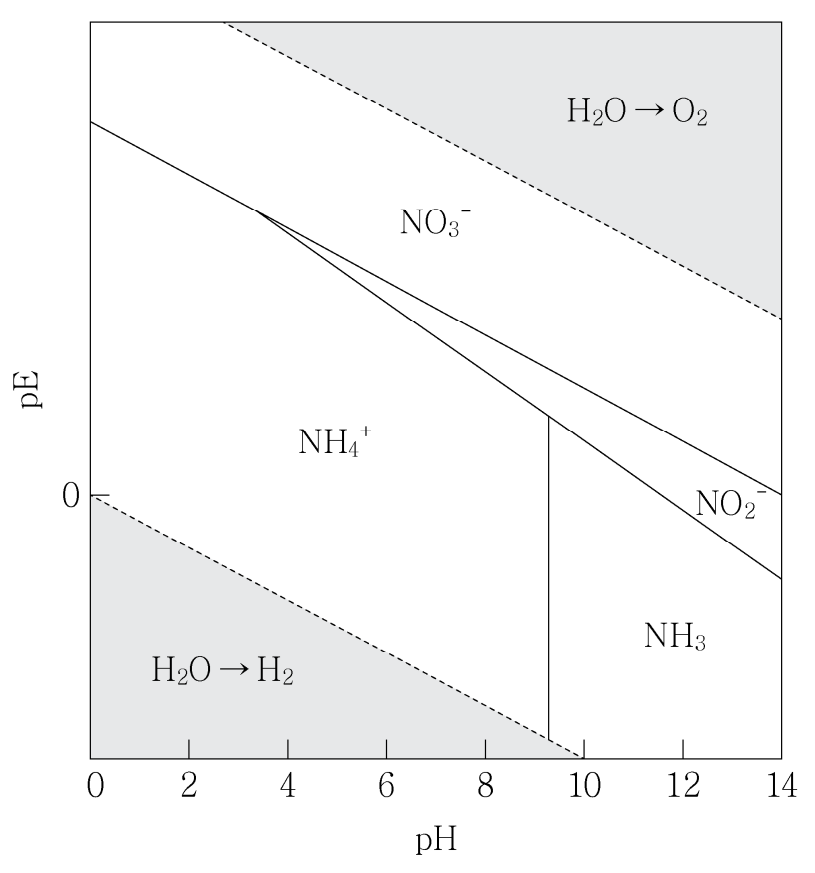
Q1. pE를 정의하고, pE와 물속 질소화학종의 관계를 설명하시오.
A1.
pE = -log [e-]를 의미한다.
pE가 증가할수록 NH4+ → NO3- (낮은 pH), NH4+ → NO2- → NO3- (중간 pH), NH3 → NO2- → NO3- (높은 pH)가 된다.
질소의 산화수는 NH4+, NH3에서 -3, NO2-에서 +3, NO3-에서 +5이다.
따라서 pE가 증가할수록 질소화학종 내 질소의 산화수는 증가하는 경향이 있다.
Q2. 다음 두 반쪽 반응을 이용하여 물속에서 NO2- (aq)를 주 화학종으로 발견할 수 없는 pH의 범위를 구하시오.
○ NO3- (aq) + 10H+ (aq) + 8e- → NH4+ (aq) + 3H2O (ℓ), K1, pEº = 14.88
○ NO2- (aq) + 8H+ (aq) + 6e- → NH4+ (aq) + 2H2O (ℓ), K2, pEº = 15.08
A2.
2번 문제는 NO2-가 주 화학종으로 존재하는 pH, pE 경계선 방정식을 구하는 문제이다.
pE°는 -log E°가 아니라 -log ([e-])를 의미한다.
○ NO2- / NH4+ 경계식 :
반응식 2의 경우, K2 = 일정 = [NH4+] / ([NO2-][H+]8[e-]6)을 얻을 수 있다.
log K2 = 일정 = log [NH4+] - log [NO2-] + 8 pH + 6 pE = 6 pEº (∵ 표준 조건에서도 성립해야 함) = 90.48
[NH4+]와 [NO2-]가 모두 주생성물이고 둘의 농도가 동일할 때, 8 pH + 6 pE = 90.48이 성립한다.
○ NO2- / NH3 경계식 :
3번 문제 풀이를 보면, 7 pH + 6 pE = 81.22가 성립한다.
○ NO3- / NO2- 경계식 :
반응식 1의 경우, K1 = 일정 = [NH4+] / ([NO3-][H+]10[e-]8)을 얻을 수 있다.
log K1 = 일정 = log [NH4+] - log [NO3-] + 10 pH + 8 pE = 8 pEº (∵ 표준 조건에서도 성립해야 함) = 119.04
반응식 2의 경우, K2 = 일정 = [NH4+] / ([NO2-][H+]) = 90.48
log K2 = 일정 = log [NH4+] - log [NO2-] + 8 pH + 6 pE = 6 pEº (∵ 표준 조건에서도 성립해야 함) = 90.48
log K1 - log K2 = log [NO2-] - log [NO3-] + 2 pH + 2 pE = 28.56
[NO3-]와 [NO2-]가 모두 주생성물이고 둘의 농도가 동일할 때, 2 pH + 2 pE = 28.56이 성립한다.
따라서 NO2-를 주 화학종으로 발견할 수 없는 pH의 범위는 다음과 같이 결론 지을 수 있다.
pE < -(8/6) pH + 15.08 (∵ NO2- / NH4+ 경계식)
또는 pE < -(7/6) pH + 13.53667 (∵ NO2- / NH3 경계식)
또는 pE > -pH + 14.28 (∵ NO3- / NO2- 경계식)
위와 같은 답안은 3번 문제를 먼저 풀어야 하므로 출제 취지에 덜 가까워 보인다.
NO2- / NH4+ 경계식과 NO3- / NO2- 경계식의 교점을 구해보자.
pE = -(8/6) pH + 15.08 = -pH + 14.28 ⇔ 1/3 pH = 15.08 - 14.28 = 0.8 ⇔ pH = 2.4
따라서 NO2-를 주 화학종으로 발견할 수 없는 pH의 범위는 pH < 2.4이다.
Q3. NH4+ (aq)와 NH3 (aq)의 경계가 pH = 9.26일 때, NH4+ (aq)의 산 해리 상수를 구하고, NO2- (aq)와 NH3 (aq)의 경계를 나타내는 pE-pH 식을 구하시오.
A3.
산·염기 반응은 산화수가 바뀌지 않는 반응이기 때문에 pE만 바뀌고 pH는 일정한 형태의 그래프 개형을 보인다.
pH = 9.26으로부터, Ka = KNH4+/NH3 = [NH3][H+] / [NH4+] = 10-9.26 (이 수식은 [NH3] = [NH4+]에도 성립해야 함)
즉, pKa = 9.26이 성립한다.
반응식 3 : NO2- (aq) + 7H+ (aq) + 6e- → NH3 (aq) + 2H2O (ℓ)
○ NO2- / NH3 경계식
반응식 3의 경우, K3 = 일정 = [NH3] / ([NO2-][H+]7[e-]6) = [NH4+] / ([NO2-][H+]8[e-]6) × [NH3][H+] / [NH4+]
∴ K3 = K2 × Ka
log K3 = 일정 = log [NH4+] - log [NO2-] + 8 pH + 6 pE + log Ka = 6 pEºNH4+ - 9.26 = 90.48 - 9.26 = 81.22
log K3 = log [NH3] - log [NO2-] + 7 pH + 6 pE = 81.22
[NH3]와 [NO2-]가 모두 주생성물이고 둘의 농도가 동일할 때, 7 pH + 6 pE = 81.22가 성립한다.
입력: 2024.07.10 10:44
'▶ 자연과학 > ▷ 5급 기술고시 풀이' 카테고리의 다른 글
| 【상하수도공학】 2018 국가공무원 5급(기술) 제4문 (0) | 2024.12.17 |
|---|---|
| 【환경화학】 2024 국가공무원 5급(기술) 제5문 (1) | 2024.07.10 |
| 【환경화학】 2024 국가공무원 5급(기술) 제4문 (0) | 2024.07.10 |
| 【환경화학】 2024 국가공무원 5급(기술) 제3문 (6) | 2024.07.10 |
| 【환경화학】 2024 국가공무원 5급(기술) 제2문 (0) | 2024.07.10 |



최근댓글