9-2강. 웨스턴블롯팅 프로토콜
추천글 : 【생물학】 9강. DNA 테크놀로지
1. gelation [본문]
2. sample running [본문]
3. sample preparation [본문]
4. primary antibody 부착 및 저장 [본문]
5. secondary antibody 부착 [본문]
6. 전기영동 [본문]
7. 단백질 로딩 양을 조절하여 최적의 실험조건을 탐색 [본문]
1. gelation [목차]
⑴ 1-1. gelation에 쓰이는 한 쌍의 슬라이드 글래스에 있는 얼룩을 알코올 + 킴테크로 지우기
⑵ 1-2. 그 슬라이드 글래스 쌍을 형틀에 끼운 뒤 고정
① 두 슬라이드 글래스 모두 형틀 한쪽면과 바닥면이 닿도록 한 뒤 고정해야 함
○ 이유 : 이후의 과정에서 젤이 굳기 전에 용액이 흘러나오는 것을 방지하기 위함
② 한 슬라이드 글래스는 앞뒤와 위아래가 있음
⑶ 1-3. gelation 장치 위에 스펀지를 올려놓고 물을 뿌린 뒤 1-2에서 작업한 형틀을 올려놓음
⑷ 1-4. 물을 슬라이드 글래스 사이의 틈을 통해 넣고 20분간 기다림
① 물이 새어 나오면 슬라이드 글래스를 제대로 고정하지 않은 것임
② 이후의 과정에서 젤이 굳기 전에 용액이 흘러나오는 것을 방지하기 위함
⑸ 1-5. stacking gel solution과 running gel solution을 제조 : APS 및 TEMED 첨가 직전까지 수행
⑹ 1-6. 기다린 뒤 gelation 장치를 싱크대에 들고 간 후 장치를 거꾸로 뒤집어 물을 제거함
⑺ 1-7. gelation 장치를 한쪽으로 기울여 슬라이드 글래스 사이에 있는 잔존 수분을 제거함
① 제거할 때 킴테크를 사용하여 물을 닦아주는 게 좋음
⑻ 1-8. stacking gel solution에 APS 및 TEMED를 첨가한 뒤 슬라이드 글래스 사이의 틈을 통해 넣음
⑼ 1-9. 이소프로판올 1 ㎖를 첨가함으로써 거품을 제거하고 stacking gel을 더 평탄하게 만들 수 있음
⑽ 1-10. stacking gel solution의 gelation을 위해 기다림
① stacking gel solution을 약간 더 많이 만듦으로써 넣고 나서 남은 solution의 gelation을 통해 슬라이드 글래스 내 solution의 gelation을 추측할 수 있음
② gelation은 발열반응이므로 gel이 약간 따뜻한 것을 알 수 있음
⑾ 1-11. gelation이 끝난 후 싱크대에 이소프로판올을 제거하고 증류수로 4-5회 세척함
⑿ 1-12. running gel solution에 APS 및 TEMED를 첨가한 뒤 슬라이드 글래스 사이의 틈을 통해 넣음
⒀ 1-13. 즉시 comb를 끼워줌
① comb를 45° 기울인 뒤 쭉 running gel의 표면을 밀고 들어간 뒤 벽에 닿으면 천천히 comb의 반대쪽을 잠기게 함
② 한 번 잠기게 한 comb를 절대로 다시 꺼내면 안 됨
⒁ 1-14. running gel solution의 gelation이 끝난 뒤 comb를 뺌
⒂ 1-15. gel을 소시지처럼 보고 킴테크로 샌드위치처럼 감싼 뒤 락앤락 박스에 놓고 물을 채워 넣음. 냉장 보관
2. sample running : 프로틴을 젤 상에 running시키는 과정 [목차]
⑴ 2-1. BCA assay를 통해 각 샘플별로 total protein을 정량
⑵ 2-2. 그 중 일정한 protein 양만큼 젤에 로딩함
⑶ 2-3. 전기영동
3. sample preparation [목차]
⑴ 프로틴을 PVDF membrane에 부착시키는 과정
⑵ PVDF membrane과 nitrocellulose membrane
① PVDF membrane
○ 장점 : protein binding degree가 좋음
○ 단점 : 노이즈가 많음. activation 과정이 필요함
② nitrocellulose membrane
○ 장점 : 노이즈가 적음
○ 단점 : protein binding degree가 나쁨
③ 일반적으로 PVDF membrane가 자주 사용됨
⑶ 3-1. protein sample을 buffer에 용해시킨 뒤 PVDF membrane에 부착시킴
① 용도에 따라 리파 버퍼, 로딩 버퍼, 트랜스퍼 버퍼를 이용
② 리파 버퍼(ripa buffer) : 등장액. 세포를 용해시킬 때 사용하는 버퍼
③ 로딩 버퍼(loading buffer) : 이황화결합을 파괴하는 버퍼. Laemmil sample buffer라고도 함
④ 트랜스퍼 버퍼(transfer buffer) : gel에서 membrane으로 transfer하는 데 사용하는 버퍼
⑷ 3-2. Ponceau staining
① 프로틴이 정말로 membrane에 부착했는지를 확인하는 과정
② 아세트산이 포함된 용액을 씀
4. primary antibody 부착 및 저장 [목차]
⑴ 4-1. primary antibody를 부착시킴
⑵ 4-2. primary antibody가 부착된 프로틴을 저장
① BSA나 skim milk에 저장
② 이때 TBST로 dilution을 함
5. secondary antibody 부착 [목차]
⑴ 2차 항체를 쓰는 이유
① 혼성화에 참가하는 항체의 수를 늘려 신호를 증폭하기 때문
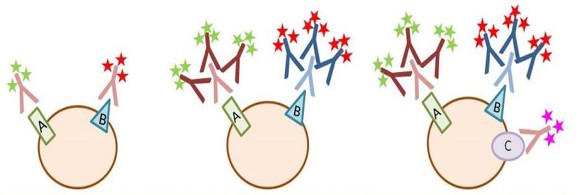
| direct method | indirect method | combined method | |
| 정의 | 2차 항체를 쓰지 않음 | 2차 항체를 씀 | 두 방법을 혼합 |
| 장점 | 빠름. 단일 단계 여러 항체 사용 가능 |
이차 항체의 신호증폭 한 이차 항체가 여러 일차 항체에 결합 가능 |
이차 항체의 신호 증폭 여러 항체 사용 가능 |
| 단점 | 신호가 미미함 | 2단계 반응 다른 숙주의 항체 필요 |
다중 단계 반응 |
Figure. 1. 2차 항체를 쓰는 이유
② 2차 항체의 요건 : 조직의 종과 1차 항체의 유래종은 2차 항체의 유래종과 다른 종이어야 함
③ 2차 항체의 선택
○ 일반적으로 특정 종의 항체의 구조는 공통적이기 때문에 2차 항체는 값이 저렴한 IgG에 대한 항체를 사용함
○ 2차 항체는 항체의 Fc 부분을 타겟팅하는 것과 Fab 부분을 타겟팅하는 게 있음
○ 구조가 비교적 일정한 Fc 부분을 타겟팅하는 2차 항체를 많이 사용함
⑵ 5-1. secondary antibody를 1 : 5000으로 첨가
⑶ 5-2. TBST로 세 번 씻어야 함
① 씻는 과정에서 transfer buffer는 재활용이 가능함
6. 전기영동 [목차]
⑴ 6-1. 50 V 1시간
⑵ 6-2. 100 V 1시간
7. 단백질 로딩 양을 조절하여 최적의 실험조건을 탐색 [목차]
⑴ antibody에 따라 다른 듯
⑵ 일반적인 기준
① 세포 용해물(cell lysate), 세포막 용해물(membrane lysate), 핵 용해물(nuclear lysate) : 20 ~ 30 μg/well을 로딩
② 정제된 단백질 : 10 ~ 100 ng/well을 로딩
입력 : 2020.02.19 11:42
수정 : 2022.02.08 15:41
'▶ 자연과학 > ▷ 일반생물학' 카테고리의 다른 글
| 【생물학】 4-7강. 지질 합성 (0) | 2019.02.16 |
|---|---|
| 【생물학】 4-6강. 지질 분해 (0) | 2019.02.16 |
| 【생물학】 4-4강. 단백질 분해 (0) | 2019.02.16 |
| 【생물학】 4-3강. 포도당 합성 (0) | 2019.02.16 |
| 【생물학】 4-1강. ATP 합성효소 (0) | 2019.02.16 |




최근댓글