38강. 미생물학 실험
추천글 : 【생물학】 생물학 목차, 【생물학】 37강. 생물학 실험
1. 획선평판법 [본문]
2. 그람염색 [본문]
3. 항생제 민감성 테스트 [본문]
4. 에임즈 테스트 [본문]
5. cross-feeding 실험 [본문]
6. 접합 중단 실험 [본문]
a. microbiological testing and genetic monitoring
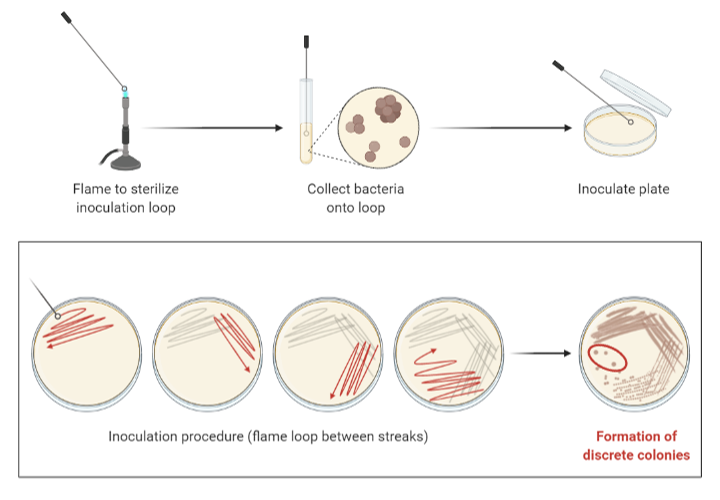
1. 획선평판법(streak plate) [목차]
⑴ 정의 : 한 개의 콜로니를 분리할 때 쓰는 방법
⑵ 과정
⑴ Gram이란 사람이 만든 염색법
⑵ 그람염색 : 크리스탈 바이올렛(crystal violet) → 사프라닌 O(safranine O)
① 1st. 알코올 램프로 2-3회 열처리하여 세균을 슬라이드 글라스에 열고정
② 2nd. 크리스탈 바이올렛 염색 시약을 도말한 시료 위에 뿌려주고 20초간 방치
○ 이때 모든 세포는 보라색
○ 크리스탈 바이올렛은 (+) 전하를 띠는 염기성 시약이기 때문에 그람양성 세균의 테이코산에 강하게 결합
③ 3rd. 염색시약을 증류수가 담긴 튜브에 짧은 시간 동안 씻어주고 남은 물기를 제거
④ 4th. 요오드 용액(I2-KI)을 도말한 시료 위에 뿌려주고 1분 동안 방치
○ 요오드가 crystal violet - iodine complex를 형성하여 변색 및 탈색을 방지 (매염제 기능)
⑤ 5th. 슬라이드를 95% EtOH가 담긴 튜브에 넣었다 빼며 요오드 용액을 씻어줌
○ 그람양성균만 보라색을 나타냄
○ 그람양성균의 경우, 알코올이 세균 세포벽을 수축시켜 세포질 내에 I2-crystal violet을 가둘 수 있음
⑥ 6th. 증류수가 담긴 튜브에 조심스럽게 넣었다 빼며 슬라이드를 씻어 탈색을 멈추게 함
⑦ 7th. 사프라닌을 도말 시료 위에 뿌려주고 1분간 방치
○ 그람양성균은 보라색을 그대로 유지하고 있음
○ 그람음성균은 사프라닌에 의해 빨간색을 나타냄
⑧ 8th. 몇 초간 조심스럽게 물로 씻어준 후 물기 제거
⑶ 그람양성 세균(Gram positive bacteria)
① 구조 : 원형질 - 세포막 - 두꺼운 펩티도글리칸(peptidoglycan)으로 구성
② 펩티도글리칸 : N-아세틸글루코사민(N-AG)과 N-아세틸뮤람산(N-AM)이 번갈아 나타나면서 β 1→4 결합을 한 것
③ 내생포자를 생성하여 고온·고압에 견딤
④ 펩티도글리칸 밖으로 돌출된 테이코산(Teichoic acid)은 공유결합으로 연결되며 그람양성에서만 관찰
○ 테이코산은 글루탐산이 포함돼 있어 음전하를 띰
⑤ 예 : 바실러스균(Bacillus subtilis), 탄저균(Bacillus anthracis), 포도상구균(Straphylococcus)
⑷ 그람음성 세균(Gram negative bacteria)
① 구조 : 원형질 - 세포막 - 주변세포질공간 - 얇은 펩티도글리칸 - 주변세포질공간 - LPS, 외막(outer membrane)
② LPS(lipopolysaccharide) : 독성이 있고 면역계의 표적이 됨
○ 보톡소의 독성도 LPS로부터 기인
○ 페니실린은 LPS를 통과할 수 없음
○ 혈액 응고, 고열 발생
③ 외막 : 통과 단백질이 있어 세포막보다 투과성이 더 큼
④ 주변세포질공간(periplasmic space)
○ 펩티도글리칸 층과 세포막, 외막을 분리시키는 부분
○ 물질대사나 물질 수송 등의 세포 기능에 중요한 세포 공간
⑤ 예 : 대장균(Escherichia coli), 헬리코박터 파일로리(Helicobacter pylori)
3. 항생제 민감성 테스트(antibiotics susceptibility test; AST) [목차]
⑴ 개요
① CFU(colony forming unit) : 샘플 내 박테리아 또는 곰팡이 포자가 형성하는 콜로니 수
○ 필요한 경우 다음 공식을 사용할 수 있음 : 샘플의 CFU = diluted sample의 CFU × dilution factor
② MIC(minimum inhibitory concentration) : 미생물의 생장을 억제하는 항생제의 최소 농도
③ MBC(minimum bactericidal concentration) : 영양배지에 서브컬쳐를 하더라도 미생물이 나타나지 않는 최소 농도
○ 즉, 박테리아 살상능력을 보이는 최소 농도로 이해하면 됨
○ MBC ≤ MIC
④ 실제로 어떤 박테리아인지도 알려줄 수 있음
⑵ broth dilution test (broth microdilution method)
① 1st. 항생제의 농도를 달리 처리한 뒤 동일한 CFU의 미생물을 첨가
② 2nd. MIC 결정 : overnight incubation을 한 뒤 visual turbidity가 생기지 않는 최소 항생제 농도를 결정
③ 3rd. MBC 결정 : 각 샘플을 영양배지에 서브컬쳐 하여 콜로니가 생기지 않는 최소 항생제 농도를 결정
④ optical density를 쓴다는 점이 한계
⑶ disc diffusion method
① drug로 인한 inhibition zone의 직경을 측정
⑷ epsilo-meter test
① 한 플레이트 안에서 gradient하게 항생제 농도를 전개함으로써 MIC를 직접적이고 간편하게 측정할 수 있음
② MBC를 측정할 수는 없음
⑸ SCMA(single-cell morphological analysis)
① 문제의식 : 혈액 샘플의 MIC를 측정할 때 초기 박테리아 농도에 크게 의존함
② 광학현미경을 활용하여 쉽게 MIC를 결정할 수 있음
4. 에임즈 테스트(Ames test) [목차]
⑴ 개요
① 캘리포니아 버클리 대학 Bruce Ames 박사팀에 의해 개발된 유전독성 평가법
② 돌연변이 유발원, 암 유발원을 찾을 때 쓰는 검사 : 빠르고 간편하며 발암성 시험 결과와 매우 밀접한 상관관계를 보임
③ 주로 신약개발 1상 전에 스크리닝 할 때 사용하는 테스트
④ 영양요구성 돌연변이를 사용하여 복귀 돌연변이(back mutation)이 일어나는지 확인
○ 복귀 돌연변이 : 주로 치환 돌연변이로 동일한 돌연변이 기작이 일어나야 복귀할 수 있음
⑤ 돌연변이원에 민감한 살모넬라 타이피뮤리움(S. typhimurium)을 사용
⑥ DNA 수선기능이 정상인 균주를 사용하면 콜로니 수는 줄어듦
⑦ 일반적으로 사용하는 시험계
○ Salmonella typhimurium TA98
○ Salmonella typhimurium TA100
○ Salmonella typhimurium TA1535
○ Salmonella typhimurium TA1537
○ Escherichia coli WP2 uvrA (pKM101)
⑵ 실험 과정
① S. typhimurium 돌연변이를 strain 별로 준비
③ 최소배지고체성분의 고체 평판 배지와 이들을 spreading
④ 배지의 중앙에 다음을 묻힌 디스크를 각각 놓음
○ 물 : 음성대조군
○ 간효소 : 음성대조군
○ 화학물질 : 실험군
○ 물 + 간효소 : 음성대조군
○ 화학물질 + 간효소 : 만일 화학물질 단독으로 처리한 실험군과 콜로니 수가 비슷하다면 해당 화학물질은 대사경로 상에서 돌연변이 유발원이 되는 게 아니라 단독으로 돌연변이 유발원이 되는 것임
④ 37 ℃에서 16시간 배양
⑤ 만일 콜로니가 생기면, 해당 콜로니는 영양요구성이 없는 것으로 복귀 돌연변이가 일어난 것
5. cross-feeding 실험 [목차]
⑴ 개요 : 물질대사의 작용순서를 알기 위한 실험
⑵ 전제
① 돌연변이체 A는 a 유전자의 돌연변이, B는 b 유전자의 돌연변이, C는 c 유전자의 돌연변이
○ 편의상 x 유전자가 생성하는 물질을 X라고 표시
② 프롤린을 합성하지 못하는 돌연변이체에서 생성된 프롤린 생합성 중간물질은 세포 내 축적
③ 세포 내 축적된 프롤린 생합성 중간물질은 한전배지를 통해 확산됨
⑶ 결과
⑷ 해석
① 22 ℃ 실험 해석
○ 물질 C는 물질 A보다 나중에 작용 : ?? → 물질 A → 물질 C, A 균주는 효소 c는 있으므로 생존 가능
○ B 균주는 영양비요구성
② 30 ℃
○ B 균주는 영양비요구성
○ C 균주는 영양비요구성
○ 전제 ②에 따르면 C 균주에는 물질의 축적이 없으므로 A 균주에게 전달되는 물질이 없음
③ 42 ℃
○ B 균주는 영양요구성 : B 균주는 온도민감성 돌연변이
○ 물질 A는 물질 B보다 나중에 작용 : ?? → 물질 B → 물질 A, B 균주는 효소 a는 있으므로 생존 가능
○ C 균주는 영양비요구성
⑸ 해석 노하우
① 더 나중에 작용하는 효소일수록 돌연변이가 더 심각한 돌연변이임
② 22 ℃ 실험에서 물질 A → 물질 C임을 알 수 있음
③ 42 ℃ 실험에서 물질 B → 물질 C임을 알 수 있음
6. 접합 중단 실험(interrupted mating technique) : 유전자 지도 작성에 응용 [목차]
⑴ 1st. Hfr 균주는 strs leu+ thr+ azir tonr lac+ gal+임
① 조건 : 항생제 민감성, 영양 비요구성
⑵ 2nd. F- 균주는 strr leu- thr- azis tons lac- gal-임
① 조건 : 항생제 저항성, 영양 요구성
⑶ 3rd. 스트렙토마이신이 있고 트레오닌과 류신은 없는 배지에서 배양 : strr leu+ thr+이 있는 균주만 살아남음
⑷ 4th. 접합 후 8분이 됐을 때 azir가 추가로 살아남음 : strr leu+ thr+ 옆에 azir가 있음
⑸ 5th. 접합 후 10분이 됐을 때 tons가 추가로 살아남음 : strr leu+ thr+ azir 옆에 tons가 있음
⑹ 6th. 접합 후 16분이 됐을 때 lac+가 추가로 살아남음 : strr leu+ thr+ azir tons 옆에 lac+가 있음
⑺ 7th. 접합 후 25분이 됐을 때 gal+가 추가로 살아남음 : strr leu+ thr+ azir tons lac+ 옆에 gal+가 있음
입력: 2019.03.17 16:28
'▶ 자연과학 > ▷ 일반생물학' 카테고리의 다른 글
| 【생물학】 투과전자현미경 사용법 (0) | 2019.03.14 |
|---|---|
| 【생물학】 1-1강. 생체고분자 소수성 지표 (0) | 2019.03.12 |
| 【생물학】 29강. 환경미생물학 (0) | 2019.03.08 |
| 【생물학】 15-1강. 미세세포 독성 실험 (0) | 2019.03.03 |
| 【생물학】 혈액검사 (0) | 2019.03.03 |







최근댓글