16강. 반응속도론
추천글 : 【화학】 화학 목차
1. 반응속도 [본문]
2. 단순한 반응속도식 [본문]
3. 반응 메커니즘 [본문]
4. 미카엘리스-멘텐 방정식 [본문]
5. 무기소재 방정식 [본문]
6. 반응속도 요인 [본문]
a. 약리학
b. 약물 시너지 모델링
c. 전기화학 반응속도론
1. 반응속도(reaction rate) [목차]
⑴ 개요
① 정의 : 단위시간당 농도의 변화량. 소멸 속도나 생성 속도의 크기로 정의할 수 있음
② (구별개념) 전환율(conversion rate) = 반응한 반응물의 몰수 / 공급한 반응물의 몰수
⑵ 반응식 예
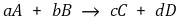
⑶ 반응속도 표현
① 평균 반응속도(average reaction rate)

② 순간 반응속도(instantaneous reaction rate)

③ 반응속도론에서는 순간 반응속도만 다룸
⑷ 고유 반응속도(unique reaction rate)
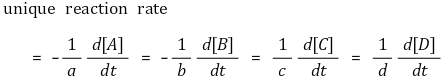
⑸ 반응속도 측정실험
① 반응속도를 측정할 때 초기상태(initial state)의 반응속도를 측정
② 하나의 농도를 2배, 3배로 늘리면서 다른 모든 물질의 농도를 고정
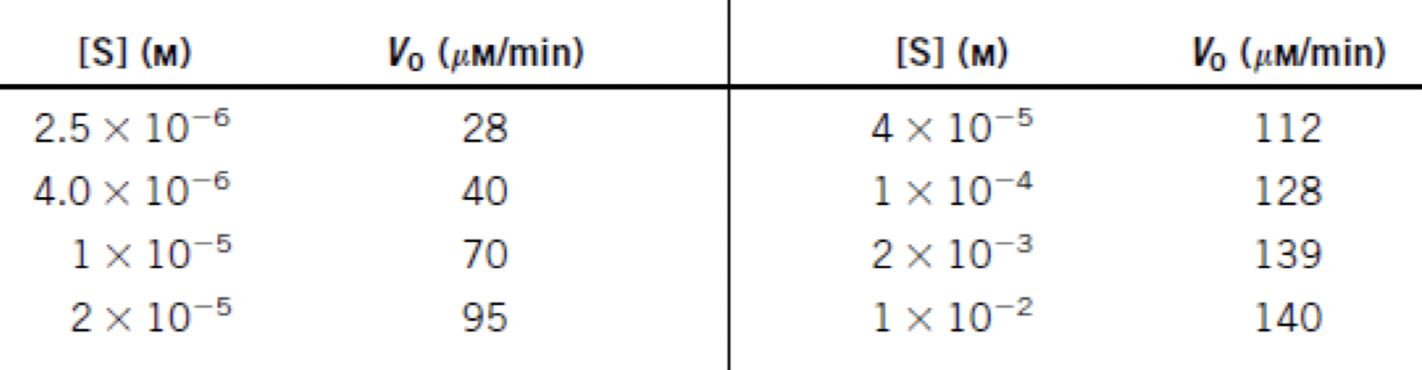
Figure. 1. 반응속도 측정실험의 예
2. 단순한 반응속도식 [목차]
⑴ 반응속도식 : aA + bB + ··· → cC + dD의 화학반응에서 반응속도식은 다음과 같음
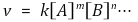
① H2O(l), C(s) 등은 자유도가 1이므로 항상 1로 처리
② 반응속도의 차수(overall order) = m + n + ···
③ 반감기(half-life)의 추이를 확인하면 반응속도의 차수를 추론 가능
⑵ 0차 반응(zero-order reaction)
① 반응속도식
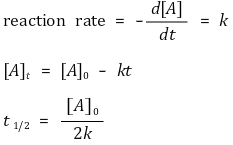
② 예 1. 하버(Haber) 공정의 역반응
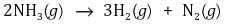
③ 예 2. 간에서 알코올을 분해하는 반응
⑶ 1차 반응 : 반감기 일정
① 반응속도식
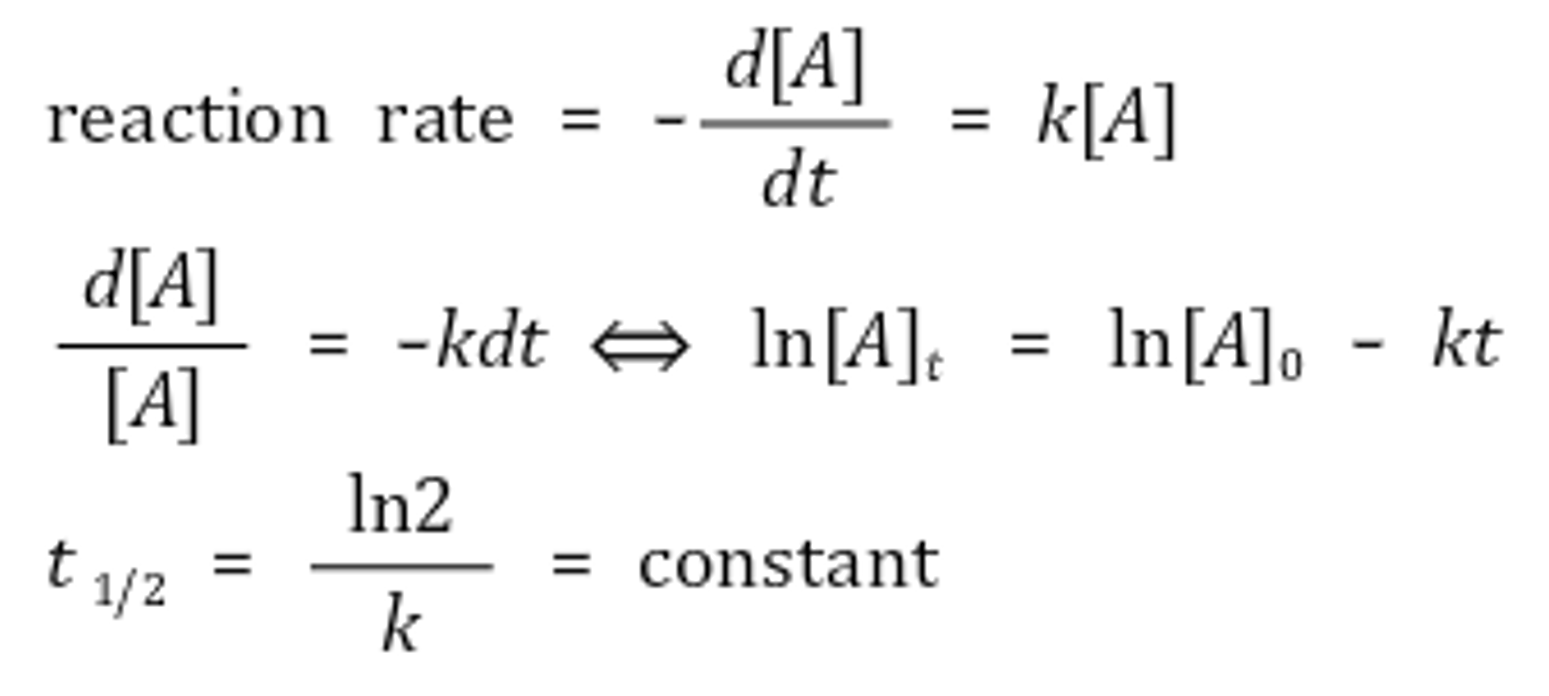
② 예 1. 핵 반응 : 방사성 원소는 1차 반응을 하기 때문에 반감기 일정
⑷ 2차 반응
① 반응속도식
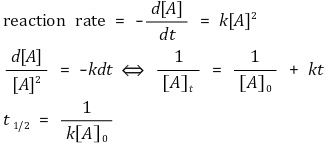
② 예 1. dimerization
Figure. 2. Diels-Alder reaction을 이용한 dimerization
3. 반응 메커니즘 [목차]
⑴ 반응 메커니즘 : 하나의 반응은 여러 단위반응으로 구분돼며, 각 단위반응에서 각 반응물질은 계수의 승수만큼 기여

⑵ 단일단계 반응(unit step reaction, elementary reaction)
① 분자도(molecularity) : 반응에 참여하는 분자의 개수
○ 단분자 반응(unimolecular reaction) : 분자도가 1
○ 이분자 반응(bimolecular reaction) : 분자도가 2
○ 삼분자 반응(termolecular reaction) : 분자도가 3
○ 삼분자 반응은 확률상 적절한 반응조건을 구성하는 것이 굉장히 어려우므로 자연계에서 드묾
○ 단분자 반응과 이분자 반응을 조합하여 메커니즘을 구성하는 게 자연스러움
② 단일단계 반응은 계수가 곧 반응의 차수를 구성
○ A → P : rate = k [A]
○ A + B → P : rate = k [A][B]
○ A + A → P : rate = k [A]2
○ A + B + C → P : rate = k [A][B][C]
○ A + A + B → P : rate = k [A]2[B]
○ A + A + A → P : rate = k [A]3
⑶ 방법 1. 반응속도 결정 단계(rate determining / limiting step; RDS/RLS) : 방법 2, 방법 3에 포함됨
① 반응 메커니즘 예
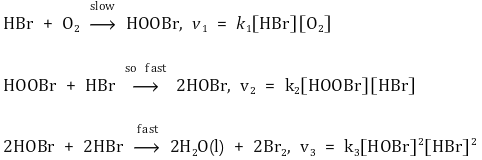
② 반응속도 결정 단계 : 반응 메커니즘에서 가장 느린 단계 반응, 전체 반응속도에 가장 큰 영향을 줌
③ 전체 반응속도식
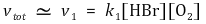
⑷ 방법 2. 유사 정상상태 (정류상태 근사)
① 메커니즘 예
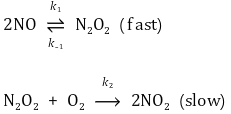
○ 방법 1로 해석하면 전체 반응속도식은 다음과 같음
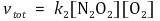
○ 한계 : 만약 1단계 반응이 반응속도 결정 단계가 아니면 전체 반응속도식이 중간체에 대한 식으로 나오므로 유용하지 않음
② 가정 : 중간체인 N2O2의 양은 빠르게 평형상태를 가진다고 가정
③ 전체 반응속도식
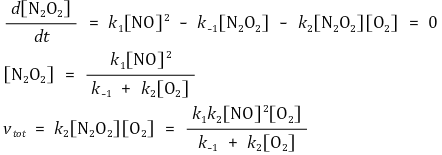
⑸ 방법 3. 빠른 평형 (사전 평형 근사법) : 방법 2보다 더 선호됨
① 메커니즘 예 : 방법 2와 같음
② 가정 : 1단계 반응에서 빠르게 평형상태를 가진다고 가정
③ 전체 반응속도식
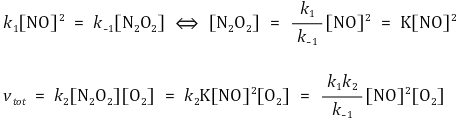
4. 미카엘리스-멘텐 방정식 [목차]
⑴ 미카엘리스-멘텐 방정식(미하엘리스-멘텐식, Michaelis-Menten equation)
① 유도 1. 유사 정상상태

○ kcat : ES → E + P가 되는 반응속도 상수
○ V : P가 생성되는 속도
○ Vm = kcat [ES] ≤ kcat E0 (단, E0는 전체 효소 농도)
② 유도 2. 빠른 평형 : 주로 이 가정이 채택. 첫 반응이 빠르게 평형에 도달한다고 가정
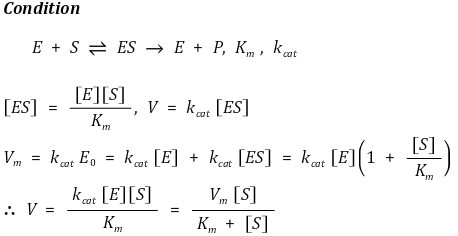
③ 그래프 도시 방법
○ Michaelis-Menten plot
○ Woolf-Hanes 식
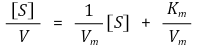
○ Eadie-Hofstee 식
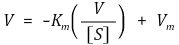
○ Lineweaver-Burk plot : LB plot이라고도 함
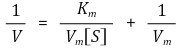
○ x축 : 1 / [S], y축 : 1/ V, x 절편 : (-1/Km , 0), y 절편 : (0, 1/Vm)
○ [S] ≫ Km : V = Vm = kcatE0
○ [S] ≪ Km : V = Vm[S] / Km = kcatE0[S] / Km
④ 미카엘리스-멘텐 방정식 분석
○ 미카엘리스 상수(Michaelis constant) : Km 지칭
○ Km의 의미 : 최대 속도의 절반에 해당하는 기질 농도
○ Km이 클수록 기질 친화도가 떨어짐
○ 촉매전환율(catalytic turnover number) : kcat 지칭
○ 정의 : 효소가 기질로 완전히 포화 시 한 효소 분자에 의해 단위 시간당 반응하는 기질 분자 수 (단위 : s-1)
○ Vmax / Etot과 같음
○ 촉매효율(catalytic efficiency) 또는 특이성 상수(specificity constant) : kcat /Km 지칭
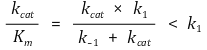
○ kcat ≫ k-1 : kcat / Km ∽ k1
○ 모든 효소의 활성부위가 기질로 채워져 있는 경우, 효소는 포화상태이고 0차 반응이며 V = Vmax임
○ Vm 및 Km을 구할 때 두 점이 너무 가깝지도 않고, 역수값이 너무 큰 것(오차↑)도 아닌 구간을 선택해야 함
⑵ 저해제(Inhibitor)
① 경쟁적 저해(competitive inhibition) : 기질과 같은 활성부위를 놓고 효소반응에 경쟁적으로 참가하여 효소반응을 저해
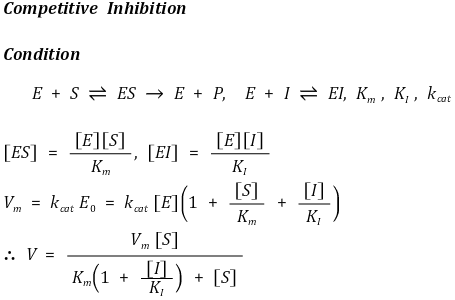
○ Vm 일정
○ Km 증가
○ Lineweaver-Burk plot에서 y 절편이 동일함
② 무경쟁적 저해(반경쟁적 저해, uncompetitive inhibition) : 효소-기질 복합체에 저해제가 결합하여 효소반응을 저해
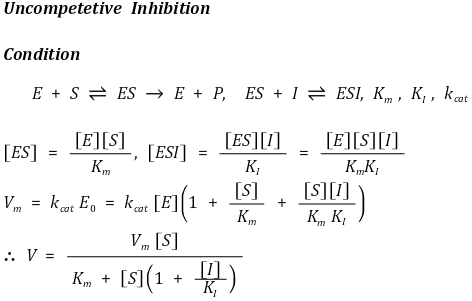
○ Vm 감소
○ Km 감소
○ Lineweaver plot에서 기울기가 일정
③ 비경쟁적 저해(noncompetitive inhibition) : 활성부위가 아닌 다른 자리(allosteric site)와 결합하여 효소반응에 비경쟁적으로 참가하여 효소반응을 저해
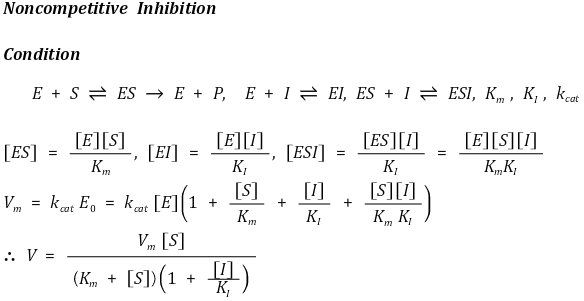
○ Vm 감소
○ Km 일정
○ Lineweaver plot에서 x 절편이 동일함
⑶ 협동성
① 억제자 혹은 활성자 대신 기질 자체가 효소 활성을 조절하는 것
② 양성적 협동성 : 다기질 효소에서 이미 결합된 기질이 다른 기질의 결합을 도와주는 것
③ 음성적 협동성 : 있긴 있으나 극히 드묾
④ 반응식 : 협동성이 있으면 ES1이 생긴 이후 순식간에 ESn이 생기므로 ES1, ···, ESn-1을 고려할 필요가 없음
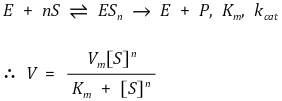
⑤ 예 : 헤모글로빈의 산소포화도
○ 헤모글로빈은 4개의 소단위로 구성되어 있으며, 각 소단위는 하나의 산소결합 부위를 가짐
○ 헤모글로빈은 sigmoid 곡선 개형의 산소포화도 곡선을 나타냄
○ 산소 한 분자가 하나의 결합 부위에 붙으면 나머지 결합 부위들에서 산소 친화력 정도가 증가
○ 하지만 산소가 없는 지역에서 산소 분자가 하나 떨어지기 시작하면 나머지도 떨어짐
○ 미오글로빈은 하나의 서브유닛으로 되어 있어 협동성이 없으므로 hyperbolic 곡선 개형의 산소포화도 곡선을 나타냄
5. 무기소재 방정식 [목차]
⑴ Eley–Rideal mechanism

Figure. 2. Eley-Rideal mechanism
6. 반응속도 요인 [목차]
⑴ 충돌 이론
① 반응 속도 : 화학 반응은 분자가 충돌할 때 일어난다고 가정
② 유효 충돌 : 충분한 에너지를 갖는 분자가 적당한 방향으로 충돌할 때 반응이 실제로 일어난다고 가정
③ 활성화 에너지 : 반응이 일어날 때 분자는 전이상태라는 불안정한 상태를 거쳐야 하며, 반응물이 전이상태에 도달하기 위해 필요한 에너지를 지칭
⑵ 유효 충돌수
① 농도 : 농도 증가 → 유효 충돌수 증가 → 반응속도 증가
② 압력(기체) : 압력 증가 → 농도 증가 → 반응속도 증가
③ 표면적(고체) : 표면적 증가 → 유효 충돌수 증가 → 반응속도 증가
⑶ 활성화에너지
① 반응을 일으키는데 필요한 최소한의 에너지
② 활성(activity)
○ 정의 : 반응속도를 증진시키는 기능
○ 반응물을 전환시키는 정도로 표시
○ 요인 1. 전환율(conversion) : 반응물의 전환된 비율 / 반응속도
○ 요인 2. TON(turnover number) / TOF (turnover frequency)
○ 정의 : 활성점 당 전환된 반응물 분자 수 (s-1 또는 h-1)
○ 일반적으로 10-2 ~ 102 s-1
○ 효소의 경우 103 ~ 107 s-1
○ 요인 3. 수율 : 선택성은 수율로 결정하고 활성은 전환율로 결정
③ 온도 : 온도 증가 → 평균 운동 에너지 증가 → 활성화에너지를 넘는 분자 수 증가 → 속도 증가
○ 일반적으로 10 ℃가 올라갈 때마다 반응속도는 2-3배 증가
④ 촉매 : 반응 전후에 양의 변화가 없지만 반응경로를 변화시켜 활성화에너지를 바꿈
○ 정촉매 : 활성화에너지 감소 → 속도 증가
○ 부촉매 : 활성화에너지 증가 → 속도 감소
○ 균일촉매(homogeneous catalyst) : 반응물(reactant)과 촉매가 동일한 상(예 : 기체, 액체)인 경우
○ 예 : 2SO2(g)+O2(g) → 2SO3(g) (촉매 : NO (g))
○ 불균일촉매(heterogeneous catalyst) : 반응물과 촉매의 상이 동일하지 않은 경우
○ 성분 1. active phase : 화학반응이 일어나는 활성 부위를 제공하는 금속
○ 성분 2. support / carrier : active phase를 분산시키고 안정화시키는 높은 표면적의 금속. 효율성, 물리적 강도, 선택성 등도 증가시킴
○ 성분 3. promotor : 촉매의 활성도, 선택성, 수명 등을 증가시키는 보조제
○ 예 : 2SO(g)+O(g) → 2SO3(g) (촉매 : Pt (s))
○ 예 : 2H2O2 (ℓ) → 2H2O (ℓ) + O2 (g) (촉매 : 이산화망간(MnO2) (s))
⑤ 아레니우스 식(Arrhenius equation)
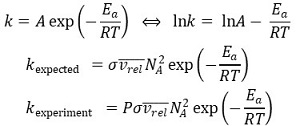
○ A, Ea : Arrhenius parameter
○ A : pre-exponential factor
○ Ea : activation energy
○ exp (-Ea / RT) : energy requirement
○ σ vrel NA2 : collision rate
○ P : steric requirement
○ kexperiment < kexpected
○ 방향·배열 등을 기술하는 요인
○ 항상 1보다 작으며 10-6 이하인 경우도 있음
⑥ 속도상수 간 곱셈은 활성화에너지를 더하고, 속도상수 간 나눗셈은 활성화에너지를 뺌
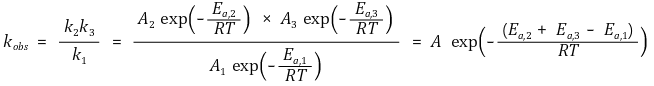
⑦ (참고) Brønsted-Evans-Polanyi (BEP) 원리 : 자유 활성화 에너지와 반응의 자유 에너지가 비례
○ 하몬드 가설처럼 경험칙인 것으로 보임
입력: 2018.12.27 18:50
수정: 2022.04.22 12:10
'▶ 자연과학 > ▷ 일반화학' 카테고리의 다른 글
| 【화학】 15-2강. 전기화학 반응속도론과 배터리 (2) | 2022.04.21 |
|---|---|
| 【화학】 16-1-1강. radioligand binding assay (0) | 2022.01.15 |
| 【화학】 농업 비료의 NPK 계산법 (0) | 2021.10.15 |
| 【화학】 22-2강. 방사성 동위원소와 입자의 상호작용 (0) | 2021.09.14 |
| 【화학】 15-1강. 전기화학 문제 (18) | 2020.12.25 |





최근댓글