7강. 할로젠화 알킬(알킬 할라이드, alkyl halide)
추천글 : 【유기화학】 유기화학 목차
1. 개요 [본문]
2. 친핵성 치환반응 [본문]
3. SN2 반응 [본문]
4. SN1 반응 [본문]
5. E2 반응 [본문]
6. E1 반응 [본문]
7. E1cB 반응 [본문]
8. Bredt's rule [본문]
9. SN2 반응 vs SN1 반응 [본문]
10. SN2, E2, SN1/E1 반응 비교 [본문]
11. 탄소-탄소 짝지음 반응 [본문]
12. 제법 [본문]
1. 개요 [목차]
⑴ 할로젠화 알킬(알킬할라이드) : R-X 형태의 화합물
① 예 : methyl halide, vinyl halide, aryl halide, allylic halide, benzylic halide
② 할로젠화 알킬은 굉장히 반응성이 큼 : 할로젠 원소의 전기음성도가 커서 할로젠기가 이탈되기 쉽기 때문
⑵ 구조에 따른 성질
① 탄소는 부분 양하전을 띠는 친전자체, 할로젠 원소는 부분 음하전
② 상대 시약은 친핵체 또는 염기
③ 용매 : H2O, ROH
⑶ 끓는점과 녹는점
① 탄소수가 같다면 할로젠화 알킬의 끓는점, 녹는점이 알케인보다 큼 : 할로젠화 알킬의 분자간 인력이 크기 때문
② R기가 클수록 할로젠화 알킬의 끓는점, 녹는점이 커짐 : R기가 클수록 표면적이 커져 분자간 인력이 크기 때문
③ X가 클수록 할로젠화 알킬의 끓는점, 녹는점이 커짐 : 편극성이 증가하여 분자간 인력이 크기 때문
⑷ 용해도
① 할로젠화 알킬은 유기용매에 용해
② 할로젠화 알킬은 물에 용해되지 않음
⑸ 결합세기 : X가 클수록 결합세기 감소
⑹ 반응 일반
① 가열을 하면 제거반응이 주류
○ 예 : E1 제거반응, E2 제거반응, CO2 이탈, N2 이탈
2. 친핵성 치환반응 [목차]
⑴ 개요

Figure. 1. 친핵성 치환 반응
R-X : 기질(S, substrate)
Nu: : 친핵체
R-Nu : 생성물(P, product)
X : 이탈기(L, leaving group)
⑵ 메커니즘 예 1. 반응물 결합의 분해와 생성물 결합의 생성이 동시에 이뤄지는 경우 (SN2)

Figure. 2. 친핵성 치환반응 메커니즘 예 1
⑶ 메커니즘 예 2. 반응물 결합이 분해되고 나서 생성물 결합이 생성되는 경우 (SN1)

Figure. 3. 친핵성 치환반응 메커니즘 예 2
⑷ 메커니즘 예 3. 생성물 결합이 생성되고 나서 반응물 결합이 분해되는 경우 (불가능)
① 이유 : 2주기 원소 탄소는 최대 8개의 최외각 전자밖에 수용할 수 없으므로 불가능한 구조
② 중간체로는 존재할 수 없고, 전이상태로는 존재할 수 있는 것으로 간주

Figure. 4. 친핵성 치환반응 메커니즘 예 3
3. SN2 반응(bimolecular nucleophilic substitution) : 2차니까 동시 반응, 구슬치기 같이 반응 [목차]
⑴ 반응속도론
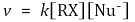
⑵ 메커니즘

Figure. 5. SN2 반응의 메커니즘
① 1단계 반응으로 이루어짐
② 강친핵체가 약친핵체를 대체하므로 비가역적 반응
③ MO 이론 : 중심 탄소의 σ* antibonding MO와 친핵체의 오비탈이 보강간섭을 일으켜서 새로운 결합이 형성됨
⑶ 입체화학
① 전이상태 : 삼각쌍뿔(sp3d)
② 친핵체의 후면 공격(backside attack) : 친핵체는 이탈기가 결합된 방향의 뒤쪽을 공격
③ 카이랄 중심의 배위반전(inversion)
○ 배위반전이 일어나지만 RS 명명법의 판단은 독립적
○ 반응 전후로 RS 판단이 달라질 수도 달라지지 않을 수도 있음 : CIP 우선순위에 따라 다양한 경우가 나옴
④ 일반적인 경우 라세미화가 일어나지 않음
○ 예외 : 아이오딘 이온의 가역성
⑷ 반응속도 요인 : 기질
① 원칙 : 친전자체인 α 탄소가 플러스 성질을 많이 가질수록 반응속도가 큼
② 일반
○ 경향성 1. 전이상태의 안정성이 올라간 경우
α-halo carbonyl > R-NH-CH2-X > R-O-CH2-X > Ph-CH2-X, R=C-CH2-X

Figure. 6. α-halo carbonyl이 SN2 반응의 전이상태의 안정성을 높이는 메커니즘

Figure. 7. (참고) 친핵체가 접근하는 쪽으로 전자가 비어있는 오비탈이 형성되려면 π*와 σ*이 오버랩돼야 함
○ α-halo carbonyl : π* (C=O) 오비탈과 σ* (C-X) 오비탈이 합쳐져서 더 낮은 에너지의 MO를 형성 → 친핵체가 카르보닐 탄소를 공격 → 분자 내 SN2 반응이 일어남
○ (주석) R-NH-CH2-X에 대한 레퍼런스를 찾지 못해 추후 번복될 수 있음
○ 경향성 2. 할로젠화 알킬
> 메틸 RX > 1차 RX > 2차 RX > 3차 RX > norbornane halide
○ 이유 : 입체효과로 인해 전이상태의 활성화 에너지에 차이가 발생하기 때문
○ 경향성 3. sp2 탄소에 결합된 할로젠 원소
> aryl halide, vinyl halide
○ VSEPR 상으로 backside attack이 불가능함
○ C-X의 결합력이 강하기 때문이 이탈시키기 쉽지 않음
⑸ 반응속도 요인 : 친핵체
① 원칙 : 강한 친핵체일수록 SN2 반응의 속도가 빠름
② 비염기 친핵체(Nu:) : NaCN, KN3, RNH2, RCOONa. NaSR, NaBr, KI는 1, 2차 RX와 반응
③ 염기 친핵체 : NaOR, KC≡CH, NaNH2 등, 1차 RX와 반응, 2차 RX는 E2 반응이 우세
④ 단, 짝산의 pKa가 10 이상인 친핵체들을 염기친핵체라고 함
⑹ 반응속도 요인 : 용매
① 극성 양성자성 용매 : 수소결합이 존재하는 용매
○ 예 : 물, EtOH, MeOH 등
② 극성 비양성자성 용매 : 수소결합이 존재하지 않는 용매
○ 예 : 아세톤, DMSO(dimethyl sulfoxide), DMF(dimethyl formamide) 등
③ 비극성 용매
○ 4차 암모늄 염, 크라운 에터 등의 상전이 촉매가 필요할 수 있음
④ 경우 1. 출발물질이 전하를 띠고 생성물이 중성인 경우
○ 극성 양성자성 용매는 출발물질의 SN2 반응성을 떨어트리므로 비극성 용매 또는 극성 비양성자성 용매가 유리
⑤ 경우 2. 출발물질이 중성이고 생성물이 전하를 띠는 경우
○ 극성 양성자성 용매는 부분전하를 띠는 전이상태를 더 잘 안정화시키므로 극성 양성자성 용매에서 SN2 속도 ↑
⑺ 반응속도 요인 : 이탈기
① SN2 반응은 이탈기가 떨어지는 게 반응속도에 포함되므로 이탈기가 반응속도 요인이 됨
② 이탈기가 안정할수록, 즉 염기도가 낮을수록 반응속도 증가
③ C-F 결합은 너무 단단해서 잘 안 떨어짐
○ 이탈기 경향성 : C-F < C-Cl, C-Br < C-I
○ 테프론(테트라 플루오린, teflon) : -(CF2-CF2)n-. 열을 가해도 분해되지 않음
○ 요오드는 큰 편극성으로 인해 C-I 결합 분해가 잘 일어남
⑻ 고급 이론
① 아이오딘 이온의 가역성
○ 문제점 : 아이오딘 이온의 SN2 반응은 친핵체의 염기도와 이탈기의 염기도가 비슷하여 가역적이므로 반응물과 생성물이 공존 (예 : CH3Br + I- ⇄ CH3I + Br-)
○ 해결책 : 역반응을 억제하기 위해 KBr이 용해되지 않는 아세톤에서 반응을 진행
○ alkyl iodide는 iodide ion과 끊임없이 반응하여 라세미 혼합물이 됨

Figure. 8. alkyl iodide가 라세미 혼합물이 되는 과정
② fluoride 이온의 불용성
○ 문제점 : fluoride 이온은 이온성이 매우 강해 비양성자성 용매에 녹기 어려움
○ 그 결과 fluoride에 의한 SN2 반응은 일어나기 어려움
○ 해결책 : 크라운 에터와 같은 상전이 촉매를 이용하면 염소이온을 비양성자성 용매로 끌어들일 수 있음
③ SN2 반응의 분자 간 반응과 분자 내 반응
○ 분자 간 반응과 분자 내 반응은 경쟁적 관계
○ 일반적으로 분자 내 반응이 분자 간 반응보다 빠르게 진행함
○ 고리를 형성하는 분자 내 반응은 오히려 엔트로피를 낮춤에도 반응속도는 여전히 더 빠름
○ 분자 내 반응을 우세하게 만들기 위한 조건 : 분자 농도가 낮은 경우, 5각 고리 또는 6각 고리가 생성되는 경우
⑼ 결론 : SN2 반응은 입체장애가 적은 기질, 강친핵체, 극성 비양성자성 용매에서 빠르게 반응
4. SN1 반응(unimolecular nucleophilic substitution) : 1차니까 떼어놓고 반응, 떼어놓으니까 카보양이온 [목차]
⑴ 메커니즘 도입 배경
① t-butyl bromide와 KOH 반응 : E2 반응이 일어남

Figure. 9. t-butyl bromide와 KOH 반응
② t-butyl bromide와 H2O 반응

Figure. 10. t-butyl bromide와 H2O 반응
○ 3차 RX는 입체 효과가 크기 때문에 SN2 친핵체 공격을 하기 힘듦
○ 반응속도가 t-butyl bromide의 농도에만 비례하므로 SN2 반응으로 설명 불가 : 반응물의 결합이 분해되고 나서 생성물의 결합이 생성되는 경우에만 가능
⑵ 반응속도론
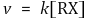
⑶ 메커니즘 : 2단계 반응

Figure. 11. SN1 반응의 메커니즘
① 카보양이온이 생성 : 즉, 가용매 분해반응(solvolysis)의 일종
○ 속도결정단계 : 카보양이온이 형성되는 1단계
② 볼츠만 에너지 분포에 의해 용매들의 진동으로 C-Br 결합이 끊어질 수 있음
⑷ 입체화학
① 위 메커니즘에서 카보양이온의 앞쪽이나 뒤쪽으로 물이 첨가될 수 있어 카이랄 물질의 경우 라세미화가 가능
② 즉, 카이랄 분자가 비카이랄 중간체를 거쳐서 카이랄이 생성되는 라세미화
③ 단, 실제 반응은 배위 반전이 배위 보존보다 우세함 : 완벽한 SN1 반응은 없고 SN2 반응도 혼재하여 일어남
④ 탄소양이온을 경유하므로 더 안정한 탄소양이온으로의 자리옮김반응(rearrangement reaction)이 있을 수 있음
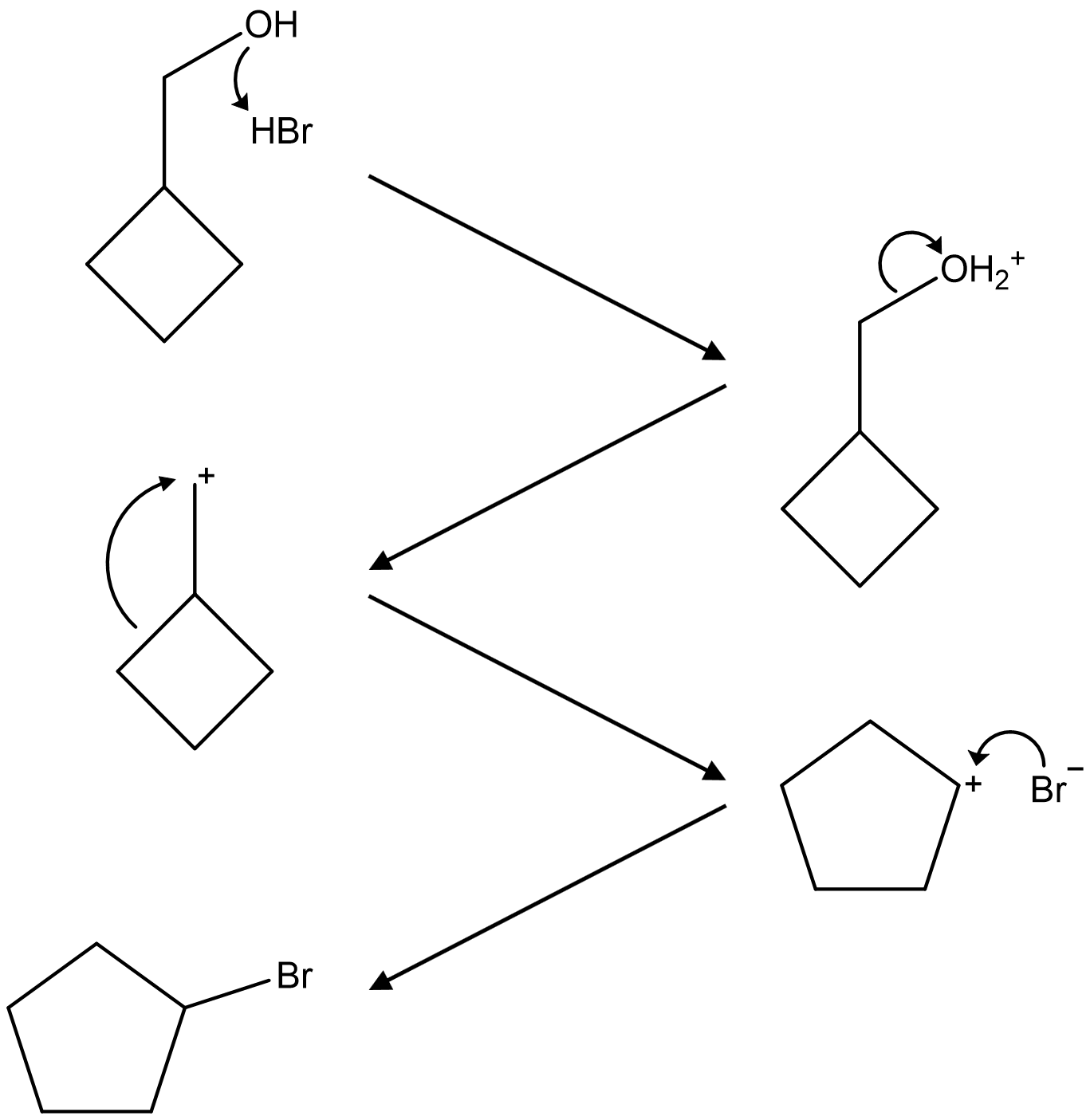
Figure. 12. 자리옮김반응으로 인해 고리확장반응을 수반한 SN1 반응 예시
⑸ 반응속도 요인 : 기질
① CX의 탄소 차수 증가 → 카보양이온 안정 → 속도결정단계의 활성화에너지 감소 → 반응속도 증가
② 공명 안정화가 일어나는 양이온 중간체 생성시 같은 차수의 단순한 카보양이온에 비해 SN1 속도 빨라짐
③ 1차 할로젠화 알킬 : 카보양이온이 너무 불안정하여 SN1 반응이 일어나지 않음
⑹ 반응속도 요인 : 친핵체
① 일반적인 SN1 반응 조건 : 일반적으로 아민을 제외한 H2O, ROH, RCOOH 등의 약친핵체와 3차 RX 간의 반응
② 강친핵체 조건 : 특히 3차 RX에서 E2 반응이 일어남
③ 2차 RX에서도 H2O, ROH(RCOOH는 제외)와 같은 약친핵체 조건에서 SN2 반응이 주반응 (ref)
④ 가용매 분해반응(solvolysis) : 일반적으로 친핵체로서 용매를 사용
⑺ 반응속도 요인 : 용매
① 극성 양성자성 용매 : 탄소 양이온을 안정화하므로 반응속도 증가
⑻ 반응속도 요인 : 이탈기
① 탄소와 이탈기 간의 결합이 약할수록, 또는 떨어져 나가는 음이온이 안정할수록 좋은 이탈기로 속도가 빠름
② 이탈기의 이탈성은 이탈기의 염기도에 반비례
⑼ 반응속도 요인 : 촉매
① Ag+는 이탈기와 결합하여 이탈기의 해리를 촉진하여 SN1의 반응속도를 높임
5. E2 반응(bimolecular elimination) : 2차니까 동시반응 [목차]
⑴ 친핵성 치환반응과의 경쟁반응

Figure. 13. E2 반응과 SN2 반응의 경쟁반응
⑵ 반응속도론
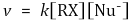
⑶ 메커니즘 : 1단계 반응. 반응물의 결합이 분해되는 동시에 생성물의 결합이 생성

Figure. 14. E2 반응의 메커니즘
① 염기가 베타 수소를 공격하여 중간체가 된 뒤 X-와 HB+가 이탈하는 반응
⑷ 입체화학
① 위치선택적 반응(regioselective reaction) : Saytzeff's rule (Zaitsev's rule)

Figure. 15. Zaisev's rule의 예
○ 치환기가 많을수록 알켄은 보다 안정화됨
○ 설명 1. 치환기가 있는 경우 hyperconjugation에 의해 anti-π(π*) 결합 오비탈과 인접한 σ 오비탈과 상호작용
○ 설명 2.
○ sp2 혼성 탄소는 s-character가 크므로(33%) 전기음성도가 큼
○ sp3 혼성 탄소는 s-character가 작으므로(25%) 전기음성도가 작음
○ sp3 혼성 탄소는 sp2 혼성 탄소에게 전자를 주려고 하므로, 치환기가 많을수록 sp2 혼성 탄소들이 안정해짐
○ 하몬드 가설(Hammond's postulate)
○ 정의 : 전이상태의 구조는 에너지가 더 가까운 쪽의 구조를 닮음
○ 흡열반응의 경우 에너지 순서는 반응물 < 생성물 < 전이상태이므로 전이상태 구조는 생성물을 닮음
○ 발열반응의 경우 에너지 순서는 생성물 < 반응물 < 전이상태이므로 전이상태 구조는 반응물을 닮음
○ 응용 : 생성물의 치환기가 많을수록 제거반응의 반응속도가 증가함
○ 치환기가 많은 생성물의 경우 하몬드 가설에 따라 전이상태 에너지가 낮음
○ 반응물에서 시작하여 보다 안정한 생성물을 만드는 경로가 전이상태 에너지가 낮아 반응속도가 더 빠름
○ 하몬드 가설이 E2 반응 외에 다른 반응에서까지 적용되는 것은 아님
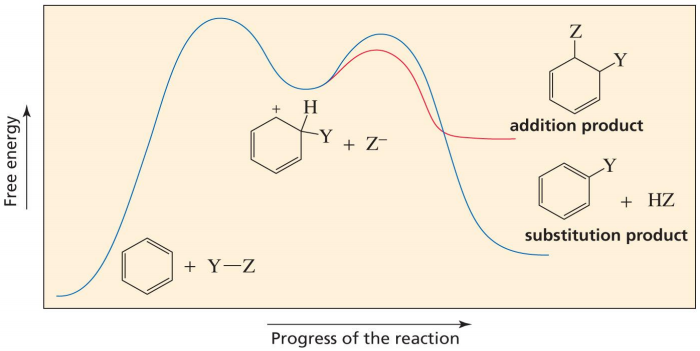
Figure. 16. 하몬드 가설이 적용되지 않는 다른 반응
○ 두 가지 이상의 알켄이 생성 시 주생성물의 판단 방법
○ 입체장애가 있는 할로젠화 알킬 혹은 염기 : 입체장애를 고려한 경로가 주생성물 생성
○ EtO-, OH-에 의한 E2 제거반응은 거의 대부분 Zaitsev's rule을 따름
○ 예외
○ 치환기의 수보다 컨쥬게이션이 에너지 안정성에 더 중요하게 관여하는 경우 : 4-chloro-5-methyl-1-hexene 등
○ alkyl fluoride : 2-fluoropentane 등
○ 호프만 제거반응(Hofmann elimination reaction)
○ C-X 결합이 단단한 경우
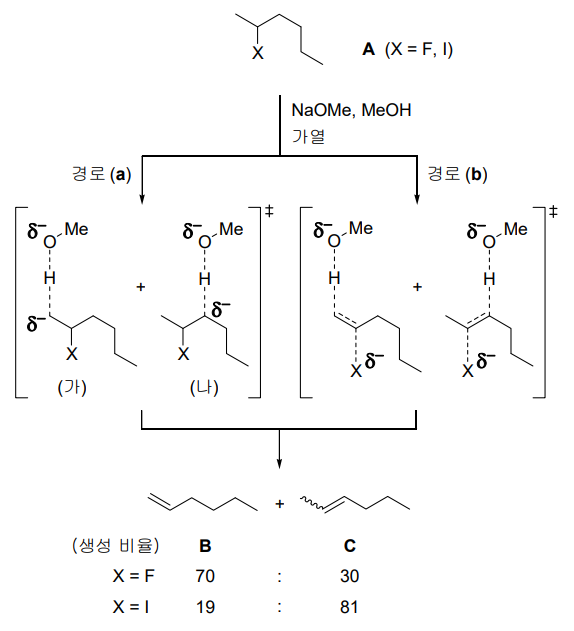
Figure. 17. C-X 결합에 따른 E2 반응의 위치선택적 반응
○ C-X 결합이 단단한 경우 (e.g., X = F) : 경로 ⒜를 따름. ㈎가 ㈏보다 더 안정함 (∵ 입체장애)
○ C-X 결합이 느슨한 경우 (e.g., X = I, OTs) : 경로 ⒝를 따름. 다치환 알켄의 중간체가 더 안정 (∵ 열역학적)
② 입체선택적 반응(stereoselective reaction) : 하나의 반응물에 대해서 입체구조가 선택적
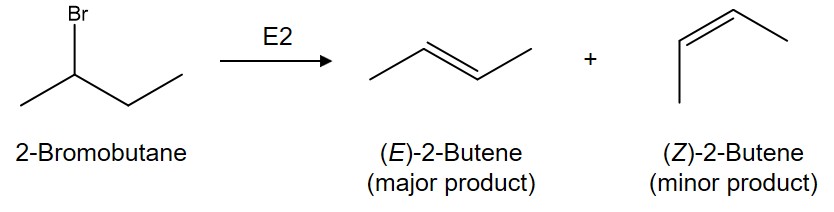
Figure. 18. E2 제거반응과 입체선택적 반응
○ 특히, 베타 수소가 두 개인 경우 입체선택적 반응이 나올 수 있음
○ 예 : trans alkene이 주생성물, cis alkene이 부생성물임
③ 입체특이적 반응(stereospecific reaction)

Figure. 19. E2반응의 anti-periplanar 규칙 (위 반응에서 X와 Ha가 이탈됨)
○ 준평면(periplanar) : 네 개의 원자가 한 평면상에 있는 기하 구조
○ 경우 1. 안티 첨가(anti-addition)
○ 안티 준평면(anti-periplanar) : 준평면 중 C-H와 C-L(L : 이탈기)가 0° 입체각을 가지는 경우
○ 즉, 이 경우 안티 준평면은 H와 X 원자가 분자의 반대 쪽에 배열되어 있는 기하 구조를 의미
○ 이탈기와 산성 수소가 180° 입체각(anti)을 가질 때 E2 제거반응을 할 수 있음
○ 안티 준평면은 staggered conformation이므로 안티 첨가는 자주 일어남
○ 175-179° 입체각도 충분히 안티 첨가를 할 수 있음
○ cyclohexane halide의 E2반응 : chair-form을 기준으로 안티 첨가가 일어나는 게 주생성물
○ 경우 2. 신 첨가(syn-addition)
○ 신 준평면(syn-periplanar) : 준평면 중 C-H와 C-L(L : 이탈기)가 0° 입체각을 가지는 경우
○ 즉, 이 경우 신 준평면은 H와 X 원자가 분자의 같은 쪽에 배열되어 있는 기하 구조를 의미
○ 이탈기와 산성 수소가 0° 입체각(eclipsed)을 가질 때 E2 제거반응을 할 수 있음
○ 신 준평면은 elipsed conformation이므로 신 첨가는 자주 일어나지 않음
○ cyclopentane halide와 관련된 E2 제거반응은 거의 대부분 신 첨가
○ 주의사항
○ anti-periplanar 규칙은 Saytzeff 규칙보다 우선
○ (주석) 어려운 문제는 십중팔구 입체특이적 반응을 응용
⑸ 반응속도 요인
① 기질 : 기질의 차수가 클수록 반응속도가 빠름 (∵ Zaitsev's rule)
○ CH3-X < 1º RX < 2º RX < 3º RX
○ 이유 : 전이상태는 부분적인 2차 결합을 형성하여 치환기가 많아질수록 hyperconjugation에 따라 안정화됨
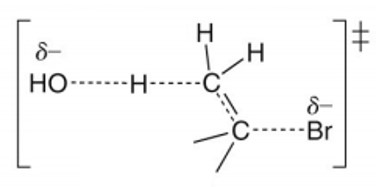
Figure. 20. E2 반응에서 부분적인 2차 결합을 가지는 전이상태
② 친핵체 : 친핵성도가 클수록 반응속도 증가
③ 용매
○ 속도비교 : 극성 양성자성 용매 < 비극성 용매 < 극성 비양성자성 용매
○ 극성 양성자성 용매는 친핵체를 안정화시켜 반응속도를 떨어트림
④ 이탈기 : 이탈기가 안정할수록 반응속도 증가
⑤ 중수소 치환
○ 중수소는 무거워서 탄소-중수소 해리가 잘 안 된다고 생각하면 됨
○ E2 반응은 수소가 떨어지는 반응이 RDS이므로 중수소가 있으면 반응속도가 느려짐
⑥ 한 분자 내 E2 반응조건과 -OH기가 동시에 존재하는 경우 강염기에 의한 -OH의 H+ 해리반응이 우선함
○ 이유 : 말단 산·염기 반응은 굉장히 빠른 반응이기 때문
6. E1 반응(unimolecular elimination) : 1차니까 떼어놓고 반응, 떼어놓으면서 카보양이온 [목차]
⑴ 반응속도론
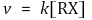
⑵ 메커니즘 : 2단계 반응. 카보양이온이 형성되는 1단계가 속도결정단계

Figure. 21. E1 반응의 메커니즘
① 카보양이온이 생성 : 즉, 가용매 분해반응(solvolysis)의 일종
○ 속도결정단계 : 카보양이온이 형성되는 1단계
② 위 메커니즘에서 약염기로 작용하는 H2O가 C+에 붙는다면 SN1 반응이 됨
③ SN1 반응과 E1 반응은 유사 조건 하에 일어나므로 항상 동시에 경쟁적으로 일어남
⑶ 입체화학
① E1 반응도 E2 반응처럼 Zaitsev's rule을 따름
② 탄소양이온을 경유하므로 더 안정한 탄소양이온으로의 자리옮김반응(rearrangement reaction)이 있을 수 있음
⑷ 반응속도 요인
① 기질
○ 3차 벤질 ≃ 3차 알릴 > 2차 벤질 ≃ 2차 알릴 ≃ 3차 알킬 > 1차 벤질 ≃ 1차 알릴 ≃ 2차 알킬 > 1차 알킬 > 메틸 > 바이닐 양이온
○ 중간체인 탄소양이온의 안정성에 큰 영향을 받음
○ 탄소양이온이 생성되는 반응이 속도 결정 단계 (rate-determining step)
○ 치환기가 많을수록 carbocation이 안정함
○ 전이상태의 에너지 차이는 중간체인 탄소양이온의 에너지 차이보다 작음
② 용매
○ 반응속도가 탄소 양이온을 안정화시키는 정도에 크게 영향을 받음
○ 비극성 용매 < 극성 비양성자성 용매 < 극성 양성자성 용매
7. E1cB 반응(unimolecular elimination conjugate base) [목차]
⑴ 개요
① 정의 : 기질이 β-halo carbonyl이거나 β-haydroxy carbonyl일 때 일어나는 제거반응
② 조건 1. acidic H가 존재할 것
③ 조건 2. poor leaving group이 존재할 것
⑵ 메커니즘
① 1 단계. 강염기가 acidic 수소를 제거
② 2 단계. 수소가 제거되면서 생긴 비공유전자쌍이 케톤기와 공명 → 산소 음이온 형성
③ 3 단계. 산소 음이온은 다시 공명하면서 이탈기를 해리시켜 이중결합 형성
⑶ (참고) 카르보닐 알파 반응
8. Bredt's rule [목차]
⑴ Bredt's rule
① 법칙
○ 다리걸친 이중고리 화합물에서 다리목 탄소(bridge head)에 π결합, 즉 이중결합이 존재할 수 없음
○ 다리걸친 이중고리 화합물에서 다리목 탄소가 탄소양이온이 될 수 없음
② 이유
○ 구조상 sp2의 삼각평면 구조가 형성될 수 없음
○ 다리목 탄소와 결합한 탄소 3개가 동일 평면에 있을 수 없으므로 p 오비탈 간 겹침이 없어 삼각평면이 불안정
③ 응용
○ 다리목 탄소에 대한 SN2 반응은 불가능 : backside attack이 불가능하므로
○ 다리목 탄소에 대한 SN1 반응은 불가능 : 탄소양이온이 불가능하므로
○ 다리목 탄소에 대한 E2, E1 반응은 불가능 : 이중결합이 불가능하므로
○ 다른 탄소의 경우 SN2, SN1, E2, E1 반응 가능
○ 다른 탄소에서 일어나는 E2 제거반응의 경우 anti 제거반응이 아니라 syn 제거반응임을 유의

Figure. 22. 다리 이고리구조에서 다리목 탄소가 카보양이온이 된 경우 (불가능)
⑵ anti-Bredt's rule
① 법칙
○ 8개 이상의 탄소를 갖는 고리가 발견되면 Bredt's rule 적용 불가
○ 예 1. bicyclo[3.3.1]non-1-ene : normal condition에서 다리목 탄소에서 이중결합이 형성될 수 있는 가장 작은 화합물
② 이유
○ cycloalkene에서는 8각 고리부터 trans가 존재할 수 있으므로
③ 응용
○ SN2 반응은 여전히 일어날 수 없음 (∵ backside attack이 불가능하므로)
○ SN1, E2, E1 반응이 일어날 수 있음
⑶ Bredt's rule이 적용될 수 있는 상황에서도 Grignard 시약 반응은 참가 가능
① 이유 : 다리목 탄소가 sp3인 탄소음이온이 되는 것이므로
9. SN2 반응 vs SN1 반응 [목차]
⑴ 1단계 반응 vs 2단계 반응
⑵ 2분자 반응 vs 1분자 반응
⑶ 기질
① SN2 반응 : 입체장애가 덜 일어날수록 반응속도 증가. 메틸기 > 1차 > 2차
○ 3차 탄소는 반응이 일어나지 않음
○ 예외 : neopentyl bromide의 경우 입체장애로 인해 1차이지만 2차보다 반응이 500배 가량 느림
② SN1 반응 : 카보양이온이 안정할수록 반응속도 증가. 3차 > 2차
○ 메틸기와 1차 탄소는 반응이 일어나지 않음
⑷ 친핵체
① SN2 반응 : 강친핵체 유리
② SN1 반응 : 친핵성도가 크게 반응속도에 영향을 미치지 않음. 반응의 순도를 높이기 위해 약친핵체 조건
⑸ 입체화학
① SN2 반응 : 배위반전
② SN1 반응 : 배위반전과 배위보존 동시생성 → 라세미화
10. SN2, E2, SN1/E1반응 비교 [목차]
⑴ 메커니즘 판단 방법
| RX \\ 친핵체 | 매우 약염기 | 약염기 | 강염기 + 입체장애 × | 강염기 + 입체장애 O |
| methyl, 1차 | 반응없음 | SN2 | SN2 (+ E2) | SN2 (+ E2) |
| 1차 + 입체장애 | 느림 | SN2 | E2 (+ SN2) | E2 |
| 2차 | SN1/E1(느림) | SN2 (+ SN1, E2) | E2 | E2 |
| 3차 | SN1/E1 | SN1/E1 | E2 | E2 |
| β-halo carbonyl 또는 β-hydroxy - |
E1cB | E1cB | E1cB | E1cB |
Table. 1. 메커니즘 판단 방법
E1cB 반응은 그 성격이 E2 제거반응과 가까움
① 매우 약염기 : H2O, ROH 등
② 약염기 : X-, SR-, CN-, N3-, RCO2-, NR3, PR3 등
○ 2차 RX에 SN2 반응이 우세
○ 중성친핵체(e.g., NR3, PR3)는 약염기이지만 암모니아, 아민은 강친핵체로 분류됨
③ 강염기 + 입체장애 × : OH-, RO-, NH2- 등
④ 강염기 + 입체장애 ○ : LDA, DBN, DBU, t-BuO-
○ 1차 RX에 E2 반응이 우세
○ DBN (1,5-diazabicyclo[4.3.0]non-5-ene)
○ DBU (1,8-diazabicyclo[5.4.0]undec-7-ene)
⑵ 용매
⑶ 기질
① 1차 RX는 주로 SN2 반응이 진행되지만, 기질의 입체장애가 심하거나 비친핵적 강염기가 처리 시 E2 반응이 진행
② 2차 RX는 SN2 반응과 E2 반응의 경쟁적 반응
○ 짝산의 pKa가 약 12 이하에서는 SN2 생성물이 주생성물 : 단, 명확하게 구분되지는 않음
○ 짝산의 pKa가 약 12 이상에서는 E2 생성물이 주생성물: 단, 명확하게 구분되지는 않음
③ 2차 RX는 모든 메커니즘 생성물이 형성되므로 친핵체(또는 염기)의 세기를 고려해야 함
○ 2-bromoheptane + NaOCH3 + CH3OH : 강친핵체가 존재. 따라서 SN2 반응, E2 반응
○ 2-bromoheptane + CH3OH + 열(Δ) : 반응조건이 용매화 반응 조건. 따라서 SN1/E1 반응
④ 3차 RX는 강염기 조건에서 E2 반응, 약염기 조건에서 SN1/E1 반응이 일어남
⑷ 친핵체
① 중성친핵체인 암모니아, 아민은 강친핵체로 SN2 또는 E2 반응을 수행
② SN2 선호 친핵체 : X-, SR-, CN-(중요), RCO2-(중요), NH3, Et3N
③ E2 선호 염기 : OH-(중요), RO-, NH2-(중요), LDA, DBN, DBU, t-BuOK(중요)
○ Zaitsev's rule (Saytzeff's rule) : 열역학적으로 안정한 알켄이 얻어짐
○ Hofmann rule : 속도론적으로 우세한 생성물이 얻어짐
○ Zaitsev's rule 우세 염기 : OH-, MeO-, EtO-
○ Hofmann rule 우세 염기 : t-BuOK, LHMDS, LDA, DBN, DBU 등 입체 장애가 큰 염기
⑸ 기타
① SN1 반응과 E1 반응은 똑같이 카보양이온 중간체를 경유하므로 치환 생성물과 제거 생성물의 혼합물 형태로 생성
○ 일반적으로 SN1이 E1보다 우세함
○ 예 : tert-Bu-Br + EtOH에서 SN1 생성물은 81%, E1 생성물은 19%를 차지함
② 약염기일수록 치환 반응이 우세하고, 강염기일수록 제거 반응이 우세함
③ 온도가 증가할수록 E1 제거반응이 우세하고, 온도가 감소할수록 SN1 치환반응이 우세해짐
○ ΔG = ΔH - TΔS에 의해 온도가 높아질수록 엔트로피 요소가 강화되므로 제거 반응이 선호됨
○ SN1 치환반응
○ 탄소 양이온 중간체 + :Nu- → 생성물
○ 반응물 2개, 생성물 1개
○ Δn = -1이므로 엔트로피 감소
○ E1 제거반응
○ 탄소 양이온 중간체 + :B → 생성물 + HB+
○ 반응물 2개, 생성물 2개
○ Δn = 0이므로 엔트로피 변화는 미미함
○ SN1/E1 생성물의 주 생성물 판단시 온도가 고려되는 경우는 드묾
④ 질산은(AgNO3) 조건 : 이탈된 halide를 제거함
○ 효과 1. SN1 반응 속도를 높임
○ 효과 2. 1차 RX도 SN1 메커니즘을 따름
11. 탄소-탄소 짝지음 반응(유기시약 반응) [목차]
⑴ 그리냐르 시약(Grignard reagent) : RMgX (예 : H3C-MgX)
① 제법 : R-X + Mg (용매 : 무수 ether 또는 무수 THF) → R-MgX
② (공식) RMgX에서 Mg가 δ+가가 되어 R은 강한 음하전을 띰. 친전자체 탄소를 찾아 R부터 연결하고 생각

Figure. 23. 에스테르의 그리냐르 시약 반응 예
③ 반응하는 경우 : 케톤, 알데하이드, 아실 클로라이드, 산 무수물, 에스터, 포스젠
④ 반응하지 않는 경우 : 카르복실산
⑵ 알킬리튬 시약(alkyl lithium reagent) : RLi (예 : H3C-Li)
① 제법 : R-X + 2Li (용매 : 무수 ether) → R-Li + Li-X
② (공식) RLi에서 Li가 δ+가 되어 R은 강한 음하전을 띰. 친전자체 탄소를 찾아 R부터 연결
③ 반응하는 경우 : 케톤, 알데하이드, 카르복실산
⑶ 길만 시약(Gilman reagent) : R2CuLi (예 : (H3C)2CuLi)
① 제법 : 2RLi + CuI (용매 : 무수 ether) → R2CuLi + LiS(s) ↓
② (공식) R2CuLi에서 CuLi가 δ+가 되어 R은 강한 음하전을 띰, 친전자체 탄소를 찾아 R 1개만 연결
③ 반응하는 경우 : 할로젠화 알킬 (SN2), 에논 (Michael addition), 아실 클로라이드
④ 반응하지 않는 경우 : 케톤, 알데하이드
⑷ 요약
① 유기시약에 있는 알킬기는 δ-
② δ-의 탄소부분이 친전자체 탄소에 붙음
12. 제법 [목차]
⑴ 알켄의 HX 첨가 반응에 의한 제법
⑵ 알켄의 X2 첨가 반응에 의한 vic-dihalide 제법
⑶ 알카인의 HX 첨가 반응에 의한 gem-dihalide 제법
⑷ 알카인의 X2 첨가 반응에 의한 tetrahalide 제법
⑼ 알코올의 SOCl2, PBr3 등에 의한 치환 반응
입력: 2019.01.10 15:12
수정: 2022.02.01 16:36
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 1-1강. 루이스 구조식 (0) | 2018.12.27 |
|---|---|
| 【유기화학】 8강. 알켄 및 알카인 (59) | 2018.12.27 |
| 【유기화학】 5강. 유기반응 개요 (4) | 2018.12.27 |
| 【유기화학】 6강. 유기반응 공통 (0) | 2018.12.27 |
| 【유기화학】 4강. 입체화학 (10) | 2018.12.27 |




최근댓글