17강. 카르보닐 알파 반응
추천글 : 【유기화학】 유기화학 목차
1. 개요 [목차]
⑴ 용어
① 알파 탄소 : 카르보닐 탄소 옆에 붙어 있는 탄소
② 알파 수소 : 알파 탄소에 붙어 있는 수소
⑵ 카르보닐 화합물의 알파 수소의 pKa
① 케토에스테르 : 11
② 다이에스테르 : 13
③ 아마이드 : 15 (질소쪽 수소)
④ 알데하이드 : 17
⑤ 케톤 : 20
⑥ 에스터 : 25. 에스터보다 케톤, 알데하이드에서 우선하여 알파수소가 제거됨
⑦ 공식 1. 카르보닐 화합물의 알파 수소는 꽤 acidic 하여 상당히 다양한 반응을 일으킴 : 반면 allyl 수소는 pKa가 44 정도
⑧ 공식 2. 산·염기 반응과 다른 유기반응이 경합하는 경우 가장 빠른 산·염기 반응이 선호됨
⑶ 카르보닐 화합물 반응 유형
① 유형 1. Y-의 염기도가 X-의 염기도보다 클 때

Figure. 1. 카르보닐 화합물 반응 유형 1
② 유형 2. Y-의 염기도가 X-의 염기도보다 작을 때

Figure. 2. 카르보닐 화합물 반응 유형 2
③ 유형 3. 에논과 1,2-첨가반응 : 친핵체가 강한 친핵체(예 : Grignard 시약)인 경우에 해당

Figure. 3. 카르보닐 화합물 반응 유형 3
④ 유형 4. 에논과 1,4-첨가반응 (Michael addition) : 친핵체가 약한 친핵체(예 : MeSH)인 경우에 해당

Figure. 4. 카르보닐 화합물 반응 유형 4
○ 친핵체가 알파 탄소를 공격하는 경우 : 중간체는 공명을 하지 않음
○ 친핵체가 베타 탄소를 공격하는 경우 : 중간체의 공명구조는 2가지. 중간체가 안정하므로 이 경로가 선호됨
○ 친핵체가 베타 탄소를 공격 시 산소가 음하전을 가지는 게 유리하므로 Figure. 4와 같은 생성물이 생성됨
2. 반응 1. 카르보닐 알파 수소 제거 반응 [목차]
⑴ 반응 1-1. 엔올-케토 토토머화 반응(enol-keto tautomerization)
① 산 촉매 토토머화 반응

Figure. 5. 산 촉매 토토머화 반응
② 염기 촉매 토토머화 반응

Figure. 6. 염기 촉매 토토머화 반응
③ 원칙 : 일반적으로 케토형이 유리
④ 예외 : 에놀형이 유리한 경우

Figure. 7. 에놀형이 유리한 경우
⑤ 에스터, 카르복실산, 아마이드는 케톤, 알데하이드와 달리 토토머화를 하지 않음
○ 이유 : -OH 대신 -OR에 있는 산소가 이중결합을 형성하려고 하기 때문

Figure. 8. 에스터의 공명 기여체
⑵ 반응 1-2. 알데하이드의 알킬화

Figure. 9. 산 촉매 조건의 알데하이드의 알킬화 메커니즘

Figure. 10. 염기 촉매 조건의 알데하이드의 알킬화 메커니즘
⑶ 반응 1-3. 케톤의 알킬화

Figure. 11. 산 촉매 조건의 케톤의 알킬화 메커니즘

Figure. 12. 염기 촉매 조건의 케톤의 알킬화 메커니즘
⑷ 반응 1-4. 에스터의 알킬화

Figure. 13. 산 촉매 조건의 에스터의 알킬화 메커니즘

Figure. 14. 염기 촉매 조건의 에스터의 알킬화 메커니즘
⑸ 반응 1-5. 나이트릴의 알킬화

Figure. 15. 산 촉매 조건의 나이트릴의 알킬화 메커니즘

Figure. 16. 염기 촉매 나이트릴의 알킬화 메커니즘
⑹ 알킬화 공통
① 반응속도론적 고려(kinetic control) : 입체효과(steric effect)가 관여
○ 낮은 온도(e.g., -76 ℃)에서 우세
○ E+는 약간 많이(slight excess) 첨가해 주어야 함 (e.g., 1.05 eq) (∵ 반응이 느리기 때문)

Figure. 17. 반응속도론적 생성물
② 열역학적 고려(thermodynamic control) : 중간체 단계에서 다치환 알켄의 안정성이 관여
○ 높은 온도에서 우세 : 반응속도론적 생성물이 생성돼도 역반응이 일어나 열역학적 생성물로 수렴
○ E+는 약간 적게 첨가해 주어야 함 (e.g., 0.95 eq)

Figure. 18. 열역학적 생성물
⑺ 반응 1-6. 메틸 케톤의 할로폼 반응(haloform reaction)
① 반응조건 : 1. X2, KOH (물/dioxane), 2. HCl, H2O
○ 2번 반응조건 HCl, H2O는 proton source의 역할을 해서 O-를 OH로 만듦
○ X2로 Cl2(g)나 I2(g)를 쓰기도 함
○ CHX3를 할로폼(haloform)이라고 함
○ CHI3는 노란색 고체로 반응의 양성 여부를 판단할 수 있는 유명한 침전물
② 발상
○ 발상 1. 만일 OH-기가 케톤 탄소를 공격하면 X2랑 마땅히 반응할 여지가 없어서 역반응이 진행됨
○ 발상 2. CH3-는 좋은 이탈기가 아니므로 X2랑 반응해서 좋은 이탈기가 된 뒤 카르보닐 화합물 반응유형 1을 따름
③ 중요성 : 케톤에서 카르복실산을 만들 수 있음

Figure. 19. 메틸 케톤의 할로폼 반응 메커니즘
⑻ 반응 1-7. 싸이올(thiol)-말레이마이드(maleimide) 클릭 반응

Figure. 20. thiol-maleimide click chemistry
① pH = 6.5-7.5 : 말레이마이드는 싸이올과만 반응할 수 있음
② pH > 7.5 : 말레이마이드는 싸이올 및 아민과 모두 반응할 수 있음
⑼ 반응 1-8. Hell-Volhard-Zelinsky reaction
3. 반응 2. 카르보닐 알파 축합 반응 [목차]
⑴ 개요
① 케톤의 알파 수소는 에스터의 알파 수소보다 산의 세기가 더 큼
○ 이유 : 에스터에는 알콕시기가 있어 전자 주기 공명효과에 의해 카르보닐 탄소의 전자 밀도를 높여, 에스터 탄소의 친전자성이 케톤 탄소의 친전자성보다 떨어지기 때문 (ref) → 음하전으로 불안정한 짝염기가 안정화되지 않음
② E1cB(elimination unipolar conjugate base) : 짝염기가 형성된 후에 제거 반응이 진행되는 것
③ 보통 hydroxide는 나쁜 이탈기이나 짝염기의 공명 안정화가 두드러지므로 반응이 일어날 수 있음
⑵ 반응 2-1. 케톤의 알파 탄소 할로젠화 : 주로 ketone + acetic acid + Br2 조건을 많이 예로 듦
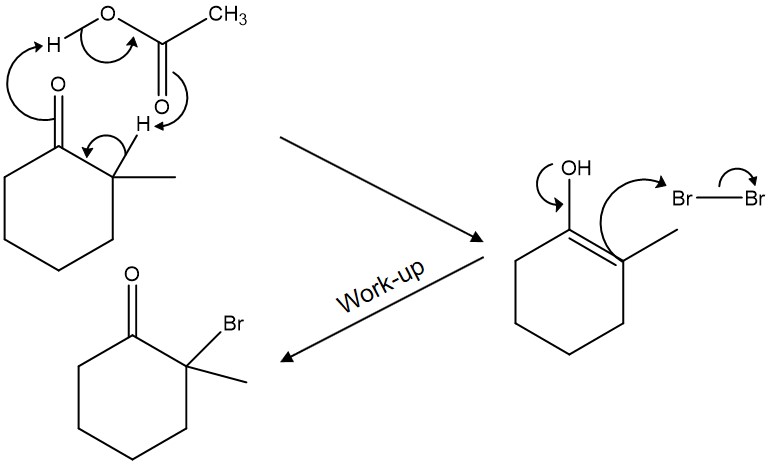
Figure. 21. acid-catalyzed bromination of ketone
⑶ 반응 2-2. 알돌 축합반응 (aldol condensation)
① 특징
○ 하나의 카르보닐 화합물이 친핵성 첨가반응에 대해 더 반응성이 크고 엔올 음이온을 만들 수 없을 때 가장 효과적
○ (공식) 똑같은 카르보닐 알파 자리의 수소가 두 번 떼어짐
○ (공식) 공명 안정화로 인해 =O가 OH-로 이탈됨
○ (공식) 한 카르보닐 알파 자리가 다른 케톤 탄소를 공격해서 이중결합 산소를 제거함 : 단, 불포화도는 유지되므로 그 카르보닐 알파 탄소와 다른 케톤 탄소 간에 이중결합이 형성돼야 함
○ 알돌 축합반응은 탈수 축합반응의 일종
○ Bredt's rule에 의해 알돌반응이 일어나지 않을 수 있음
② 예 1. 산 촉매 조건의 알돌 축합반응 : 2 × 동일한 알데하이드 (identical aldehydes)
③ 예 2. 염기 촉매 조건의 알돌 축합반응 : 2 × 동일한 알데하이드 (identical aldehydes)

Figure. 22. 염기 촉매 조건의 알돌 축합반응 메커니즘
④ 예 3. 분자 내 알돌 축합반응(intramolecular aldol condensation) : octane-2,7-dione이 주로 예제로 사용됨

Figure. 23. 분자 내 알돌 축합반응
○ 위 반응에서는 5각 고리와 7각 고리를 만드는 두 가지의 짝염기가 존재할 수 있음
○ 그 중 5각 고리가 더 안정하므로 5각 고리를 만들도록 짝염기가 형성됨
⑤ 예 4. 교차 알돌 축합반응(crossed aldol condensation) : 두 개의 다른 알데하이드 또는 알데하이드 + 케톤

Figure. 24. 교차 알돌 축합반응 전체 반응식

Figure. 25. 교차 알돌 축합반응 메커니즘
○ 추가적인 반응이 일어나는 것을 막기 위해 염기를 HCl로 중화시킴
○ 논점 : 3,3-dimethylbutan-2-one을 천천히 첨가해 주어야 함
○ OH-의 카르보닐 알파 수소 제거 반응은 반응 중 소량으로 유지되는 3,3-dimethylbutan-2-one에게 치우침
○ 수소가 제거된 3,3-dimethylbutan-2-one는 상대적으로 과량인 다른 알데하이드와 반응함
○ 3,3-dimethylbutan-2-one이 소량으로 유지되지 않으면 단순 알돌 축합반응을 할 수 있음

Figure. 26. 단순 알돌 축합반응
⑥ 예 5. Knoevenagel condensation : 활성화 메틸렌 구조를 이용
⑦ 예 6. Claisen Schmidt reaction : 알데하이드 + 케톤
⑧ 예 7. 무카야마 알돌(Mukaiyama Aldol)
○ 1-methylcyclohexanone + (CH3)3SiCl, (CH3CH2)3N → 열역학적 실릴 에터 우세
○ 1-methylcyclohexanone + (CH3)3SiCl, LDA, -78 ℃ → 속도론적 실릴 에터 우세
⑷ 반응 2-3. 에스터의 축합 반응
① 개요
○ 공명 안정화로 인해 -OR기가 이탈기가 될 수 있음
② 예 1. Claisen 축합반응 (Claisen condensation) : 2 × 동일 에스터

Figure. 27. Claisen 축합반응 메커니즘
○ 추가적인 반응이 일어나는 것을 예방하기 위해 NaOEt를 HCl로 중화시킴
○ 논점 : 염기는 에스터의 OR기와 동일한 형태여야 함 (∵ 에스터 교환 반응)

Figure. 28. 에스터 교환 반응(trans-esterification)
③ 예 2. 교차 Claisen 축합반응 : 2 × 다른 에스터

Figure. 29. 교차 Claisen 축합반응
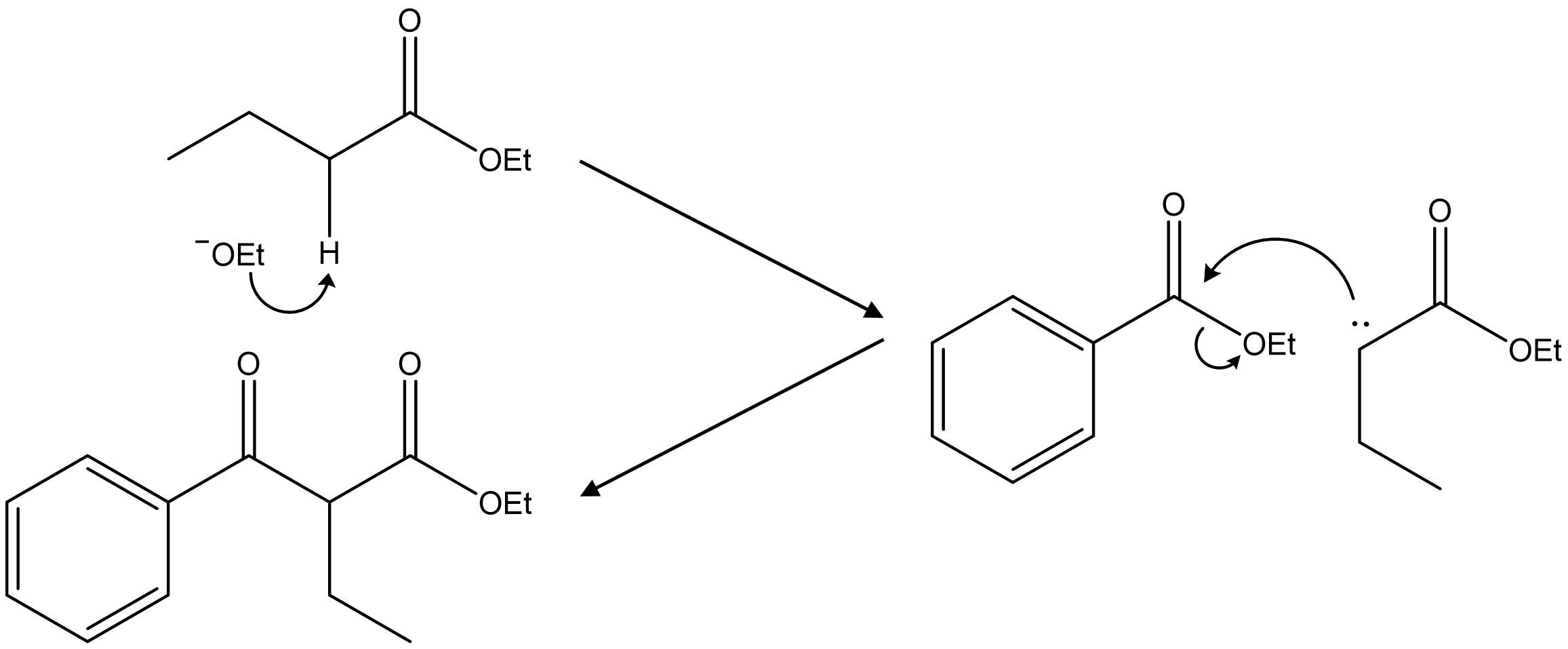
Figure. 30. 교차 Claisen 축합반응 메커니즘
○ 추가적인 반응이 일어나는 것을 예방하기 위해 NaOEt를 HCl로 중화시킴
○ 논점 1. ethyl butanoate를 천천히 첨가해 주어야 함
○ NaOEt의 카르보닐 알파 수소 제거 반응은 반응 중 소량으로 유지되는 ethylbutanoate에게 치우침
○ 수소가 제거된 ethylbutanoate는 상대적으로 과량인 다른 에스터와 반응함
○ ethylbutanoate가 소량으로 유지되지 않으면 단순 Claisen 축합반응을 할 수 있음

Figure. 31. 단순 Claisen 축합반응
○ 논점 2. 염기는 에스터의 OR기와 동일한 형태여야 함 (∵ 에스터 교환 반응)

Figure. 32. 에스터 교환 반응
○ 논점 3. 교차 Claisen 축합반응의 경우 benzoate와 non-benzoate 간의 반응으로 구성해야 함
○ alkyl benzoate끼리는 반응할 수 없음
○ 방향족 곁사슬 효과로 인해 alkyl non-benzoate끼리의 Claisen 반응보다 교차 Claisen 반응이 더 빠름
○ ethyl propanoate + ethyl ethanoate와 같이 반응을 구성하면 비교차 Claisen 반응도 적지 않게 일어남
④ 예 3. Dieckmann 축합반응
○ 분자 내 Claisen 축합반응. 1. NaOEt, 2. H3O+
○ 사각고리, 칠각고리보다 오각고리, 육각고리를 선호함 : ring strain 때문
⑤ 예 4. Darzens 축합반응 : EtONa, C5H5N
⑸ 반응 2-4. Perkin 축합 반응
① (공식) 벤즈알데하이드(benzaldehyde) + 산 무수물 → 계피산(cinnamic acid) + 카르복실산

Figure. 33. Perkin 축합 반응
⑹ 반응 2-5. 벤조인 축합 반응(benzoin condensation reaction) : CN-가 촉매로 사용됨
① α, β 불포화 카르보닐 화합물에 대해 1,2-첨가 반응 형태로 진행
○ (주석) 카르보닐 알파 축합반응은 아님

Figure. 34. 벤조인 축합 반응
⑺ 반응 2-6. Stetter 반응
① 벤조인 축합 반응과 유사하지만 1,4-첨가 반응 형태로 진행
⑻ 반응 2-7. 로빈슨 고리화 반응(Robinson annulation reaction)
① 정의 : vinyl ketone과 ketone 간의 고리화 반응
② (공식) vinyl beta 탄소는 이중결합이 풀리는 식으로 고리를 형성하고 다른 non-vinyl beta 탄소는 다른 케톤 산소에서 산소를 치우고 이중결합을 형성

Figure. 35. 로빈슨 고리화 반응
③ 메커니즘 : 1,4 첨가 반응 (Michael addition) → 분자 내 알돌 중합반응

Figure. 36. 로빈슨 고리화 반응 메커니즘
4. 반응 3. 기타 반응 [목차]
⑴ 반응 3-1. CO2 방출 반응
① 예 1. 아세토아세트산 CO2 방출반응

Figure. 37. 아세토아세트산 CO2 방출반응
② 예 2. 말론산 또는 말론산 에스터의 CO2 방출반응
○ 말론산 에스터의 경우 산 촉매 또는 염기 촉매 조건으로 말론산으로 전환하는 반응이 필요함
○ 말론산에 열을 가하면 CO2가 방출됨

Figure. 38. 말론산 에스터의 CO2 방출반응
⑵ 반응 3-2. Michael 첨가 반응
① 엔올레이트의 컨쥬게이션 화합물에 대한 1,4 첨가 반응
② 엔올-케토 토토머화 과정을 포함함
③ 기타 친핵체의 1,4 첨가 반응도 Michael 반응이라고도 함
⑶ 반응 3-3. Stork-enamine 반응
① (공식) 2-methylcyclohexanone + pyrrolidine + 약산성 조건
② 엔아민이 친핵체로서 알킬 할라이드, 아실 할라이드, 카보닐 화합물 등과 반응
③ 단계 1. 케톤의 아민 첨가반응 (ref)
○ 아민에 따른 반응 차이
○ 친핵성이 큰 아민 (pKa = 6-10, 예 : pyrrolidine) : 산 촉매 없이 반응이 진행됨. 탈수 과정이 속도 결정단계
○ 친핵성이 작은 아민 (pKa = 3-5, 예 : Ph-NH-Me) : 반응과 탈수 과정에 산 촉매가 필요함
○ 산 촉매 : 주로 p-TsOH와 같은 강한 산성 촉매가 사용됨
○ 반응 수율 증진 전략 : 정반응 결과 H2O이 생성되므로 H2O를 제거해야 수율이 증가함
○ 전략 1. 화학적으로 안정한 건조제 첨가
○ 건조제 : CaCl2, MgSO4, Na2SO4, CaSO4, K2CO3, MS, 제올라이트(zeolite) 등
○ 전략 2. Dean-Stark trap 사용
○ 반응 결과 생긴 물 또는 저비점 용매를 효율적으로 제거
○ 조건 1. azeotropic mixture 사용 : 용매와 co-solvent를 함께 섞어 끓는점을 일정하게 함
○ 조건 2. azeotropic mixture의 끓는점이 저비점 용매보다 높을 것
○ 딘 스탁 트랩에 사용하는 용매의 예 : 벤젠 (bp. 80.1 ℃), 톨루엔 (bp. 110.6 ℃), 자일렌 (bp. 139.3 ℃)
○ H2O가 효율적으로 제거되지 않으면 알코올 부산물이 발생할 수 있음
④ 단계 2. Stork-enamine alkylation

⑷ 반응 3-4. Mannich 반응

Figure. 40. Robinson's double Mannich reaction
⑸ 반응 3-5. Baylis-Hillman 반응
① 3차 아민의 1,4 첨가 후 교차 알돌 유사 반응
② 대표적인 3차 아민은 DABCO

Figure. 41. Baylis-Hillman reaction
입력: 2019.06.11 10:41
수정: 2022.09.27 08:42
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 24강. 생체고분자 : 탄수화물 (0) | 2019.01.12 |
|---|---|
| 【유기화학】 18강. 아민 등 (0) | 2019.01.12 |
| 【유기화학】 16강. 카르복실산 등 (0) | 2019.01.04 |
| 【유기화학】 15강. 알데하이드 및 케톤 (22) | 2019.01.04 |
| 【유기화학】 14강. 에폭사이드 (2) | 2019.01.04 |




최근댓글