15강. 알데하이드 및 케톤
추천글 : 【유기화학】 유기화학 목차
1. 개요 [본문]
1. 개요 [목차]
⑴ 명명법
① 알데하이드 명명법
○ CHO를 포함하는 가장 긴 사슬이 모체
○ 알데하이드 CHO 탄소가 1번
○ 고리에 붙어 있는 알데하이드가 모체인 경우 : 접미사로 -cycloalkanecarbaldehyde로 명명
○ 사슬구조에서 알데하이드가 치환기로 취급되는 경우 : oxo로 명명
○ 고리구조에서 알데하이드가 치환기로 취급되는 경우 : formyl로 명명
○ 정식 명명법 (왼쪽)과 관용 명명법 (오른쪽)의 비교
○ methanal / formaldehyde
○ ethanal / acetaldehyde
○ 2-bromopropanal / α-bromopropionaldehyde
○ 3-chlorobutanal / β-chlorobutyraldehyde
○ 3-methylbutanal / isovaleraldehyde
○ hexandial /
② 케톤 명명법
○ C=O를 포함하는 가장 긴 사실이 모체
○ C=O 기에서 가장 가까운 사슬의 말단이 1번
○ 고리에 붙어 있는 케톤이 모체인 경우 : 접미사로 -cycloalkanone으로 명명
○ 사슬구조 및 고리구조에서 케톤이 치환기로 취급되는 경우 : oxo로 명명
○ 정식 명명법 (왼쪽)과 관용 명명법 (오른쪽)의 비교
○ propanone / acetone, dimethyl ketone
○ 3-hexanone / ethyl propyl ketone
○ 6-methyl-2-heptanone / isohexyl methyl ketone
○ 2,4-pentanedione / acetylacetone
○ cyclohexanone /
○ butanedione /
⑵ 반응 공통 원리
① 친핵체 공격, 친전자체 공격
② 양성자 이동(proton transfer) : 분자 내에서(intramolecularly)가 아니라 분자 간에서(intermolecularly) 일어남
③ 토토머화(tautomerization) : 에놀 ↔ 케톤
④ 마무리(work-up) : 정확한 산이나 염기를 특정할 필요 없는 유용한 키워드
⑶ 반응성 비교
① 카르보닐 화합물 반응성 비교
○ acyl halide > acid anhydride > aldehyde > ketone > ester ~ carboxylic acid > amide > carboxylate ion
② 작용기에 따른 케톤의 반응성 비교

Figure. 1. 작용기에 따른 케톤의 반응성 비교
○ 알데하이드가 케톤보다 불안정성 (반응성), 친전자성, 연소열이 더 큼
○ 원인 1. 입체장애(steric effect) : 작용기가 많을수록 친핵체 공격이 방해를 받으므로 친핵성도가 떨어짐
○ 원인 2. 유발효과(inductive effect) : 작용기는 하이퍼컨쥬게이션으로 작용기가 케톤 탄소에 전자를 제공하므로
③ 기타 비교
○ 알데하이드와 케톤이 참가하는 반응은 상당히 비슷
○ 케톤이 알데하이드보다 극성이 큼
○ 이유 : 케톤의 경우 공명기여체에서 탄소양이온이 메틸기나 탄소 사슬에 의해 안정화되기 때문
○ 지방족 케톤이 방향족 케톤보다 반응성이 큼
○ 산화환원반응에 있어서 알데하이드와 케톤의 반응성에 차이가 남
○ 이유 : 알데하이드는 추가로 산화할 수 있는 반면 케톤은 더이상 산화할 수 없기 때문
○ 예 : 은거울 반응, 펠링 반응, 베네딕트 반응은 알데하이드에서만 반응
2. 친핵성 첨가반응 [목차]
⑴ 개요
① Bürgi–Dunitz angle : 카르보닐기의 반결합 궤도(LUMO)에 대하여 친핵체의 HOMO가 접근할 때의 각도
② 산 조건 : 카르보닐기의 친전자성을 높임
③ 염기 조건 : 친핵체의 친핵성도를 높임
④ 카르보닐 화합물에 대하여 할라이드 이온은 친핵체로 작동하지 않음
⑵ 유형 1. Y-의 염기도가 X-의 염기도보다 클 때
① 개요
○ 아실 클로라이드에서는 유형 1이 빈번하게 관찰됨
○ 카르복실산 등도 유형 1이 비슷하게 많이 관찰됨
○ 알데하이드 및 케톤이 유형 1의 반응을 하는 경우는 드문 듯

Figure. 2. 카르보닐 화합물 반응 유형 1
② 예 1. 아실 클로라이드 : Cl-의 염기도는 굉장히 작음

Figure. 3. 아실 클로라이드의 반응
⑶ 유형 2. Y-의 염기도가 X-의 염기도보다 작을 때
① 개요
○ 알데하이드 및 케톤은 대부분 유형 2를 따름
○ (주석) 기타 반응이라고 해도 유형 2의 응용에 불과한 경우가 많은 듯

Figure. 4. 카르보닐 화합물 반응 유형 2
② 예 1. 산 촉매 카르보닐 첨가 반응

Figure. 5. 산 촉매 카르보닐 첨가 반응
③ 예 2. 염기 촉매 카르보닐 첨가 반응

Figure. 6. 염기 촉매 카르보닐 첨가 반응
④ 예 3. 아세탈 형성 반응(acetal formation) : 카르보닐 탄소 보호반응
○ 아세탈과 헤미아세탈(acetal and hemiacetal)
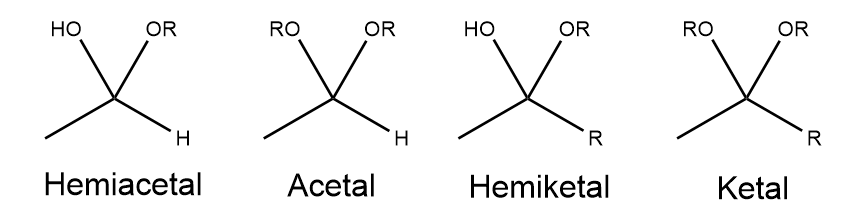
Figure. 7. 헤미아세탈, 아세탈, 헤미케탈, 케탈의 구조
○ 반응 메커니즘 : (공식) 케톤기 산소를 치우고 그 자리에 -OR기 두 개를 연결

Figure. 8. 아세탈 형성반응 예
○ 아세탈 형성 반응은 동일 반응조건에 대해 역반응도 일어남
○ 정반응 결과 H2O이 생성되므로 H2O를 제거하는 Dean-stark trap을 사용하면 수율 증가
○ 용매 : 톨루엔, 자일렌 등 비점이 높고 끓는점이 일정한 azeotropic solvent 사용 (∵ Dean-stark trap 필수 조건)
○ 반응 기질인 알코올을 과량 첨가하면 수득률이 증가 → 일반적으로 2당량 대신 과량 첨가
○ 에스터, 카르복실산, 아마이드에 대해서는 일반적인 산 조건에서 아세탈이 형성되지 않음
○ 예 3-1.

Figure. 9. 아세탈 형성반응
○ 예 3-2.

Figure. 10. 아세탈 형성반응
○ 예 3-3. Corey-Seebach reaction : 싸이올 첨가반응

Figure. 11. 싸이올 첨가반응
○ 환원 반응 : thioacetal + H2 / Raney-Ni (desulfurization)
④ 예 4. 아민 첨가 반응
○ 메커니즘 : (공식) 카르보닐기(=O)를 날리고 대신 이민기(=NR)를 붙임
○ 역반응도 가능하므로 특정 지점에서 평형상태에 이름
○ pH 4-5에서 이민 형성이 가장 잘 일어남
○ 예 4-1. 일반적인 아민 첨가 반응

Figure. 12. 알데하이드 및 케톤 아민 첨가 반응
○ 예 4-2. p-toluenesulfonyl hydrazide (CH3-Ph-SO2NHNH2)
○ 예 4-3. 엔아민(enamine) 형성 반응
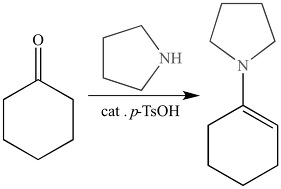
Figure. 13. 엔아민 형성 반응
○ 2차 아민은 1차 아민과 달리 iminium ion에서 떼어낼 양성자가 없으므로 알파 탄소에 결합된 수소를 뗌
○ C=N 결합세기가 C=C 결합세기보다 강하므로 1차 아민 첨가 시 이민이 형성됨
○ Stork-enamine reaction : 엔아민이 친핵체로서 알킬 할라이드, 아실 할라이드, 카보닐 화합물 등과 반응
○ 예 4-4. NaBH3CN의 이민 환원반응 : 이민을 환원하여 아민을 만듦. =N+H2 뿐만 아니라 =N+R2도 -NR2로 환원됨

Figure. 14. NaBH3CN의 이민 환원반응
○ 예 4-5. Wolff-Kishner reduction reaction
○ NH2NH2, 강염기(e.g., KOH, NaOH), 가열 조건에서 추가적인 환원이 일어남
○ -C=N-NH2 (hydrazone)에 염기를 처리한 경우
○ 예 4-6. Beckmann rearrangement
○ -C=N-OH (oxime)에 산을 처리한 경우
○ 예 4-7. Pomeranz-Fritsch reaction
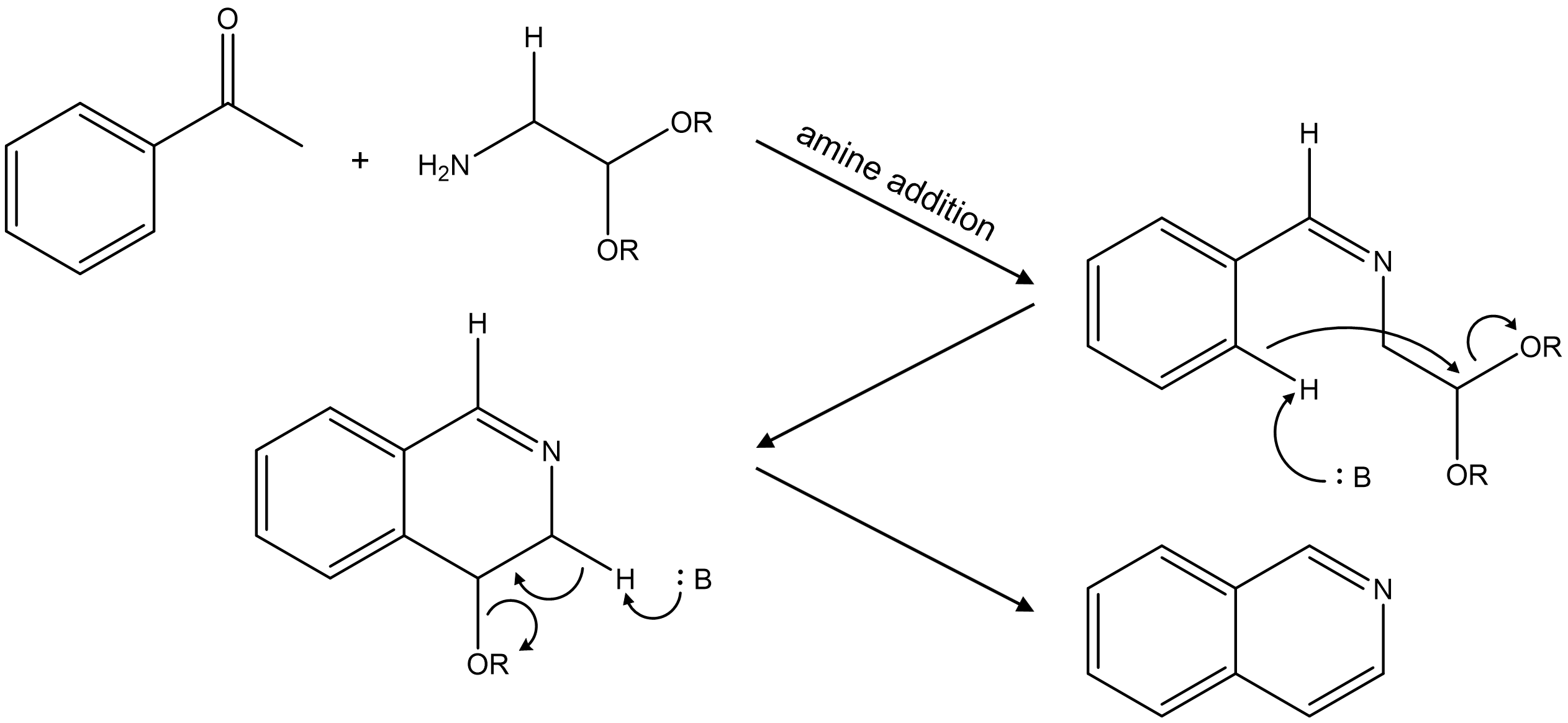
Figure. 15. Pomeranz-Fritsch reaction
○ benzaldehyde + 2,2-dialkoxyethylamine에서 아민 첨가 반응 및 친전자성 방향족 치환반응 (EAS) 수행
○ 예 4-8. Pictet-Spengler reaction
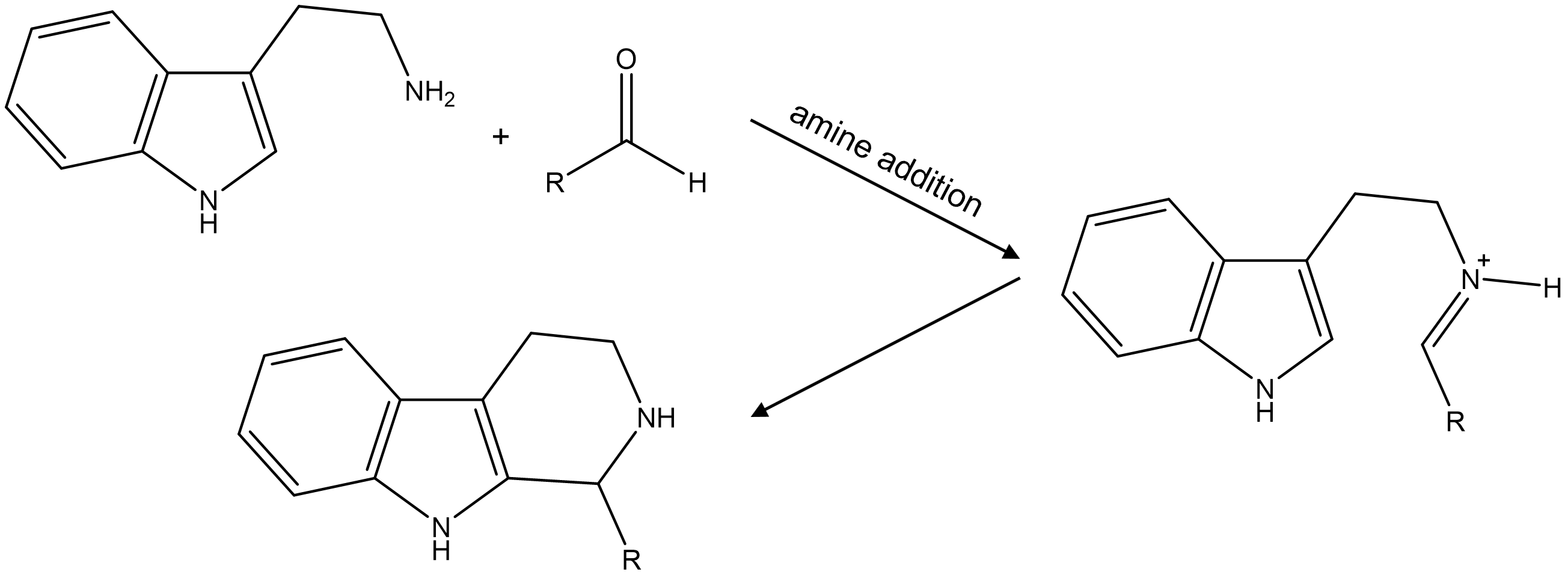
Figure. 16. Pictet-Spengler reaction
○ 아민 첨가 반응 및 Friedel-Crafts alkylation 유사 반응 수행
⑤ 예 5. 알데하이드와 케톤의 HCN 첨가 반응

Figure. 17. 알데하이드 및 케톤의 HCN 첨가 반응 메커니즘
○ 예 5-1. 벤조인 축합 반응(benzoin condensation)
○ 예 5-2. Stetter 반응
⑷ 유형 3. 에논(enone)과 1,2-첨가반응(1,2-addition reaction)
① 친핵체가 강한 친핵체(예 : Grignard 시약)인 경우에 해당
② 메커니즘

Figure. 18. 에논과 1,2-첨가반응 메커니즘
⑸ 유형 4. 에논(enone)과 1,4-첨가반응(1,4-addition reaction, Michael addition)
① 친핵체가 약한 친핵체(예 : MeSH)인 경우에 해당
② 메커니즘

Figure. 19. 에논과 1,4-첨가반응 메커니즘
③ 예외 : 아실 클로라이드의 경우 친핵체가 약해도 1,2-첨가반응을 수행함

Figure. 20. 에논과 아실 클로라이드
3. 기타 반응 [목차]
⑴ 수소화 반응
① 예 1. 수소화 금속시약 반응 : NaBH4 또는 LiAlH4

Figure. 21. 알데하이드 및 케톤 수소화 금속시약 첨가 반응
② 예 2. Pd/C 수소화 반응 : 알켄과 케톤이 있을 때 알켄이 먼저 수소화 됨 (∵ 알켄의 반응성이 더 큼)

Figure. 22. H2 (1 eq.) 조건 하 Pd/C 수소화 반응

Figure. 23. H2 (excess) 조건 하 Pd/C 수소화 반응
⑵ 산화환원반응
① 예 1. 알데하이드 및 케톤의 유기 금속시약 반응
○ 알켄과 케톤이 있을 때 유기 금속시약은 알켄에 먼저 반응 (∵ 알켄의 반응성이 더 큼)

Figure. 24. 알데하이드 및 케톤의 유기 금속시약 반응
② 예 2. 비티히 반응(Wittig 반응) : 알데하이드와 케톤에 대한 일라이드(ylide)의 첨가 반응
○ 일라이드 시약(ylide reagent)
○ 일라이드는 인접한 원자가 반대 극성을 갖는 분자를 지칭
○ P=C 결합 시 P 원자의 내부 d 오비탈 전자가 결합에 관여하므로 에너지가 매우 높아 전하가 분리된 zwitterion 형인 ylide가 실제 구조가 됨

Figure. 25. 일라이드 시약
○ 일라이드 시약 제법 : 1. Ph3P, CH3Br, 2. BuLi

Figure. 26. 일라이드 시약 제법
○ 예 2-1. (공식) 케톤의 O를 지우고 대신 C를 붙임

Figure. 27. Wittig 반응 예시
○ 예 2-2.
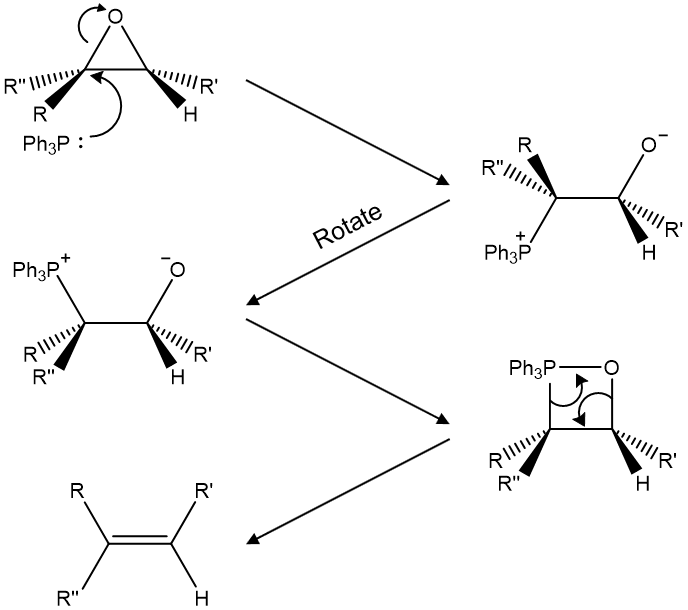
Figure. 28. Wittig 반응 예시
○ 장점 : 치환기가 적은 알켄이 유일한 생성물이 됨
○ 단점 : Wittig 반응은 (E), (Z) 구분없이 알켄이 생성됨 : Figure. 27.은 그렇지 않기 때문에 주목해 볼만 함
○ 해결방안
○ 일라이드의 친핵체 탄소에 EWG가 부착된 경우 반응성이 낮아 열역학적으로 안정한 알켄이 주로 생성
○ 일라이드의 친핵체 탄소에 페닐기가 부착된 경우 속도론적으로 유리한 (입체장애 ↓) 알켄이 주로 생성
③ 예 3. Horner-Wadsworth-Emmons 반응
○ (E) 알켄을 선택적으로 얻는 반응
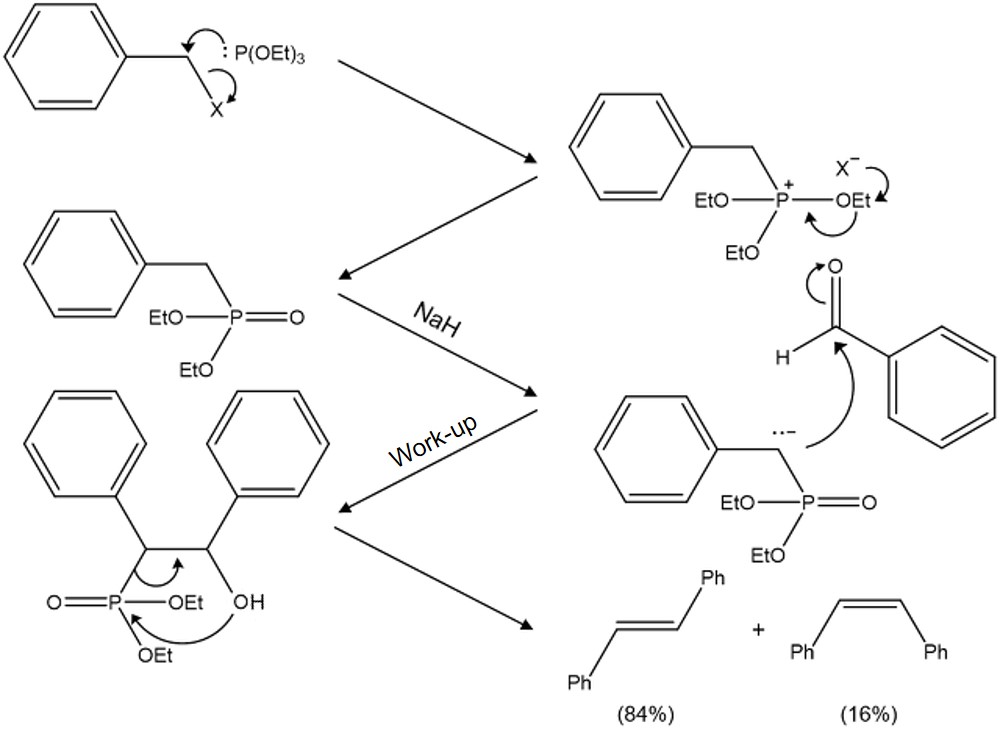
Figure. 29. Horner-Wadworth-Emmons 반응 메커니즘
④ 예 4. Reformatsky reaction
○ 유기 아연 시약의 첨가 반응
○ 유기 아연 시약은 반응성이 약해 에스터 그룹과 반응하지 않음 : 그리나드 시약 및 에스터와 다름
○ Reformatsky 시약 생성 후 알데하이드나 케톤을 처리하면 첨가 반응이 일어남
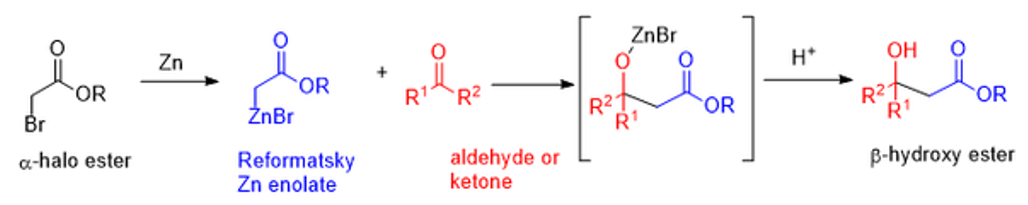
Figure. 30. Reformatsky reaction
⑤ 예 5. Cannizzaro reaction
○ α 수소가 없는 알데하이드를 강염기로 처리 시 분자 간 산화환원반응
○ benzaldehyde + KOH + H2O → potassium benzoate (oxidized) + benzyl alcohol (reduced)

Figure. 31. Cannizzaro reaction 메커니즘
⑥ 예 6. Meerwein-Ponndorf-Verley reduction (Oppenauer oxidation)
○ Al(OC(CH3)3)3 촉매 하에 카르보닐기가 환원하고 알코올이 산화하는 반응
○ 반대 방향의 반응을 Oppenauer oxidation이라고 함

Figure. 32. Meerwein-Ponndorf-Verley reduction (Oppenauer oxidation)
⑶ 침전반응 : 알데하이드는 추가로 산화할 수 있는 반면 케톤은 더이상 산화할 수 없어 침전반응에서 차이가 생김
① 은거울 반응(silver mirror reaction, Tollens test)
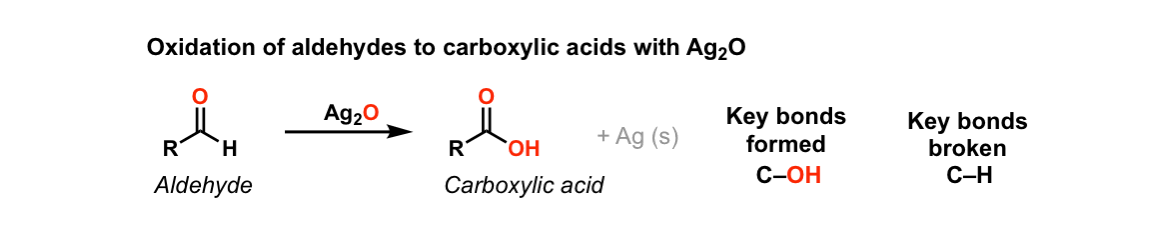
Figure. 33. 은거울 반응
○ Tollens 시약 : 무색 용액
○ 1단계. AgNO3를 물에 녹임
○ 2단계. NaOH 또는 KOH를 넣어 Ag를 Ag2O로 침전시킴
○ 3단계. 암모니아 수용액을 첨가하여 은-암모니아 착이온 Ag(NH3)2+NO3-를 만듦
○ 실험 과정
○ 1단계. 질산은 암모니아 용액(Tollens test)에 환원성 물질을 넣고 가열
○ 2단계. 이온 형태로 존재하던 은 이온이 환원되면서 Ag(s)가 석출됨
○ 환원당 : 금속 은이 석출됨
○ 알데하이드 : 금속 은이 석출됨
○ Ag2O는 Ag+ donor로 작용 : 물에 있는 산소가 알데하이드로 이동하여 카르복실산이 생성됨
○ 케톤 : 반응하지 않음
○ 예외적으로 α-hydroxy keton과 반응
○ 아세탈 : 반응하지 않음
○ 헤미아세탈 : 반응
○ 이유 : 헤미아세탈은 카르보닐기와 알코올기로 분리할 수 있기 때문
② 펠링 반응 (Fehling reaction)
○ 펠링 시약 : 황산구리 오수화물(CuSO4·5H2O), NaOH, 로셸염(Rochelle salt, sodium potassium tartrate)
○ 실험 과정
○ 1단계. 펠링 용액에 환원성 물질을 넣고 가열
○ 2단계. 타타르산과 함께 이온 형태로 존재하던 구리 이온이 환원되면서 산화구리(Ⅰ)가 침전됨
○ 환원당 : 구리 침전 (황적색)
○ 지방족 알데하이드 : 구리 침전 (황적색)
○ 방향족 알데하이드 : 반응하지 않음
○ 케톤 : 반응하지 않음
③ 베네딕트 반응 (Benedict's reaction)
○ 베네딕트 용액 : CuSO4, Na2CO3, 구연산 나트륨(sodium citrate)
○ 알데하이드 : 구리 침전 (황적색)
○ 케톤 : 반응하지 않음
○ 크레아틴과 요산을 산화시키지 않음
○ 포도당, 엿당, 과당 등을 산화시킴 : 검출 반응에서 용이하게 사용
⑷ 재배열 반응
① 예 1. Baeyer-Villiger oxidation : 7각 고리 구조 메커니즘
○ 개요
○ (공식) peroxy acid 하에 과잉된 산소가 알데하이드(또는 케톤)에 전달돼 카르복실산(또는 에스터)이 생성됨
○ 자리옮김반응 시 배위 보존
○ 이동 용이도(migratory aptitude)
○ H >phenyl > 3차 알킬 > cyclohexyl > 2차 알킬 > 1차 알킬 > 메틸
○ 전자가 많은 탄소 쪽으로 산소가 삽입 (ref)
○ 1-1. acetophenone : 벤젠 고리가 반응성을 높임
○ acetophenone은 과산화산(RCO3H)(예 : CF3CO3H)과 반응하여 phenyl acetate가 됨

Figure. 34. Baeyer-Villiger oxidation 메커니즘
-OH의 수소까지 고려하면 7각형이 형성됨을 알 수 있음
○ 1-2. mCPBA
○ RCO3H 형태의 mCPBA가 케톤을 산화시킴
○ 전자가 많은 탄소 쪽으로 산소가 삽입
○ 알켄의 에폭시화 반응과 경쟁관계에 있으나 Baeyer-Villiger 반응이 우세
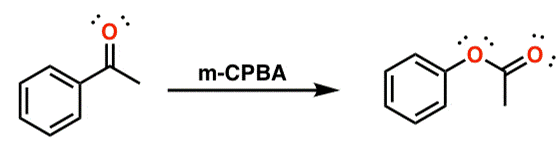
Figure. 35. mPBCA 촉매 하 Baeyer-Villiger oxidation 반응
② 예 2. Tiffeneau-Demjanov rearrangement
○ alkyl diazonium salt가 형성되면 불안정하여 carbocation을 형성

Figure. 36. Tiffeneau-Demjanov rearrangement 메커니즘
③ 예 3. Johnson-Corey-Chaykovsky reaction
○ Tiffeneau-Demjanov rearrangement 반응과 경합할 수 있음
○ 예 3-1. 황 일리드를 이용한 Johnson-Corey-Chaykovsky reaction
○ 대표적인 황 일리드(sulfur ylide)의 종류는 다음과 같음
○ H2C-S(CH3)2 : sulfur ylide (sulfonium)
○ H2C-SO-(CH3)2 : Corey's ylide (sulfoxonium)

Figure. 37. Johnson-Corey-Chaykovsky reaction 메커니즘
○ 예 3-2. AlCl3, CH2N2 조건 하에서 케톤의 Johnson-Corey-Chaykovsky reaction

Figure. 38. AlCl3, CH2N2 조건 하에서 케톤의 Johnson-Corey-Chaykovsky reaction
○ 예 3-3. sulfonium ylide는 강한 친핵체이므로 1,2-첨가가 우세

Figure. 39. sulfonium ylide의 1,2-첨가
○ 예 3-4. sulfoxonium ylide는 약한 친핵체이므로(∵ 케톤기) 1,4-첨가가 우세

Figure. 40. sulfoxonium ylide의 1,4-첨가
④ 예 4. benzilic acid rearrangement

Figure. 41. benzilic acid rearrangement 메커니즘
⑤ 예 5. Favorskii rearrangement reaction
○ (공식) 강염기, 케톤, 불포화도 1 증가, 이탈기가 두 개 제거되는 반응

Figure. 42. Favorskii rearrangement reaction
4. 알데하이드 제법 [목차]
⑴ 알켄의 가오존분해반응 : 1. O3, 2. Zn, H2O or CH3SCH3
⑵ 말단 알카인의 수화반응 : 1. BH3, 2. H2O2, OH-
⑶ Gattermann-Koch 반응을 통한 benzaldehyde 합성 : 포밀기를 위한 Friedel-Crafts acylation
⑷ 벤질 클로라이드와 나이트로메테인 음이온 간의 반응 : benzyl chloride + nitromethane anion → benzaldehyde
⑸ 1차 알코올의 약한 산화 반응 : 알데하이드까지 산화
⑹ 다이올의 HIO4 산화성 분해반응 : HIO4, H2SO4
⑻ Reimer-Tiemann 반응 : CHCl3, KOH
⑼ Corey-Seebach 반응 경유 : thioacetal + HgCl2, MeOH, H2O → aldehyde
① 황 원자의 역할 : backbonding effect로 음전하 감소. 황 원자 자체가 쉽게 극성화 되어 음이온을 안정화
② Hg2+의 역할 : 루이스 산, 육각 구리 구조의 용매화
③ Hg2+가 없으면 역반응이 우세해짐
5. 케톤 제법 [목차]
① 공통 : -OH기가 연결된 알카인이 수화되어 엔올(enol)이 형성된 뒤에, 토토머화를 거쳐 케톤이 생성됨
② 산 촉매 수화 반응 : H2O, H2SO4 / H2O, H2SO4, HgSO4
③ 수소화 붕소 첨가-산화 반응 : 1. BH3, 2. H2O2, OH- / 1. BH3, 2. H2O2, OH-
⑶ Friedel-Crafts 아실화 반응
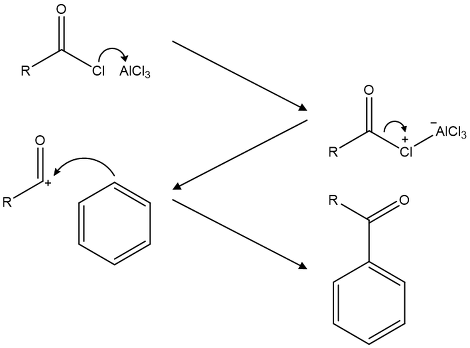
Figure. 43. 벤젠의 Friedel-Crafts 아실화 반응
⑸ 다이올의 HIO4 산화성 분해 반응 : 1. HIO4, 2. H2SO4
⑹ Corey-Seebach 반응 경유 : thioketal + HgCl2, MeOH, H2O → aldehyde
① 황 원자의 역할 : backbonding effect로 음전하 감소. 황 원자 자체가 쉽게 극성화 되어 음이온을 안정화
② Hg2+의 역할 : 루이스 산, 육각 구리 구조의 용매화
③ Hg2+가 없으면 역반응이 우세해짐
① 그리냐르 시약, 길만시약은 카르복실산과 반응할 수 없음
입력: 2019.03.29 13:54
수정: 2023.01.30 23:12
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 17강. 카르보닐 알파 반응 (7) | 2019.01.04 |
|---|---|
| 【유기화학】 16강. 카르복실산 등 (0) | 2019.01.04 |
| 【유기화학】 14강. 에폭사이드 (2) | 2019.01.04 |
| 【유기화학】 13강. 에터 (0) | 2019.01.04 |
| 【유기화학】 12강. 알코올 (11) | 2019.01.04 |




최근댓글