11강. 방향족 화합물(aromatic compounds)
추천글 : 【유기화학】 유기화학 목차
1. 방향족성 [본문]
2. 벤젠 유도체 명명법 [본문]
3. 비편재화된 벤젠의 특성 [본문]
4. 반응 1. 친전자성 방향족 치환 반응 [본문]
5. 반응 2. 친핵성 방향족 치환 반응 [본문]
6. 반응 3. 기타 반응 [본문]
7. 다중치환효과 [본문]
8. 방향족 곁사슬 효과 [본문]
9. 제법 [본문]
1. 방향족성(aromaticity) [목차]
⑴ 방향족성 : 예상보다 훨씬 낮은 에너지를 가지고, 반응성(방향족 곁사슬 효과)이 크게 달라지는 것
⑵ 휘켈규칙(Hückel's rule) : 4가지 조건을 모두 만족하면 방향족성을 갖게 됨
① 고리 형태
○ 이유 : 고리 형태에서는 p 오비탈 간의 오버랩이 용이하기 때문
② 평면 구조
○ cyclooctatetraene은 평면 구조가 아니므로 방향족이 아님
○ 단, cyclooctatetraene에 K 2 eq를 제공하면 평면형의 구조와 10개의 파이 전자를 가짐
③ 평면형 고리를 이루는 각 원자는 모두 콘쥬게이션을 만족해야 함
④ p 오비탈에 존재하는 π 전자의 개수가 4n + 2, n = 0, 1, 2, ···개여야 함
○ 평면형 고리를 이루는 조건과 맞물려 있음 (예 : cyclooctatetraene는 평면형 구조가 아니므로 방향족 아님)
○ 2π system은 ring strain이 있으므로 6π system이 보편적
⑶ Frost의 원 (polygon rule)
① 주어진 고리 형태의 화합물에 내접원을 그림
② 원의 중심을 기준으로 아래에 위치한 MO는 결합 MO, 위에 위치한 MO는 반결합 MO, 중심 높이는 비결합 MO
③ 반결합 MO에 전자가 놓이지 않고, 홀전자가 없으면 방향족성을 만족
⑷ 예시

Figure. 1. 벤젠, 피리딘, 피롤
① 벤젠 : 휘켈 규칙을 모두 만족
② 피리딘(pyridine) : 휘켈 규칙을 만족. 질소 원자의 비공유전자쌍은 비편재화에 참가하지 않기 때문에 약염기로 작용
③ 피롤(pyrrole) : 휘켈 규칙을 만족. 질소의 비공유전자상도 비편재화에 참가, 염기성이 전혀 없음
⑸ 반방향족성(anti-aromaticity), 비방향족성(non-aromaticity)
① 반방향족성 : 휘켈규칙에서 오직 파이전자 개수조건이 4n+2개에서 4n개로 바뀐 것. 방향족성 소멸
② cyclooctatetraene은 파이전자가 4n, n=2개지만 모든 탄소가 동일 평면상에 있지 않으므로 반방향족이 아니라 비방향족
③ 방향족성을 갖추면 치환반응만 가능하지만 반방향족성, 비방향족성을 갖추면 알켄처럼 첨가반응만 가능
2. 벤젠 유도체 명명법 [목차]
⑴ 치환기 명명
⑵ 번호 붙이기
① 치환기가 1개인 경우 따로 번호를 부여하지 않음
② 우선순위가 높은 작용기가 붙은 탄소의 번호가 낮도록 숫자를 배열
○ 가장 우선순위가 높은 작용기가 붙은 탄소가 1번이 됨
③ 여러 가지 경우가 가능하다면 우선순위가 높은 작용기가 붙은 탄소가 1개라도 더 적은 번호를 갖도록 번호 부여
④ 그럼에도 여러 가지 경우가 가능하다면 알파벳 순으로 빠른 치환기에 낮은 번호가 붙어야 함
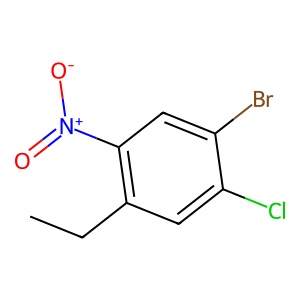
Figure. 2. 1-Bromo-2-chloro-4-ethyl-5-nitrobenzene
⑤ 1,2-치환은 ortho(o-), 1,3-치환은 meta(m-), 1,4-치환은 para(p-)로 나타낼 수 있음
⑶ 접미사 명명 : 관용명을 사용하며 IUPAC에서 승인
① 주작용기가 카르복실산(-COOH)인 경우 : 《 ··· + benzoic acid》
② 주작용기가 알데하이드(-CHO)인 경우 : 《··· + benzaldehyde》
③ 주작용기가 -COMe인 경우 : 《··· + acetophenone》
④ 주작용기가 히드록시기(-OH)인 경우 : 《··· + phenol》
⑤ 주작용기가 아미노기(-NH2)인 경우 : 《··· + aniline》
⑥ 주작용기가 에터(-OMe)인 경우 : 《··· + anisol》
⑦ 주작용기가 메틸기(-CH3)인 경우 : 《··· + toluene》
⑧ 기타 : chlorobenzene, styrene, t-butylbenzene, o-xylene, m-xylene, cumene, nitrobenzene, benzonitrile, mesitylene, o-cresol, m-cresol
⑷ 전체 이름 명명
① 우선순위가 같은 작용기는 알파벳 순으로 재배열
② 《(치환기 위치-치환기 이름)n + 주사슬 + 접미사》와 같이 명명
⑸ 벤젠기가 치환기로 취급되는 경우
① 벤젠보다 알킬 치환기의 탄소수가 적은 경우 알킬기를 치환기로 취급
② 벤젠보다 알킬 치환기의 탄소수가 많거나 같은 경우 벤젠을 치환기로 취급하여 phenyl(= Ph, Φ)로 표현
○ 예 : 2-phenylhexane (= n-hexylbenzene)
③ 이중결합 등과 같이 우선순위가 높은 작용기가 모체로 작용하는 경우 벤젠을 치환기로 취급
⑹ 나프탈렌(naphthalene), 안트라센(anthracene), 페난트렌(phenanthrene) 명명법

Figure. 3. 나프탈렌(naphthalene) 명명법

Figure. 4. 안트라센(anthracene) 명명법

Figure. 5. 페난트렌(phenanthrene) 명명법
⑺ 헤테로 방향족 명명법

Figure. 6. 피롤(pyrrole) 명명법

Figure. 7. 이미다졸(imidazole) 명명법

Figure. 8. 퓨란(furan) 명명법

Figure. 9. 피리딘(pyridine) 명명법

Figure. 10. 싸이오펜(thiophene) 명명법

Figure. 11. 피리미딘(pyrimidine) 명명법

Figure. 12. 퀴놀린(quinoline) 명명법

Figure. 13. 이소퀴놀린(isoquinoline) 명명법
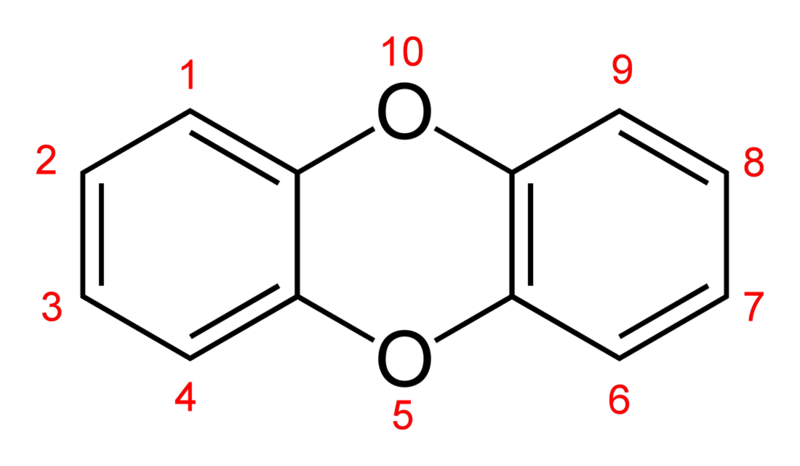
Figure. 14. dibenzo-p-dioxin 명명법
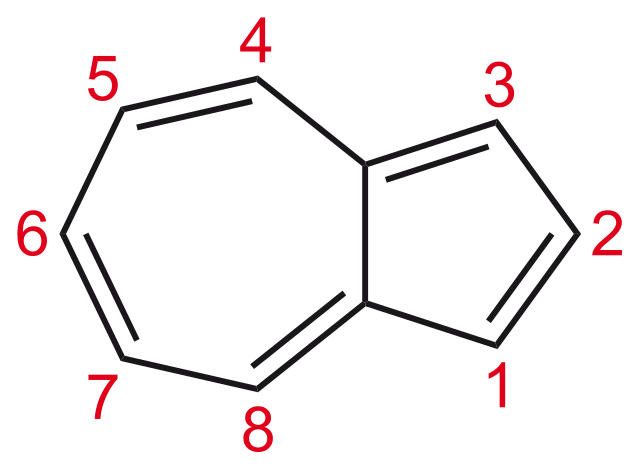
Figure. 15. azulene 명명법
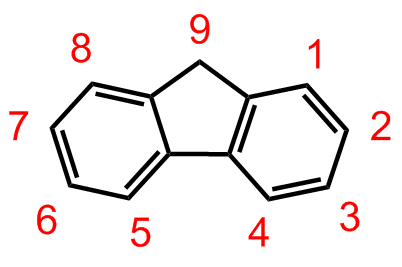
Figure. 16. fluorene 명명법
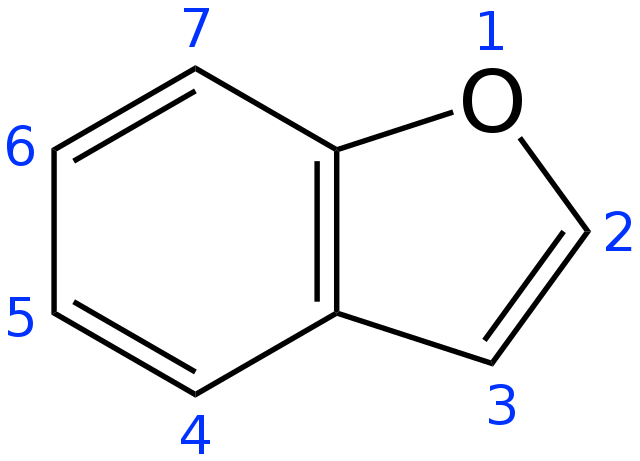
Figure. 17. benzofuran 명명법
3. 비편재화된 벤젠의 특성 [목차]
⑴ 케큘러(Kekulé) : 단일 결합과 이중 결합으로 표현되어도 모든 결합길이가 동일
① C-C 단일 결합 길이 : 154 pm
② C=C 이중 결합 길이 : 134 pm
③ 벤젠의 탄소 결합 길이 : 139 pm. 모든 탄소-탄소 결합길이가 동일함
⑵ 예상보다 낮은 수소첨가 반응열
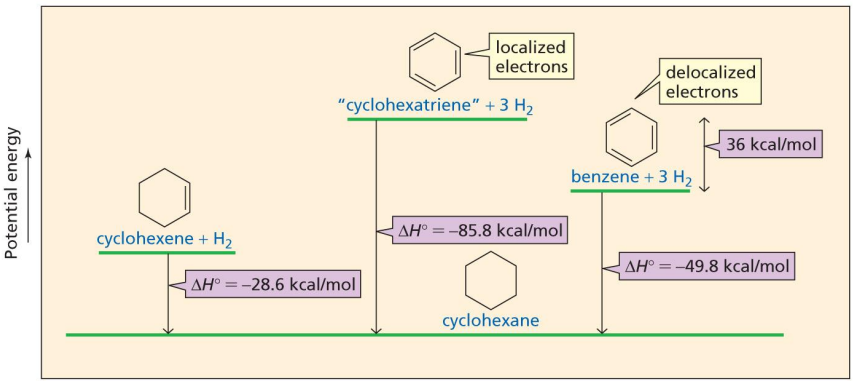
Figure. 18. 벤젠의 예상보다 낮은 수소 첨가 반응열
① cyclohexene이 cyclohexane보다 28.6 kcal/mol(= 118 kJ/mol)만큼 에너지가 높음
② 1,3-cyclohexadiene이 cyclohexane보다 230 kJ/mol만큼 에너지가 높음
③ 118 × 2 = 236 kJ/mol이 아닌 이유는 공명구조를 가지기 때문
④ benzene은 cyclohexane보다 49.8 kcal/mol (= 206 kJ/mol)만큼 에너지가 높음
⑤ 36 kcal/mol (= 152 kJ/mol)은 벤젠의 공명 안정화 에너지
⑶ 벤젠의 낮은 반응성 : 알켄, 알카인의 파이결합과 달리 반응이 일어나기 힘듦
① 예외 1. 고온·고압 조건에서 반응시켜 cyclohexane을 생성하는 반응
○ H2 / Ni
○ H2, Pt, ethanol, 130 atm, 25 ℃
○ H2, Rh / C, ethanol, 1 atm, 25 ℃
② 예외 2. 촉매 중수소화 반응 : 고온·고압 조건에서 D2, Rh / C 조건에서 벤젠에 중수소가 syn 첨가됨
⑷ 벤젠의 안정성 : 벤젠은 이미 전자가 풍부해 치환기가 전자를 제공하면 불안정해지고, 당기면 안정해짐

Figure. 19. benzene, nitrobenzene
① 예 : benzene보다 nitrobenzene이 더 안정하고, 에너지 수준이 낮음
⑸ ► 휘켈 근사(Hückel method)
① 정의 : cyclic 혹은 acyclic polyene의 MO 에너지 및 공명 에너지를 예측하는 방법
② 기본 방정식 : | Hij - E Sij |n×n = 0 (단, | · |은 행렬식)
○ n : MO의 개수
○ 단순화를 위해, Sii = 1, Sij (단, i ≠ j) = 0이라 가정
○ Hij : i번째 탄소가 j번째 탄소 자리에 주는 영향
○ Hii = α (Columb integral). α는 탄소의 2p 오비탈 에너지 (대략 -11 eV 또는 -1100 kJ/mol)
○ Hij (단, i ≠ j) = β (resonance integral). 폴리엔의 경우 β는 대략 α의 10%
○ α, β < 0 : 음의 포텐셜 에너지를 나타냄
③ 에너지 계산
○ 전체 에너지 : 기본 방정식에서 얻어진 여러 에너지 중 가장 낮은 에너지 자리부터 MO 전자를 채운 뒤, 그 합을 구함
○ π 전자 에너지 = 이중 결합 개수 × (2α + 2β)
○ 비편재 에너지(resonance energy) = 전체 에너지 - π 전자 에너지 - 고립 전자의 개수 × α
④ 예 1. ethene
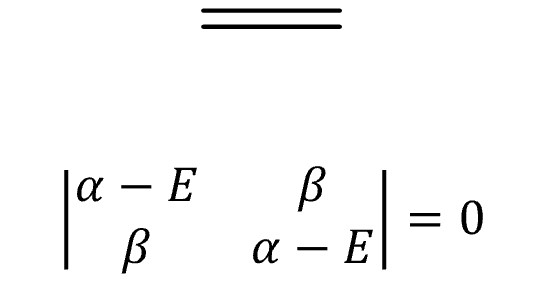
○ E = α ± β
○ MO 전자의 개수 = 2
○ 전체 에너지 = 2(α + β) = 2α + 2β
○ π 전자 에너지 = 2α + 2β
○ 비편재 에너지 = (2α + 2β) - (2α + 2β) = 0
⑤ 예 2. 1,3-butadiene
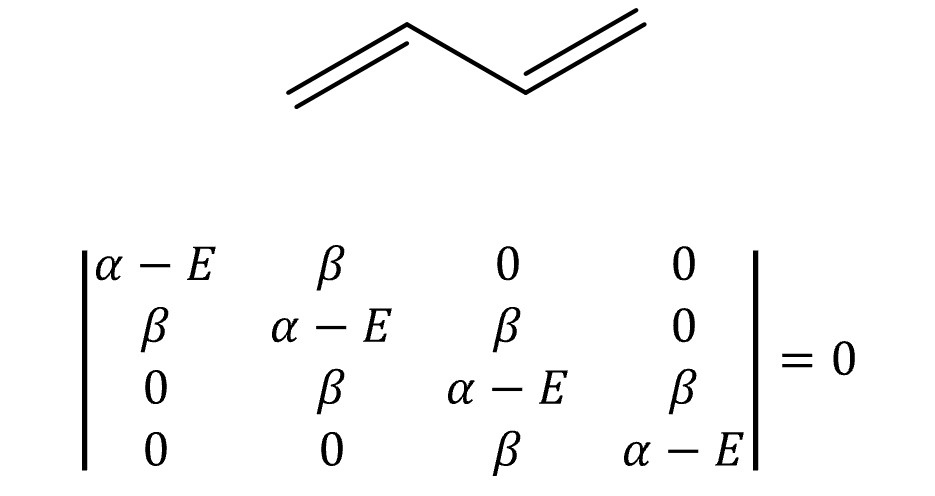
○ E = α ± 1.618β, α ± 0.618β
○ MO 전자의 개수 = 4
○ 전체 에너지 = 2 × (α + 1.618 β) + 2 × (α + 0.618 β) = 4α + 4.472 β
○ π 전자 에너지 = 2 × (2α + 2β) = 4α + 4β
○ 비편재 에너지 = (4α + 4.472 β) - (4α + 4β) = 0.472 β
⑥ 예 3. cyclopropenyl
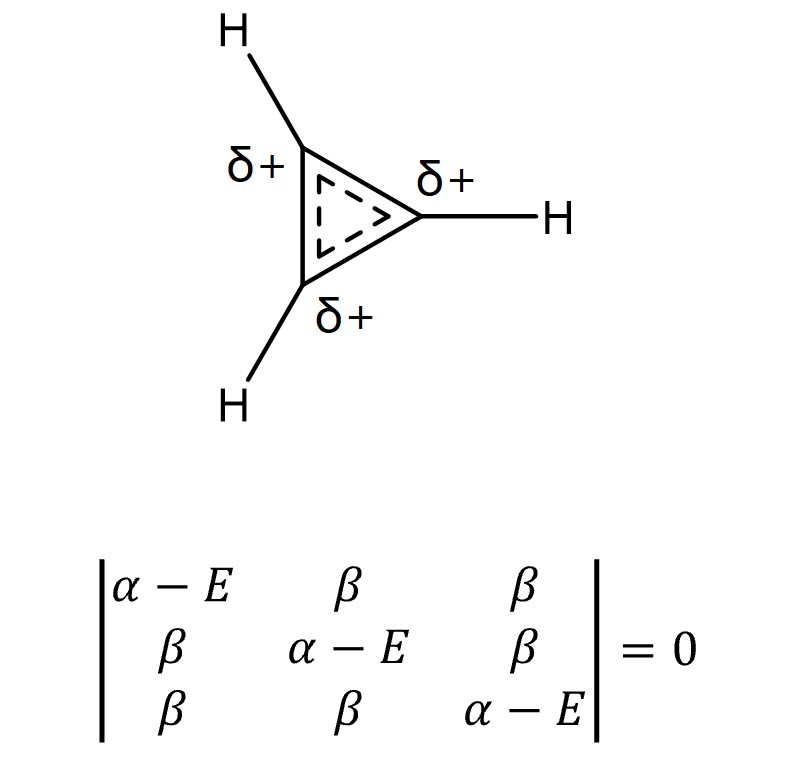
○ E = α + 2β, α – β, α – β
○ MO 전자의 개수 = 2
○ 전체 에너지 = 2 × (α + 2β) = 2α + 4β
○ π 전자 에너지 = 2α + 2β
○ 비편재 에너지 = (2α + 4β) - (2α + 2β) = 2β (∴ 방향족성)
⑦ 예 4. 벤젠(benzene)
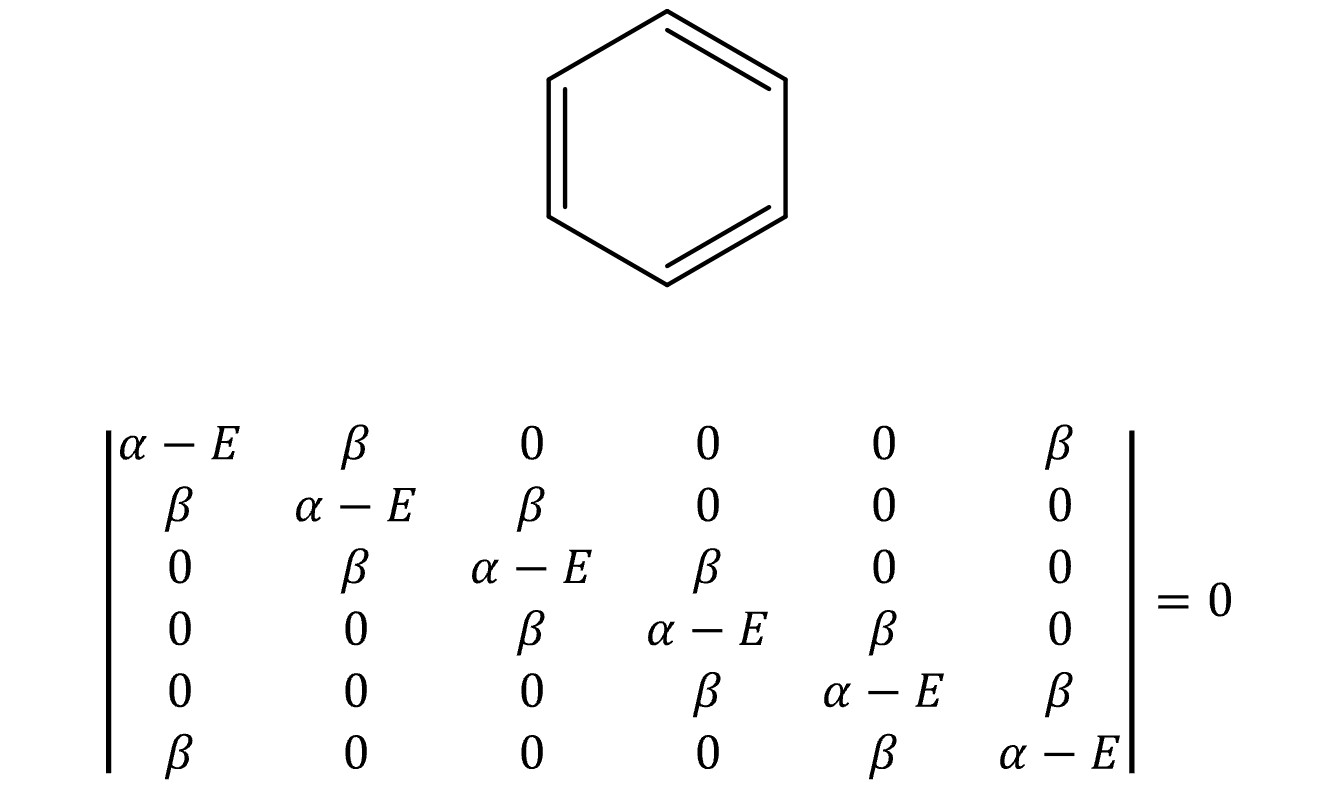
○ E = α + 2β, α + β, α + β, α – β, α – β, α - 2β
○ MO 전자의 개수 = 6
○ 전체 에너지 = 2 × (α + 2β) + 4 × (α + β) = 6 α + 8 β
○ π 전자 에너지 = 3 × (2 α + 2β) = 6 α + 6 β
○ 비편재 에너지 = (6 α + 8 β) - (6 α + 6 β) = 2 β (∴ 방향족성)
⑧ 예 5. 트라이메틸렌메테인
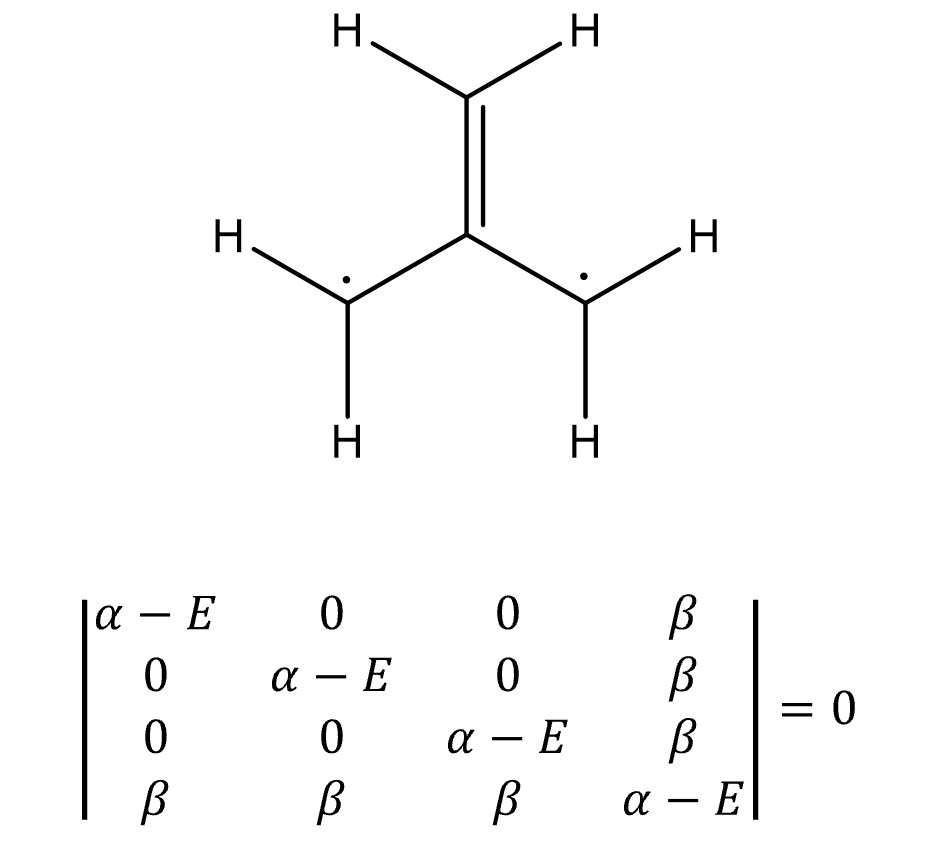
○ E = α ± √3 β, α, α
○ MO 전자의 개수 = 4
○ 전체 에너지 = 2 × (α + √3 β) + 2 × α = 4α + 2√3 β
○ π 전자 에너지 = 2α + 2β
○ 고립 전자 에너지 = 2α
○ 비편재화 에너지 = (4α + 2√3 β ) - (2α + 2β ) - 2α = (2√3 - 2)β
⑨ 예 6. 알릴 라디칼
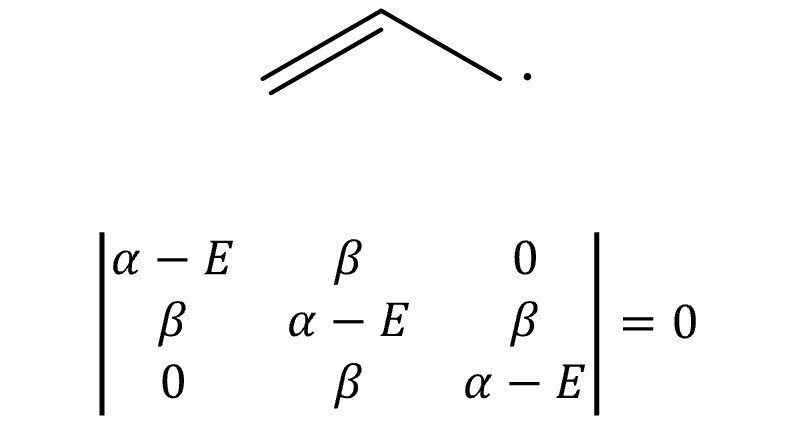
○ E = α ± √2 β, α
○ MO 전자의 개수 = 3
○ 전체 에너지 = 2 × (α +√2 β) + α = 3α + 2√2β
○ π 전자 에너지 = 2α + 2β
○ 고립 전자 에너지 = α
○ 비편재화 에너지 = (3α + 2√2β ) - (2α + 2β ) - α = (2√2 - 2)β
4. 반응 1. 친전자성 방향족 치환반응(EAS, electrophilic aromatic substitution reaction) [목차]
⑴ 개요 : 할로젠화, 설폰화, 니트로화, 아실화, 알킬화, 과산화물
① 벤젠은 반응성이 낮은 친핵체
② 반응성이 높은 친전자체 E+를 사용하여 친전자성 반응을 진행
○ arenium ion인 E+를 생성하는 단계가 속도 결정 단계
③ E+는 촉매를 사용하여 반응계 내에서 생성
④ 경향성 1. 벤젠 고리는 전자 밀도가 높을수록 EAS를 더 잘 수행함
○ 예 : isoquinoline의 두 고리 중 질소가 포함된 고리의 탄소들이 더 낮은 전자 밀도를 가지므로 질소가 없는 방향족 고리에서 먼저 반응이 일어남
⑤ 경향성 2. benzene < thiophene < furan < pyrrole
○ (참고) 방향족성 : benzene > thiophene > pyrrole > furan
⑵ 반응 1. 할로젠화(halogenation)
① 1-1. 벤젠의 할로젠화 : (공식) X2 + FeX3 → FeX4- + X+

Figure. 20. 벤젠 할로젠화 메커니즘
○ 반응성 순서 : F > Cl > Br > I 순
○ fluorination : 반응이 너무 빠름. fluoroborate 제공 시약인 F-TEDA-BF4를 처리하여 개선 가능
○ iodination : 반응이 너무 느림. 질산을 처리하여 방향족의 친전자성을 높일 수 있음
② 1-2. furan의 halogenation : dioxane / 0 ℃ 하에서 반응
○ ortho 배향이 para 배향보다 우세한 이유는 ortho 배향이 공명기여체의 개수가 많기 때문
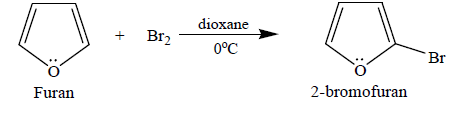
Figure. 21. furan의 halogenation
③ 1-3. NBS, NIS를 통한 방향족 할로젠화 반응 : NBS, NIS는 각각 Br, I donor로 작용함
⑶ 반응 2. 설폰화(sulphonation)
① 2-1. 벤젠의 설폰화 : (공식) H2SO4 + H2SO4 → SO3H+ + HSO4- + H2O
○ 촉매 : SO3가 사용됨

Figure. 22. 벤젠 설폰화 메커니즘
② 2-2. furan의 sulphonation : pyridine / ethylene chloride, 100 ℃ 하에서 진행
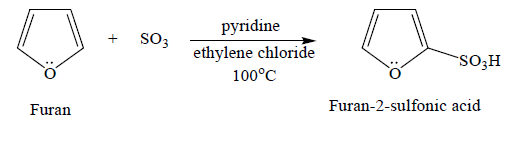
Figure. 23. furan의 sulphonation
○ ortho 배향이 para 배향보다 우세한 이유는 ortho 배향이 공명기여체의 개수가 많기 때문
③ 특징
○ EAS 중 유일하게 가역반응이 가능 : 이로 인해 방향족 화합물을 EAS로부터 보호하는 반응으로 사용할 수 있음
○ 설폰화 반응시 진한 H2SO4 농도에서 진행
○ 탈설폰화 반응시 묽은 H2SO4 농도에서 진행
○ alkali fusion : 설폰기가 첨가된 벤젠은 NaOH, heat 조건에서 SO3H기가 SO3로 이탈되고 OH기가 대신 붙음
⑷ 반응 3. 니트로화(nitration)
① 3-1. 벤젠의 니트로화 : (공식) HONO2 + H2SO4 → NO2+ + HSO4- + H2O
○ 고농도의 H2SO4, HNO3에서 반응이 잘 일어남
○ HNO3 / H2SO4 외에 NO2BF4 시약에 의해서도 가능
○ (공식 1) H2 / Pd이면 -NO2기를 -NH2로 바꿈
○ (공식 2) Sn / HCl이면 -NO2기를 -NH2로 바꿈
○ 유기화학 실험
○ 맨 처음 진한 질산과 진한 황산을 넣은 후 상온으로 냉각한 후 환류장치를 개방
○ 온도를 조절함으로써 다이나이트로화(dinitration)를 억제

Figure. 24. 벤젠 니트로화 메커니즘
② 3-2. furan의 니트로화 : HNO3 / anhydride 하에서 진행
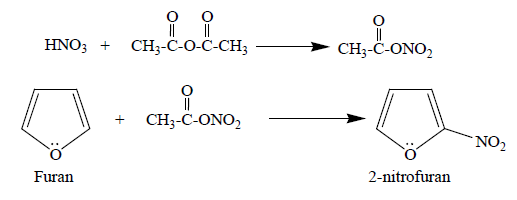
⑸ 반응 4. 아실화(Friedel-Crafts acylation)
① 개요 : 아실기(acyl group)는 RCO-기를 지칭
② 4-1. 벤젠의 아실화 : (공식) RCOCl + AlCl3 → RCO+ + AlCl4-

Figure. 26. 벤젠 아실화 메커니즘
○ AlCl3는 촉매로 사용되지 않고 소모됨
○ 비닐 탄소양이온(vinyl carbocation, acylium ion)은 매우 불안정하므로 다른 공명구조로 재빨리 바뀜

Figure. 27. 비닐 탄소양이온의 공명
③ 4-2. furan의 acylation : anhydride / BF3 하에서 진행
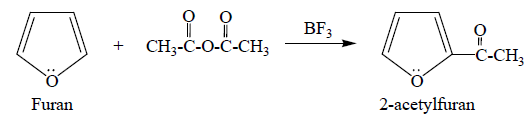
④ 4-3. fluorescein 합성 반응 : phthalic anhydride + 2 × resorcinol → fluorescein (촉매 : ZnCl2)
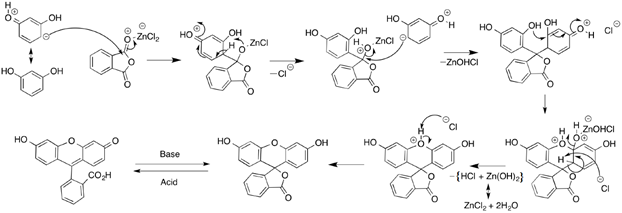
⑤ 4-4. Gattermann-Koch 반응
○ 평범한 Friedel-Crafts 아실화 반응으로 벤젠에 formyl기(-CHO)를 도입하는 것은 불가능
○ HCl과 루이스 산 하에서 압력을 가해 벤젠과 CO를 반응시켜야 함
⑥ 4-5. Blanc chloromethylation
○ 반응물 : 벤젠, HCHO
○ 시약 : HCl, ZnCl2
○ 생성물 : 1-(chloromethyl)benzene
⑦ 4-6. Fries rearrangement reaction
○ phenol + RCOCl : O-acylation
○ phenol + RCOCl + AlCl3 : C-acylation (Friedel-Crafts acylation)
○ 프라이즈 자리옮김반응은 O-아실화 생성물에서 자리옮김반응을 통해 C-아실화 생성물로 전환하는 반응
⑧ 한계
○ 문제 1. vinyl halide, aryl halide는 기질로 작용할 수 없음 : 탄소양이온이 몹시 불안정하여 반응성이 낮음
○ 문제 2. 강한 EWG가 치환된 방향족 고리에는 아실화 반응이 일어나지 않음
○ 문제 3. 예외적으로 아닐린은 EDG가 치환돼 있음에도 반응이 일어나지 않음
○ 이유 : 아닐린의 -NH2는 AlCl3와 산염기 반응을 하여 -N+H2AlCl3가 되므로 강한 EWG가 됨
⑹ 반응 5. 알킬화(Friedel-Crafts alkylation)
① (공식) RCl + AlCl3 → R+ + AlCl4-
② 메커니즘

Figure. 30. 벤젠 알킬화 메커니즘
○ R+ → R*+로 자리옮김반응이 일어날 수 있음을 유의
○ 2차, 3차 alkyl fluoride : AlCl3 대신 SbF5(antimony pentafluoride, super acid)를 사용
③ 한계
○ 문제 1. 자리옮김반응 : Friedel-Crafts 아실화 반응은 자리옮김반응이 일어나지 않음
○ 문제 2. vinyl halide, aryl halide는 기질로 작용할 수 없음 : 탄소양이온이 몹시 불안정하여 반응성이 낮음
○ 문제 3. 벤젠에 강력한 EWG가 존재하는 경우 알킬화 및 아실화는 일어나지 않음
○ 문제 4. 예외적으로 아닐린은 EDG가 치환돼 있음에도 반응이 일어나지 않음
○ 이유 : 아닐린의 -NH2는 AlCl3와 산염기 반응을 하여 -N+H2AlCl3가 되므로 강한 EWG가 됨
○ 문제 5. 다중 알킬화 반응 : 알킬기가 첨가될 수록 벤젠의 EAS 반응성이 높아지기 때문
⑺ 반응 6. 아릴화(Friedel-Crafts arylation)
① (공식) -OH기를 제거하고 방향족 고리를 붙임
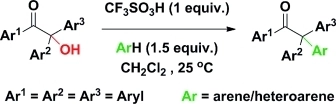
Figure. 31. CF3SO3H Friedel-Crafts arylation
⑻ 반응 7. SnCl4 촉매 하 EAS
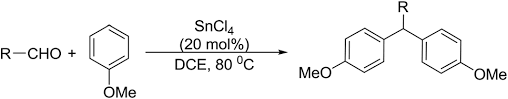
Figure. 32. SnCl4 촉매 하 EAS
⑼ 반응 8. 과산화물 (예 : (CH3CO)2O(acetic anhydride))
⑽ 반응 9. 기타 탄소-탄소 짝지음 반응
① 유기금속시약에 의한 탄소-탄소 짝지음 반응
② Stille coupling : 팔라듐 촉매, 유기 주석
③ Negishi coupling : 팔라듐 촉매, 유기 아연
④ Heck coupling (Heck reaction)
○ (공식) haloalkene or haloarene과 vinyl-H (즉, 알켄에 붙어 있는 수소)가 palladium 촉매 및 염기 하에 반응을 하여, vinyl-H가 X-와 함께 HX를 이루어 이탈되고 vinyl-H 자리에 대신 R기가 치환됨. 예를 들어, haloarene이 반응물이었으면 Phe기가 치환됨
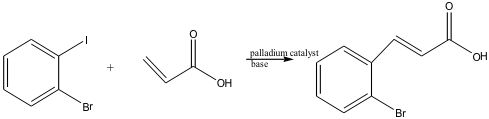
Figure. 33. Heck coupling
○ 기질 : vinyl halide, aryl halide, heterocyclic halide, benzylic halide, trifluoromethanesulfonate (CF3SO2O, triflate)
○ 팔라듐 촉매 : Pd(OAc)2 (가장 많이 사용), P(o-tolyl)3, (CH3CH2)3N 등을 촉매로 이용
○ 염기 : Et3N, NaOAc, NaHCO3, KOAc
○ 용매 : DMF, CH3CN, DMSO 등 극성 비양성자성 용매 (∵ Pd(OAc)2를 용해시키기 위함)
○ 리간드 : Pd(0)와 배위결합하는 리간드로서 Ph3P가 사용됨
○ 메커니즘 : 평면 사각형의 중간체 Pd(Ⅱ)가 생성됨
○ 높은 위치선택성 : 새로운 덜 치환된 vinyl-H 쪽에서 일어남 (∵ steric effect)
○ 높은 입체선택성 : 전적으로 trans 배열의 생성물만 얻어짐
○ 할라이드의 반응성 : I > Br > Cl
○ 이중 결합에 치환된 정도가 작을수록 반응이 빨라지고 수율이 높아짐 (∵ steric effect)
⑤ 스즈키 커플링(Suzuki coupling, Suzuki-Miyaura coupling)
○ (공식) 유기 붕소 시약이 팔라듐 촉매 및 염기 하에 할로젠화 알킬과 탄소-탄소 짝지음 반응
○ 할로젠화 알킬 : vinyl halide (triflate), alkynyl halide, aryl halide
○ 팔라듐 촉매 : biaryl phosphine ligand XPhos (XPhos Pd G4) 등
○ 메커니즘 : oxidative addition (빠름), transmetalation (느림), reductive elimination (느림) 등 3단계로 구성
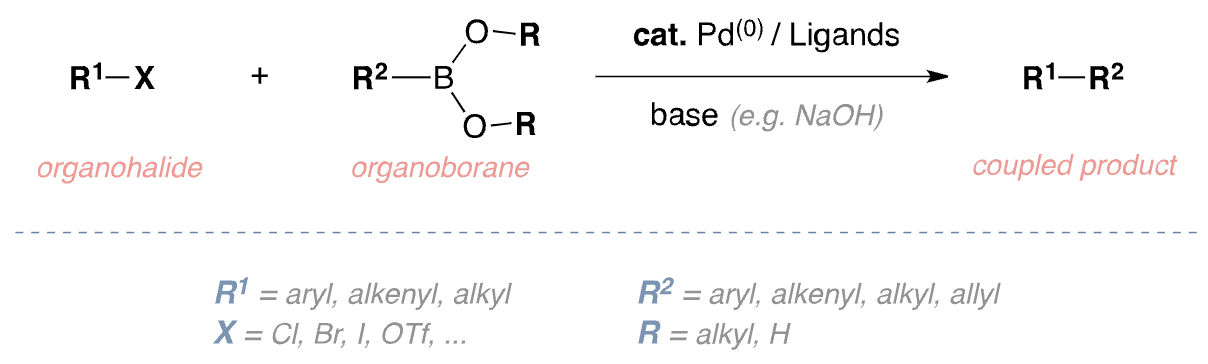
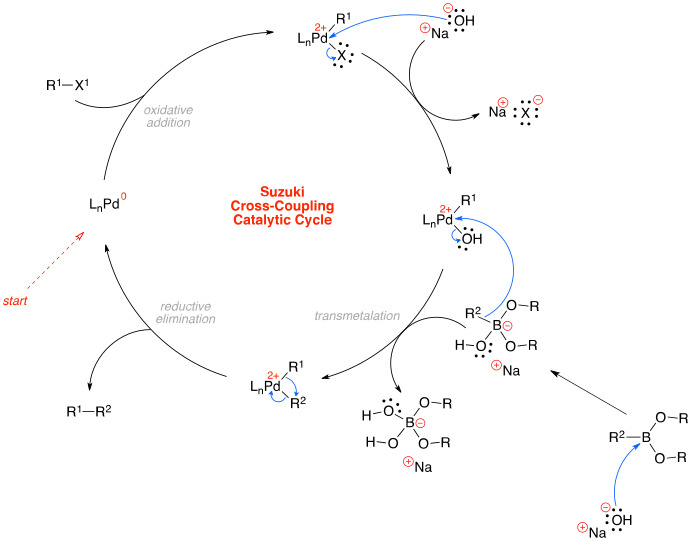
Figure. 34. 스즈키 커플링 메커니즘
○ 예 1. Grignard 커플링과 스즈키 커플링 응용
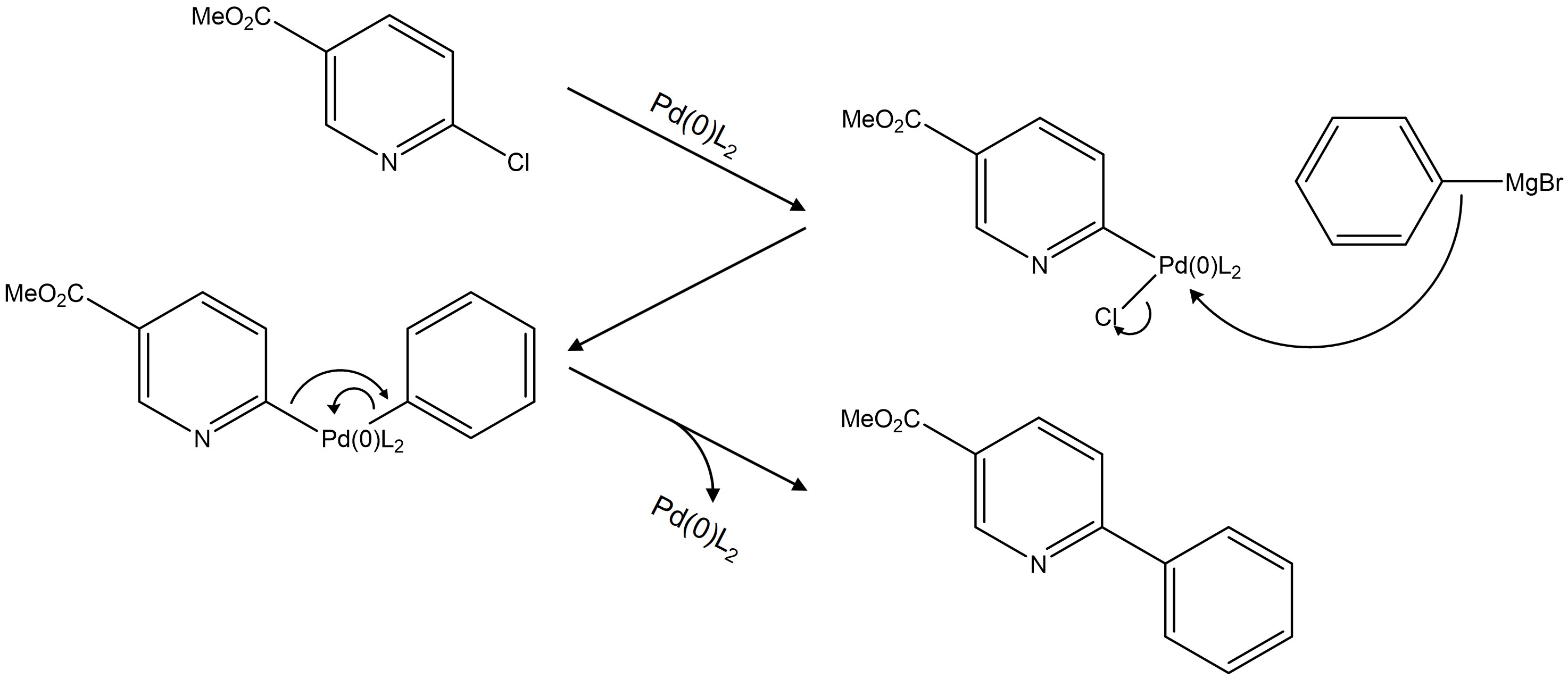
Figure. 35. Grignard 커플링과 스즈키 커플링 응용
○ 예 2. aryl boronic acid와 aryl bromide의 Suzuki coupling
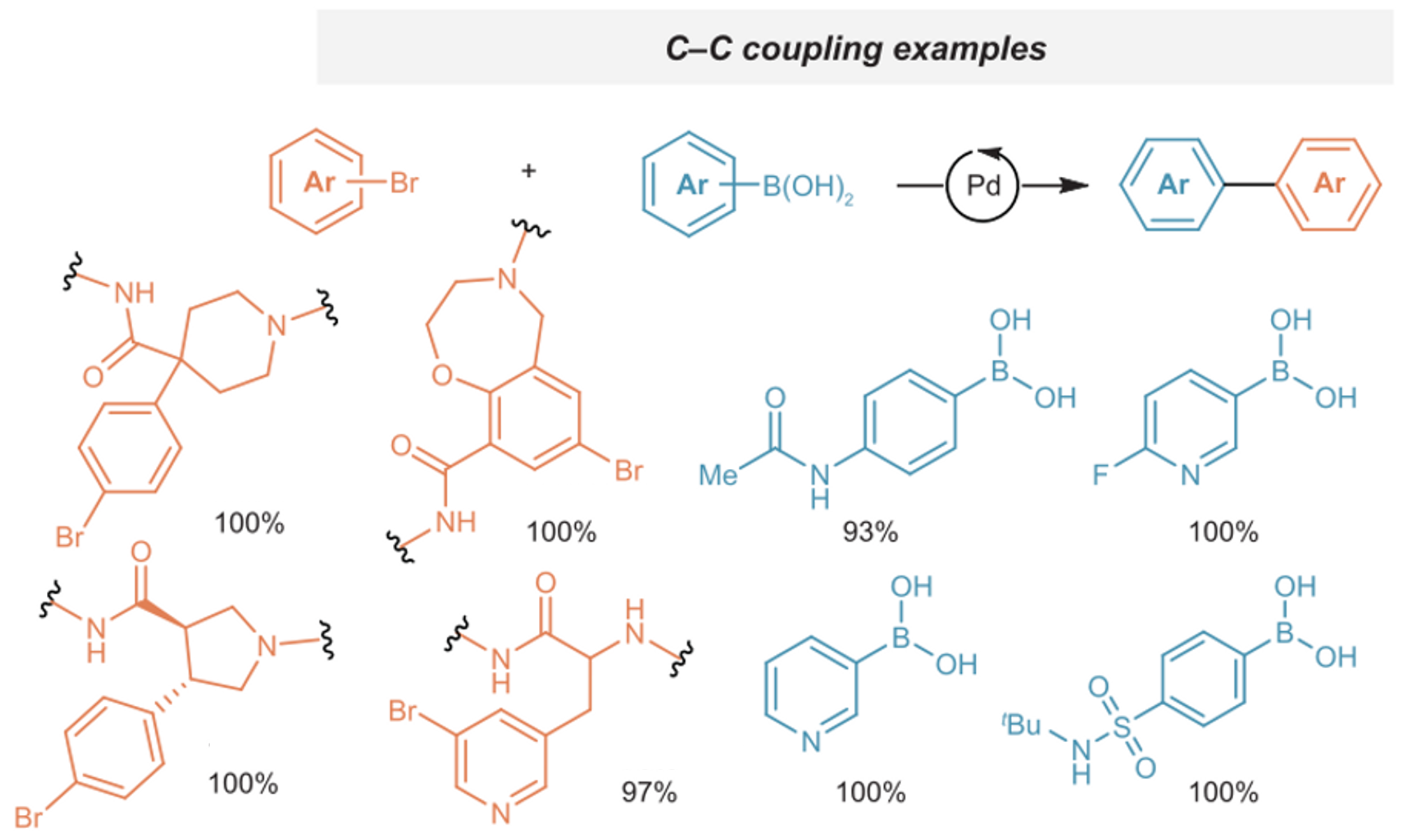
Figure. 36. aryl boronic acid와 aryl bromide의 Suzuki coupling
⑥ Hiyama coupling : 팔라듐 촉매, 유기 실레인
⑦ Kumada coupling : 팔라듐 촉매, 그리냐드 시약
⑧ Yamada coupling
⑨ 팔라듐 촉매 하 아닐린 유도체와 aryl bromide 간 커플링 반응 (탄소-질소 짝지음 반응)
○ 팔라듐 촉매 : AlPhos-ligated palladium dimer 등
○ 기타 조건 : DBU in THF at 50°C
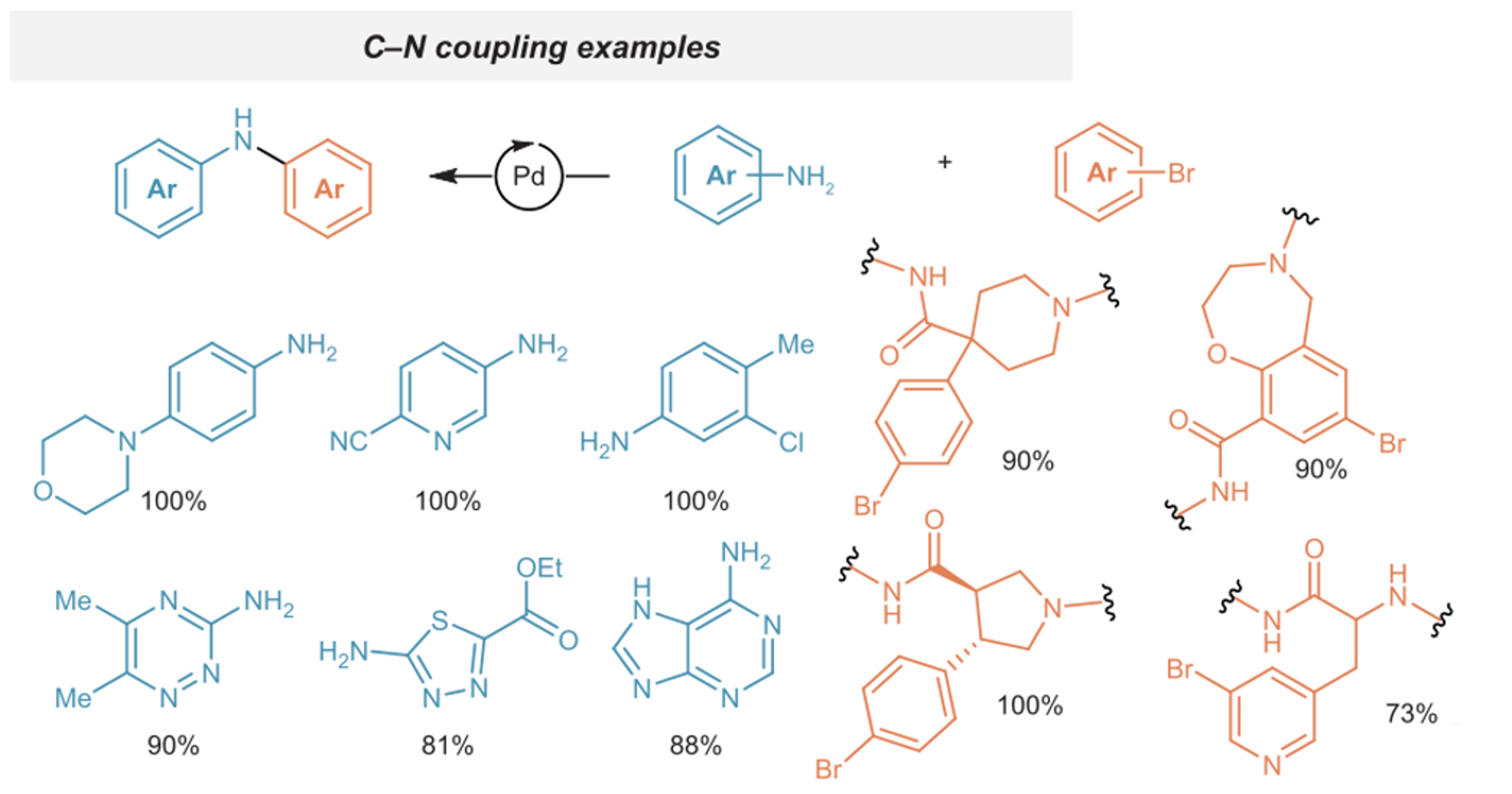
Figure. 37. 팔라듐 촉매 하 아닐린 유도체와 aryl bromide 간 커플링 반응
⑩ 3-aryl oxetane의 탄소-탄소 짝지음 반응 (ref)
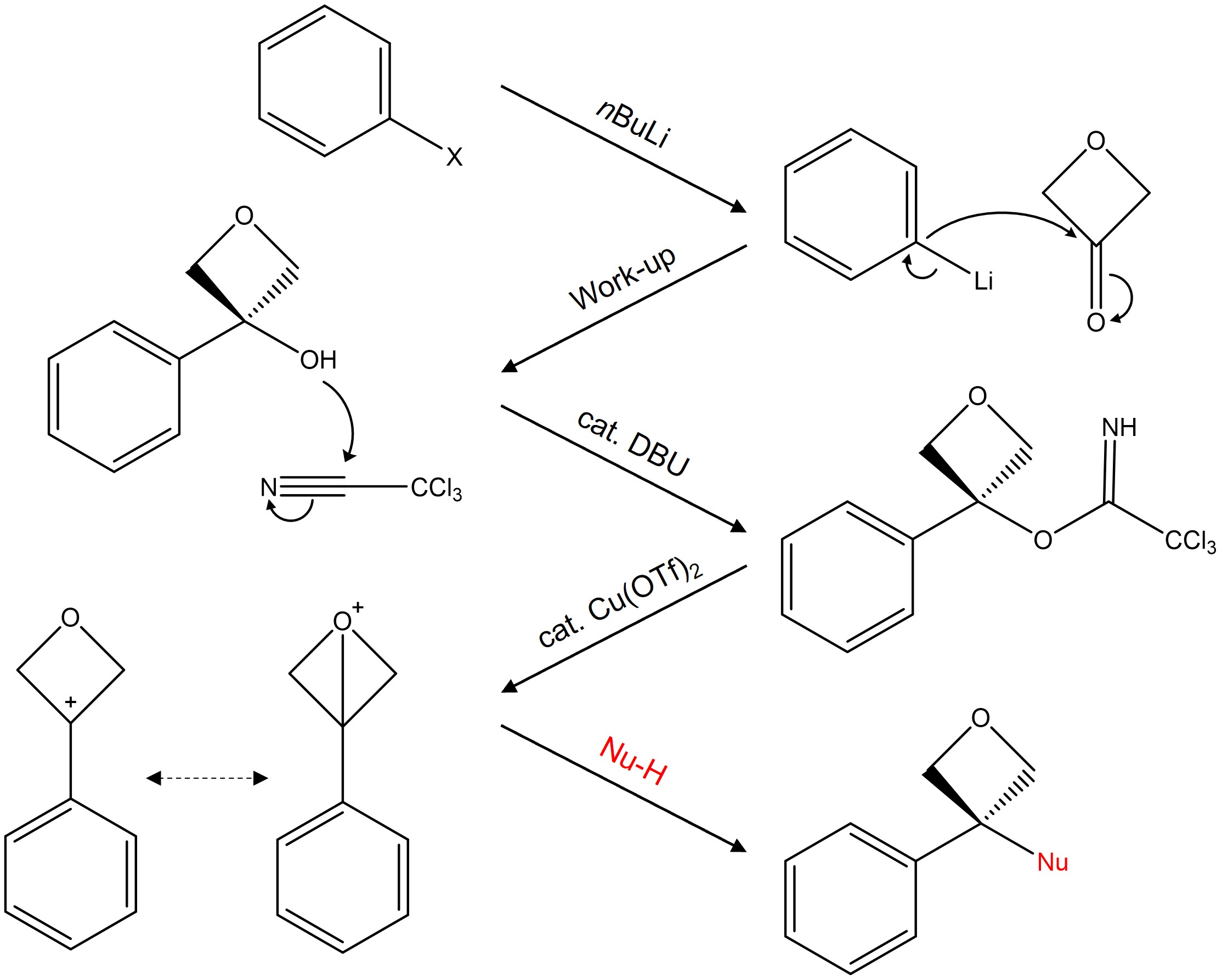
Figure. 38. 3-aryl oxetane의 탄소-탄소 짝지음 반응
5. 반응 2. 친핵성 방향족 첨가반응(SNAr, nucleophilic aromatic substitution) [목차]
⑴ 개요
① SN2-like 하지 않음
○ 이유 1. 페닐기의 입체장애
○ 이유 2. 할로젠기 등은 공명구조에 의한 이중결합적 성격을 가짐
○ 이유 3. sp2 탄소는 결합력이 강함
② SN1-like 하지 않음 : 페닐 양이온이 불안정하기 때문
⑵ 반응 1. 첨가 후 제거반응
① 1-1. 일반적인 첨가 후 제거반응

○ 친핵체를 할로젠기 자리에 첨가 후 할로젠기 이탈
○ 중간체를 meisenheimer라고도 함
○ meisenheimer가 생성되는 단계가 속도결정단계
○ EAS와 달리, EWG가 ortho, para로 배향되면 반응이 잘 일어남
○ 할로젠기의 반응속도 비교 : 전기음성도가 클수록 유발효과 중간체를 안정화하기 때문
F ≫ Cl > Br ≫ I
② 1-2. Chichibabin reaction
⑶ 반응 2. 제거 후 첨가반응 : 벤자인(benzyne) 생성 반응
① 2-1. 일반적인 제거 후 첨가반응

○ 벤자인(benzyne)
○ 벤자인 내 삼중결합에 참가하는 탄소는 sp 혼성과 sp2 혼성의 중간성격을 가짐
○ 만일 sp 혼성을 가지면 VSEPR에 의해 일직선이 되므로 고리 스트레인이 상당하고 반방향족성
○ 따라서 벤자인의 삼중결합은 1개의 π 결합과 1개의 σ 결합, 그리고 σ 결합으로 구성
○ 즉, 알켄으로부터 벤자인이 형성될 때, 새롭게 형성된 π 결합은 sp2-sp2 오비탈 겹침으로 이루어짐

Figure. 41. 벤자인의 결합 개념
○ 할로젠기가 있는 벤젠에 염기가 첨가되면 벤자인이 생성됨
○ 자주 쓰이는 염기 : KNH2, NaNH2
○ 제거 후 첨가반응의 특징
○ 벤자인 형성 단계가 속도결정단계
○ 중수소를 떼기 어려우므로 속도론적 동위원소 효과를 관찰할 수 있음
○ 할로젠 원소가 이탈기로 떨어지기 쉬울수록 반응속도가 빨라짐
F < Cl < Br < I
○ 벤자인의 친핵성 탄소, 친전자성 탄소 판단은 곁사슬의 유도효과만 고려
○ 예 : -OMe는 EDG이나 벤자인의 안정성 판단시 공명 효과가 없으므로 오직 유도효과로 인해 EWG로 고려
○ EWG의 meta 배향으로 치환기가 생김
○ 치환기가 2개인 벤젠의 제거 후 첨가반응
○ 두 치환기가 ortho 또는 meta인 경우 : meta 치환
○ 두 치환기가 para인 경우 : 전자당김 유발효과의 경우 para 치환, 전자주기 유발효과의 경우 meta 치환
② 2-2. 벤자인에서의 Diels-Alder 반응
③ 2-3. 그 밖의 벤자인 제법
○ F 제공원 : CsF, TBAF, TBAT, TMAF
○ Mg / THF
○ 탈질화 반응을 응용
6. 반응 3. 기타 반응 [목차]
⑴ 친전자성 방향족 첨가반응
① 고리의 크기가 커질수록 고리 1개당 잃어버린 공명 안정화 에너지의 크기가 줄어들어 첨가반응이 일어날 수 있음
② 안트라센(anthracene), 페난트렌(phenanthrene)은 9번, 10번 자리에 친전자성 방향족 첨가반응이 일어날 수 있음
⑵ 방향족 곁사슬 산화반응
① (공식 1) 1. KMnO4, OH-, Δ, 2. H+ : 수소를 가지고 있는 벤질자리 탄소를 -COOH로 전환
② (공식 2) KMnO4, Na2Cr2O7, H2Cr2O7, H2ClO4 : 수소를 가지고 있는 벤질자리 탄소를 -COOH로 전환
③ (공식 3) CF3CO3H : 아미노기를 나이트로기로 산화
⑶ 아닐린(aniline)
① 디아조화 반응(diazotization, diazotisation)
○ (공식 1) 아닐린에 HNO2 / H2SO4를 첨가하면 diazobenzene (작용기 : -N2+)이 됨
○ (공식 2) 아닐린 + NaNO2, HCl, 0 ℃ → diazobenzene
○ 메커니즘

Figure. 42. 디아조화 반응 메커니즘
○ 반응 중간에 nitrosonium ion (+N=O)이 생기는 게 특징
○ 니트로화 반응조건 HNO3 / H2SO4와 헷갈리지 말 것
○ 반응 1. Sandmeyer 반응
○ Ph-N2+ + CuBr → Ph-Br + N2 (g)
○ Ph-N2+ + KI → Ph-I + N2 (g)
○ Ph-N2+ + CuC≡N → Ph-C≡N + N2 (g)
○ Ph-N2+ + H3O+ → Ph-OH + HCl + N2 (g) (조건 : Δ)
○ Ph-N2+ + CuCl → Ph-Cl + N2 (g)
○ Ph-N2+ + Cu2O, Cu(NO3)2, H2O → Ph-OH + N2 (g)
○ Ph-N2+ + H3PO2 → benzene + N2 (g)
○ 반응 2. Schiemann reaction
○ Ph-N2+ + HBF4 → Ph-F + BF3 + N2 (g) (조건 : Δ)
② 아세틸화 반응
○-NH2기는 강한 EDG이기 때문에 촉매 없이 무수화물(anhydride, R-CO-O-CO-R)과 반응
○ 반응 결과 아마이드, 즉 acetanilide를 생성함
○ 실익 1. -NH2기 보호 반응
○ 실익 2. 아닐린의 반응성 감소 : 아닐린은 반응성이 커서 할로젠화 반응시 3치환 생성물이 얻어짐
○ 1. H3O+, Δ, 2. NaOH 조건에서 -NH2기로 전환
○ 1번 조건에서 아마이드 가수분해 반응이 일어나 -NH3+기가 됨
○ 2번 조건에서 NaOH로 -NH2기로 전환
⑷ Birch reduction
① 반응시약 : 1. 알칼리금속(Na, Li 등), NH3 (산으로 작용), 2. ROH (산으로 작용)
② 메커니즘

Figure. 43. Birch reduction 메커니즘
○ 알칼리금속이 물에 들어가면 강렬하게 반응하면서 이온이 됨
○ 이때 라디칼 전자 한 개 방출되어 벤젠고리에 들어간 뒤 공명이 일어남
○ 이후 전자가 하나 더 들어가고 NH3가 특이하게 산으로 작용하여 라디칼 전자 두 개 회수
○ 그 뒤 ROH가 촉매하는 토토머화가 일어날 수 있음
③ (공식 1) 벤젠고리에서 마주보든 두 지점이 sp3가 되도록 이중결합 위치 조절
④ (공식 2) sp3가 되는 지점이 EWG에 위치하고 EDG에 위치하지 않도록 해야 함
○ 메커니즘 상 탄소 음이온이 이중결합이 없는 자리에 오므로
⑤ (참고) 알카인 anti 첨가반응과 반응조건이 유사
⑸ 페놀의 Williamson Ether 합성법
① (공식) CH3I, OH- 조건에서 -OH기를 -OCH3로 치환
⑹ 치환기 환원 반응
① Clemmensen reduction
○ (공식 1) Zn, Fe, Ni, Hg or SnCl2 / HCl 조건에서 벤질자리에 있는 NO2, 케톤, 알데하이드를 NH2, CH2로 환원
○ (공식 2) H2, Pt 조건에서 벤질자리에 있는 NO2, 케톤, 알데하이드를 NH2, CH2로 환원
○ 케톤 : C=O의 산소가 Zn에 붙음 → HCl이 탄소에게 proton을 제공 → Zn이 산화하면서 산소에 전자를 제공 → 환원
○ 공명체 알켄은 환원이 안 됨
○ 카르복실산, 에스터는 환원이 안 됨
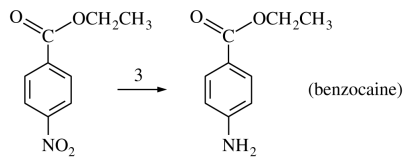
Figure. 44. Clemmensen reduction의 예시
② Wolff-Kishner reduction : acyl 치환기를 alkyl 치환기로 환원
③ thioacetal + H2 / Raney-Ni (desulfurization) : acyl 치환기를 alkyl 치환기로 환원
④ H2S, NH3, C2H5OH : m-dinitrobenzene을 m-nitroaniline으로 환원시킬 수 있음
⑺ 벤젠과 과산화수소와의 반응
① benzene + CF3SO3H + H2O2 → phenol
⑻ Claisen 자리옮김반응 : 알릴 페닐 에터가 반응물로 참가
⑼ 페놀 산화반응
① Fremy salts ((KSO3)2NO)를 이용하여 벤조 퀴논으로 산화키실 수 있음
⑽ quinone의 환원반응
① NaBH4, SnCl2, coenzyme Q 등을 이용하면 페놀로 hydroquinone으로 환원시킬 수 있음
7. 다중치환효과 [목차]
⑴ 치환기 그룹 : (참고) 치환기 그룹의 개념이 비단 방향족 화합물에만 국한되는 건 아님
① 강한 활성화 치환기 : -NH2, -NHR, -NR2, -OH, -O-
○ 비공유전자쌍을 가지고 있는 그룹
② 보통 활성화 치환기 : -NHCOCH3, -NHCOR, -OCOCH3, -OCH3, -OR
○ 비공유전자쌍을 가지지만 전자당김유발효과도 큰 그룹
③ 약한 활성화 치환기 : -R, -Phe
○ 전자제공 유발효과가 있는 그룹
④ -H : 벤젠
⑤ 약한 활성감소 치환기 : -X
○ 할로젠 그룹
⑥ 보통 활성감소 치환기 : -C≡N, -SO3H, -CO2H, -CO2R, -CHO, -COR
○ 아세틸기(-COR)는 나이트릴기(-C≡N), 설폰기(-SO3H)보다 약한 EWG
⑦ 강한 활성감소 치환기 : -CF3, -CCl3, -NO2, -N+R3
○ 양하전이 있거나 -CF3 그룹
○ -CF3와 -NR3는 EWG로서의 능력은 약하나 활성 감소는 뛰어남
⑵ 활성화 치환기(EDG, electron donating group) : ortho 치환, para 치환
① 강한/보통 활성화 치환기
○ 전자주기 공명효과 > 전자끌기 유발효과 : 반응물인 벤젠에 전자를 제공해 주는 효과가 있어 반응물이 불안정
○ 중간체의 경우 카보양이온에게 전자를 제공해 주는 효과가 있어 중간체가 안정
○ 활성화에너지가 작으므로 반응이 빨리 일어남
② 약한 활성화 치환기 : 반응물인 벤젠에 전자제공 유발효과가 있어 반응물이 불안정
⑶ 활성감소 치환기(EWG, electron withdrawing group)
① 할로젠 그룹 : ortho 치환, para 치환
○ 전자끌기 유발효과 > 전자주기 공명효과
○ F : 전기음성도가 커서 전자끌기 유발효과가 전자주기 공명효과보다 큼 → 활성감소
○ Cl, Br, I : 2p-3p 오비탈 겹침처럼 2주기 탄소와 주기 차이가 나게 되면 비공유전자쌍의 공명효과가 정말 떨어짐
○ fluorobenzene이 다른 halobenzene보다 친전자성 첨가를 잘 함 : p-p 오비탈 겹침이 그만큼 중요!
○ F > Cl > Br > I 순으로 EAS와 SNAr이 모두 빠름
○ 할로젠기가 EDG로 간주되는 경우
○ 여러 벤젠 유도체 중 반응속도를 비교하는 경우 할로젠기를 EWG로 간주하고 반응이 느린 것으로 해석
○ 일단 할로젠화 벤젠이 주어지고 주생성물을 결정하는 경우 EDG처럼 o 또는 p 이성질체가 주생성물로 얻어짐
○ 이유 : 할로젠에 존재하는 비공유 전자쌍의 공명효과로 인해 o 또는 p 이성질체가 주생성물로 얻어짐
○ R기와 할로젠기가 경합하는 경우 할로젠기에 대한 o 또는 p 이성질체가 주생성물로 얻어짐
○ 이유 : 할로젠기가 EDG로 간주되는 조건에서는 R기보다 전자제공 유발효과가 좋음
② 강한/보통 활성감소 치환기 : meta 치환
○ 반응물인 벤젠으로부터 전자를 뺐는 효과가 있어 반응물이 안정
○ 중간체의 경우 카보양이온으로부터 전자를 뺐는 효과가 있어 중간체가 불안정
○ 활성화에너지가 크므로 반응이 늦게 일어남
⑷ 가장 활성도가 높은 그룹으로 주생성물이 생성
⑸ 친핵성 방향족 치환 반응(SNAr)
① 이탈기(예 : X-)와 EWG가 o, p-위치에 있는 경우 친핵체가 첨가된 후 이탈기가 제거되는 반응이 일어남
⑹ 방향족 헤테로고리 화합물의 판단
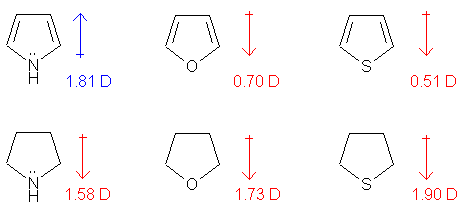
Figure. 45. 헤테로 고리화합물의 쌍극자 모멘트
○ pyrrole (왼쪽 위)만 주의해야 함 : pyrrole은 질소가 전자 주개로 작용함
② 아닐린의 니트로화
○ 단일 치환에 대하여 메타 치환과 파라 치환이 1 : 1의 비율
○ 이유 : 메타 치환이 많은 이유는 아닐린의 질소가 protonated 되면 EWG로 작용하기 때문
③ benzofuran은 2번 치환을 major product로 함 (예외)
8. 방향족 곁사슬 효과 [목차]
⑴ 요약 : 페닐기 옆의 탄소, 즉 벤질 탄소는 안정화됨
⑵ 첨가 반응의 특이성 : Markovnikov's rule 예외
⑶ SN2 치환반응의 특이성
① 벤젠 작용기가 친핵체가 접근한 전이상태를 안정화시켜 SN2 반응의 속도를 높임
○ SN2 반응속도 비교 : 1차 벤질 할로젠화 알킬 > 1차 할로젠화 알킬 > 2차 할로젠화 알킬 > 3차 할로젠화 알킬

Figure. 46. SN2 반응속도의 비교
② SN2 치환반응의 선택성
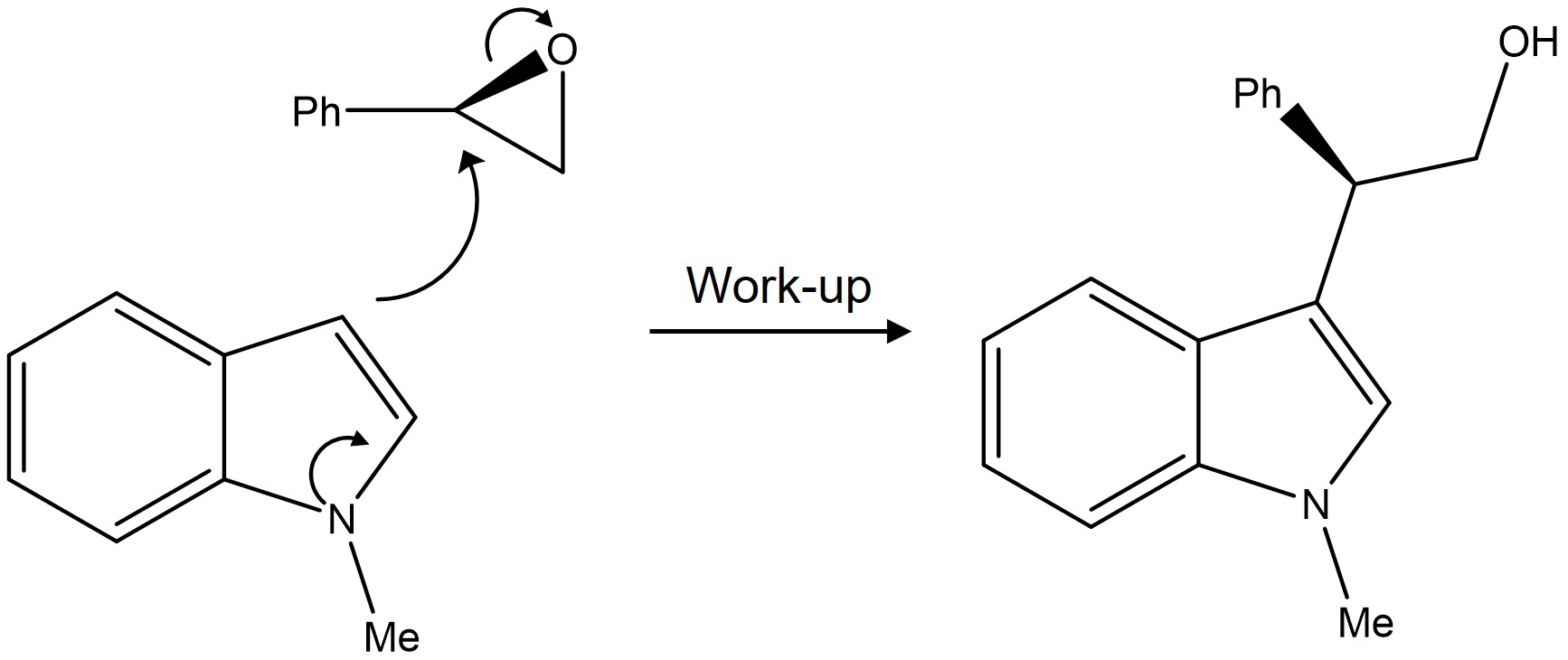
Figure. 47. Fridel-Craft alkylation에서 방향족 곁사슬에 의한 SN2 치환반응의 선택성
⑷ SN1 치환반응의 특이성
① 반응시약 : H2O
② 벤질(benzyl) 위치에 카보양이온이 있으면 공명 반응
③ 벤질 1차 할로젠화물은 SN1 반응을 할 수 있음
⑸ E2 제거반응의 특이성
① 반응시약 : NaOEt
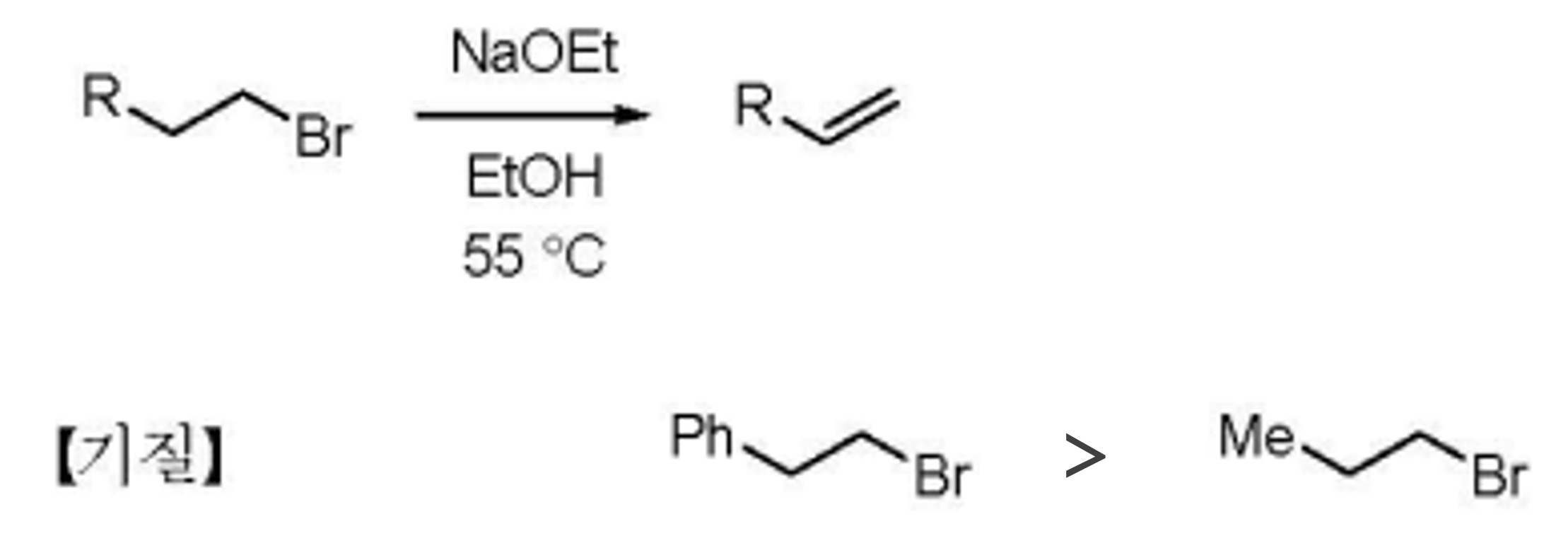
Figure. 48. E2 제거 반응 속도 비교
⑹ E1 제거반응의 특이성
① 반응시약 : POCl3, pyridine
⑺ 산염기 특이성
① 짝염기가 안정화될 수 있는 벤젠고리가 있는 산의 산도가 큼
② 예 : a의 경우 방향족 고리에 의해 짝염기가 안정화되어 산도가 커짐
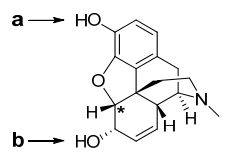
Figure. 49. 산염기 특이성 예제
⑻ 산화환원반응의 특이성
① 산화
○ 일반적으로 C-C 결합의 산화가 잘 안 됨
○ 반응시약 : KMnO4, K2Cr2O7
② 환원
○ 반응시약 : NaBH4, H2O
9. 제법 [목차]
⑴ 페놀 제법
① 실험적 합성 ver. 1
○ 단계 1. 벤젠 + HNO3 → 나이트로 벤젠 (촉매 : 황산)
○ 단계 2. 나이트로 벤젠 + H2 / Pt → 아닐린
○ 단계 3. 아닐린 + HNO2/H2SO4 → 디아조 벤젠
○ 단계 4. 디아조 벤젠 + H2O → 페놀
② 실험적 합성 ver. 2
○ 단계 1. Ph-NH2 + HONO → Ph-N2+
○ 단계 2. Sandmeyer reaction : Ph-N2+ + Cu2O, Cu(NO3)2, H2O
③ 공업적 합성
○ 클로로벤젠의 가수분해
○ 벤젠 설폰산의 가수분해
○ 큐민을 이용한 합성
⑵ Kolbe-Schmitt reaction : 해열제인 아스피린의 재료인 살리실산을 합성하는 반응
① 1단계. 페놀 → 살리실산
○ 소듐 양이온을 사용하면 전이상태 구조가 가능하여 ortho 생성물을 선택적으로 얻을 수 있음

Figure. 50. Kolbe-Schmitt reaction
② 2단계. 살리실산 → 아스피린
○ 살리실산 + 산 무수물 → 아스피린 : 권장되는 방법
○ 살리실산 + 에스테르 → 아스피린 : Fischer esterification
⑶ 크레졸 합성반응 : 페놀로부터 소독제로 쓰이는 크레졸(cresol)을 합성할 수 있음
⑷ Reimer-Tiemann 반응
① Ph-OH + 3 KOH + CHCl3 → 1-hydroxybenzaldehyde
② ortho 특이적인 phenol formylation에 의해 알데하이드인 salicylaldehyde를 형성
③ chloroform에 강한 염기를 처리할 경우 dichlorocarbene 형성과정을 거쳐 반응이 일어남 : 염기는 반응물
입력: 2019.01.13 12:23
수정: 2024.06.06 11:07
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 13강. 에터 (0) | 2019.01.04 |
|---|---|
| 【유기화학】 12강. 알코올 (11) | 2019.01.04 |
| 【유기화학】 10강. 콘쥬게이션 화학 (9) | 2019.01.04 |
| 【유기화학】 9강. 라디칼 반응 (11) | 2019.01.04 |
| 【유기화학】 1-1강. 루이스 구조식 (0) | 2018.12.27 |




최근댓글