9강. 라디칼 반응(radical reaction)
추천글 : 【유기화학】 유기화학 목차
1. 라디칼 [본문]
2. 라디칼 반응 개요 [본문]
3. 라디칼 치환 반응 [본문]
4. 라디칼 첨가 반응 [본문]
5. 라디칼 제거 반응 [본문]
6. 기타 라디칼 반응 [본문]
1. 라디칼 [목차]
⑴ 정의 : 홀전자를 보유하는 반응 중간체
⑵ 안정성
페닐 라디칼 < 비닐 라디칼 < 메틸 라디칼 < 1º 라디칼 < 2º 라디칼 < 3º 라디칼 ≪ 알릴 라디칼 < 벤질 라디칼
① 탄소의 차수가 높을수록 안정성이 높음 (∵ sp3 → sp2 전자제공 유발효과)
② 알릴 라디칼과 벤질 라디칼은 공명을 통해 라디칼이 비편재화되므로 안정
⑶ 생성
① 열(Δ) 또는 자외선(hν)에 의해 균일반응에 의해 생성
A-B → A· + ·B
② 라디칼 개시제(radical initiator) : O-O, X-X는 비공유 전자쌍의 반발로 결합력이 약해 라디칼을 생성할 수 있음
○ 예 : X2, benzoyl peroxide, ROOR, AIBN, Ph(CO2)2
⑷ 분자 궤도함수(MO)
2. 라디칼 반응 개요 [목차]
⑴ 개요
① 최외각 전자가 8개가 아니므로 전자가 결핍돼 있고 매우 반응성이 큼
② 일반적으로 전하를 가지지 않음
③ sp2 혼성
④ 탄소 양이온과 달리 자리옮김반응이 일어나지 않음
⑤ 전파 첫 번째 단계가 속도 결정 단계(rate determining step, r.d.s)
⑥ 라디칼 반응은 라디칼 치환 반응과 라디칼 첨가 반응으로 구별되며, 반응조건을 보고 구별하면 됨
⑵ 탄소라디칼의 자리옮김반응 여부
① 탄소양이온은 자리옮김반응이 일어나지만 탄소라디칼은 일어나지 않음
② 분자 궤도 함수에 의한 설명
○ 전제 : 결합 궤도 함수 A, 반결합 궤도 함수 B, C가 주어져 있음
○ 탄소양이온의 경우 2개의 전자가 A에 모두 채워짐
○ 탄소라디칼의 경우 2개의 전자가 A에 채워지고 나머지 한 개의 전자가 B 또는 C에 채워짐
○ 탄소양이온의 경우 1s 오비탈과 파이 결합의 위상이 동일 → 자리옮김반응이 가능
○ 탄소라디칼의 경우 1s 오비탈과 파이 결합의 위상이 다름 → 자리옮김반응이 불가능
⑶ 라디칼 치환 반응 조건
① 조건 1. X2 / hν or Δ
○ X2 자체가 라디칼 개시제이므로 별도의 ROOR를 사용하는 것은 낭비임
② 조건 2. NBS / hν or ROOR : NBS / Δ 조건은 Br· 생성반응 말고도 부적절한 반응이 일어날 수 있음
Figure. 1. NBS(N-bromosuccinimide)의 구조
③ 조건 3. NBS + HBr / hν or ROOR
○ NBS는 HBr와 반응하여 Br2를 생성
○ 이 조건에서 Br2가 낮은 농도로 유지
Figure. 2. NBS와 HBr의 반응
○ NBS의 N-Br 결합이 N· + ·Br 결합으로 쪼개져서 라디칼을 직접 제공하기도 함
○ NBS는 보통 CCl4 용액 조건에서 반응시킴 : NBS는 고체 상태로 존재
⑷ 라디칼 첨가 반응 조건
① 조건 1. HBr / hν, Δ, or ROOR
② (팁) HBr이 단독으로 반응물이면 라디칼 첨가 반응, 반응물이 아니면 라디칼 치환 반응
③ NBS 또한 라디칼 첨가 반응에 이용되는 경우도 있음
3. 라디칼 치환 반응(radical substitution reaction) [목차]
⑴ 메커니즘
① 전체 반응
Figure. 3. 라디칼 치환 반응 개괄
② 개시단계(initiation reaction)
Figure. 4. 개시단계
③ 전파단계(propagation reaction)
○ 반응 1. X·이 sp3 탄소와 반응하는 단계로 속도결정단계
Figure. 5. 전파단계 1
○ 반응 2.
Figure. 6. 전파단계 2
④ 종결단계(termination reaction)
○ 반응 1.
Cl· + ·Cl → Cl2
○ 반응 2.
CH3CH2· + ·CH2CH3 → CH3CH2-CH2CH3
○ 반응 3.
CH3CH2· + ·Cl → CH3CH2Cl
⑵ 위치 선택성
① 개요 : 차수가 높은 수소는 반응 메커니즘상 라디칼이 안정하므로 더 잘 치환될 수 있음
② 대표 반응식
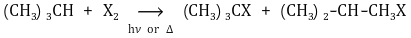
Figure. 7. 전체 반응식
③ F2 : 반응성이 매우 크고 다중 할로겐화 반응이 일어남
④ Cl2 : 반응성이 높음
○ 생성물 : (CH3)3C-Cl (37%) + (CH3)2-CH-CH2Cl (63%)
○ 반응성이 높아 아무 반응이나 막 일어나는 편
○ 탄소 라디칼 중간체 생성단계가 발열 (∵ Cl2가 비공유전자쌍 간 반발력으로 에너지가 높음)
○ 생성물 비
3º 수소 치환 : 1º 수소 치환 = 37 : 63
○ 개수 비
3º 수소 : 1º 수소 = 1 : 9
○ 반응성 비
3º 수소 치환 : 1º 수소 치환 = 37 (= 37 ÷ 1) : 7 (= 63 ÷ 9)
⑤ Br2 : 선택성이 높음
○ 생성물 : (CH3)3C-Br (99%) + (CH3)2-CH-CH2Br (1%)
○ 탄소 라디칼 중간체 생성단계가 흡열 : 활성화에너지가 높으므로 선택성이 높음
⑥ I2 : 선택성이 매우 높지만 수소 라디칼을 떼어내지 못할 정도로 반응성이 낮음
⑦ 알킬 차수별 F, Cl, Br 라디칼의 반응성
| F· | Cl· | Br· | |
| 메틸 | 1 | 1 | 1 |
| 1º | 2 | 250 | 500 |
| 2º | 2.5 | 1,100 | 40,000 |
| 3º | 3 | 1,800 | 850,000 |
Table. 1. 알킬 차수별 F, Cl, Br 라디칼의 반응성
⑧ 과량의 할로젠 : 다중 치환 할로젠화 알케인의 비율을 높여 단일 치환 할로젠의 수득률이 떨어짐
⑨ 온도 상승 : 역반응도 활발히 일어나 생성물이 조정되므로 열역학적으로 안정한 생성물이 주생성물이 됨
⑩ 응용 1. butane의 chlorination
○ 생성물 비
1-chlorobutane : 2-chlorobutane = 30 : 70
○ 개수 비
primary hydrogen : secondary hydrogen = 6 : 4
○ 반응성 비
primary hydrogen : secondary hydrogen = 30/6 : 70/4 = 1 : 3.5
⑶ 알릴자리 라디칼 치환 반응
① 알릴자리 라디칼이 훨씬 안정하므로 치환 반응이 일어난다면 알릴 자리에 라디칼이 생성
② 조건 1. X2 / hν or Δ
○ 알켄의 할로젠 첨가반응과 알릴 자리 라디칼 치환 반응이 경합
○ 고온, 저농도, 비극성 용매에서 알릴 자리 라디칼 치환 반응이 잘 일어남
○ 요인 1. 고온 : 첨가반응은 ΔS < 0이므로 ΔG = ΔH - TΔS에서 온도상승에 따라 ΔG가 증가함
○ 요인 2. 저농도 : 저농도 할로젠 하 첨가반응에서 halonium 이온 형성 후 halide가 후면공격할 확률이 적음
○ 요인 3. 비극성 용매 : 용매가 halonium 이온을 안정화시키지 못하면 첨가반응 속도가 늦춰짐
③ 조건 2. NBS / hν or ROOR : 알릴자리 라디칼 치환 반응시 가장 일반적으로 채택
④ 조건 3. NBS + HBr / hν or ROOR
○ 조건 1처럼 알켄의 할로젠 첨가반응과 알릴 자리 라디칼 치환 반응이 경합
○ 하지만 NBS + HBr에서 Br2가 낮은 농도로 유지되므로 라디칼 치환 반응이 훨씬 우세
⑷ 벤질자리 라디칼 치환 반응
① 벤질자리 라디칼이 훨씬 안정하므로 치환 반응이 일어난다면 벤질 자리에 라디칼이 생성
② 조건 1. X2 / hν or Δ : 가능
③ 조건 2. NBS / hν or ROOR : 가능
④ 조건 3. NBS + HBr / hν or ROOR : 가능
4. 라디칼 첨가 반응(radical addition reaction) [목차]
⑴ 알켄의 라디칼 첨가 반응
① 전체 반응
Figure. 8. 라디칼 첨가 반응 개괄
② 개시단계(initiation reaction)
Figure. 9. 개시단계
③ 전파단계(propagation reaction)
○ 반응 1.
Figure. 10. 전파단계 1
○ 반응 2.
Figure. 11. 전파단계 2
④ 종결단계(termination reaction)
○ 반응 1.
X· + X· → X2
⑵ 알카인의 라디칼 첨가 반응
① 반응식
Figure. 12. 알카인의 라디칼 첨가 반응
② 위 반응에서는 Br기가 라디칼 탄소와 공명할 수 있으므로 메틸기보다 더 좋은 EDG임
○ 방향족 친전자성 첨가반응(EAS)에서는 할로젠기가 EWG로 분류되지만 말 그대로 반응에 따라 다름
① 촉매량 라디칼 개시제 (benzoyl peroxide 등) 또는 산·염기 촉매 하에 반응 진행
5. 라디칼 제거 반응 [목차]
⑴ 프레온 가스(CFC)에 의한 오존층 파괴
Figure. 13. 프레온 가스에 의한 오존층 파괴 반응
⑵ 라디칼 억제제 (항산화제)
① 종류 : 비타민 E, BHT(butylated hydroxy toluene)
② (주석) 라디칼과 대신 반응하는 물질인 듯
6. 기타 라디칼 반응 [목차]
⑴ Cumene process
① O2가 두 개의 O· 라디칼로 찢어져서 각각이 OH기를 형성하여 반응하는 것
② 토토머화도 일어날 수 있음
⑵ McLafferty rearrangement
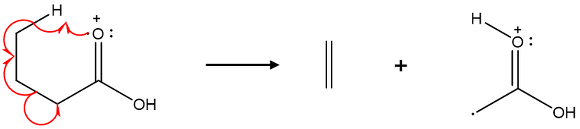
Figure. 14. McLafferty rearrangement
① 특징 1. hydrogen radical이 이동
② 특징 2. 6각 고리 전이상태
③ 특징 3. 중성인 알켄과 라디칼 양이온으로 분해
입력 : 2019.03.08 23:44
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 11강. 방향족 화합물 (31) | 2019.01.04 |
|---|---|
| 【유기화학】 10강. 콘쥬게이션 화학 (9) | 2019.01.04 |
| 【유기화학】 1-1강. 루이스 구조식 (0) | 2018.12.27 |
| 【유기화학】 8강. 알켄 및 알카인 (59) | 2018.12.27 |
| 【유기화학】 7강. 할로젠화 알킬 (19) | 2018.12.27 |
















최근댓글