12강. 알코올(alcohol)
추천글 : 【유기화학】 유기화학 목차
⑴ IUPAC 명명법과 관용명이 있음
⑵ 알코올(R-O-H) 명명법
① 알코올을 포함하는 가장 긴 사슬(고리) 구조를 모체로 결정
② 탄소사슬에서 -OH기에 가장 가까운 말단에서부터 각 탄소에 번호를 매김
③ 치환기가 존재하는 경우 알파벳 순으로 명명
④ 알킬, 할로, 알켄, 알카인 등이 혼재된 경우, 작용기의 우선순위는 다음과 같음
-OH > 알켄 > 알카인(알켄과 숫자가 동일한 경우) > 할로젠
⑤ 관용명 예시
○ propyl alcohol
○ butyl alcohol
○ sec-butyl alcohol
○ tert-butyl alcohol
○ isobutyl alcohol
○ neopentyl alcohol
⑶ 폴리올(polyol) : 2개 이상의 알코올
① 주사슬 이름 끝에 -diol, -triol 등의 접미사를 붙여 명명한다.
② 1개라도 더 적은 번호를 갖도록 번호를 부여하고, 알파벳 순으로 명명한다.
③ 관용명 : ethylene glycol (= ethane-1,2-diol), glycerol (= propane-1,2,3-triol)
2. 물리적 성질 [목차]
⑴ 알코올의 차수
① 정의 : -OH기가 붙어 있는 탄소의 차수
② 알코올의 차수↑ → 물에 대한 용해도↓
③ 알코올의 차수↑ → 분자 간 인력이 방해됨 → 녹는점 및 끓는점 감소
○ 끓는점 : 1-butanol (117 ℃) > 2-methyl-1-propanol (107 ℃) > 2-butanol (98 ℃) > 2-methyl-2-propanol (82 ℃)
○ 녹는점 : 1-butanol (-90 ℃) > 2-methyl-1-propanol (-108 ℃) > 2-butanol (-115 ℃)
○ 녹는점은 끓는점과 달리 분자 간 인력뿐만 아니라 쌓임성도 중요하므로 2-methyl-2-propanol의 녹는점(25 ℃)이 꽤 높음
⑵ 알코올의 끓는점
① 탄소의 개수가 많을수록 분자 간 인력이 증가하므로 끓는점이 높아짐
○ 예 : methanol (65 ℃) < ethanol (78 ℃) < propan-1-ol (97 ℃)
② 수소결합으로 인해 알켄, 알케인, 알카인보다 훨씬 끓는점 높음
③ 1,3-diol이 1,2-diol보다 끓는점이 높음
○ 이유 : 분자내 수소결합이 잘 형성되는 1,2-diol은 분자간 수소 결합이 상대적으로 약함
⑶ 알코올의 산도
① 용액상태에서 알코올의 산도 : methyl > 1차 > 2차 > 3차
○ 메탄올(MeOH) : 15.5
○ 에탄올(EtOH) : 16
○ i-PrOH : 16.5
○ t-BuOH : 18
○ 용매화 효과(solvation effect)
○ 알킬기가 많은 알코올일수록 수소결합에 의한 용매화효과가 떨어짐
○ 그 결과 짝염기인 알콕사이드가 덜 안정화되므로 산도가 낮음
○ 유발효과
○ 유발효과로 용매상태의 산도를 설명할 수 있으나 기체상태의 산도를 설명할 수 없음
② 기체상태에서의 알코올의 산도 : methyl < 1차 < 2차 < 3차
○ 기체 상태에서는 용매화 효과가 없음
○ 알킬기가 음전하를 분산시키는 효과가 커 3차 알코올의 산도가 가장 큼
○ 일반적으로 싸이올(thiol)의 산도가 알코올의 산도보다 큼 : 편극성, 즉 크기 효과 때문
⑷ 알코올의 수소결합 세기
① 수소결합 세기 : 1차 > 2차 > 3차
② 입체장애 : 1차 < 2차 < 3차
3. 반응 [목차]
⑴ 개요
① 반응의 핵심 : OH-가 강염기이고 나쁜 이탈기이므로 좋은 이탈기로 만드는 과정이 있음
② 종류 1. 탈수반응 (필수암기) : SN2 반응은 1차 또는 2차 알코올. 비 SN2 반응은 2차 또는 3차 알코올
○ SOCl2 그룹 : SN2 반응
○ HCl 그룹 : SN1 반응
○ POCl3 (촉매 : 피리딘(pyridine)) 그룹 : E2 반응
○ H2SO4 그룹 : E1 반응
③ 종류 2. 알코올 보호반응 및 알코올 탈보호반응
④ 종류 3. 산·염기 반응
⑤ 종류 4. 산화반응
⑥ 종류 5. 기타 반응 : 에터 합성, 에스터 합성, 피나콜 자리옮김 반응
⑵ 1-1. SN2 반응
① 시약 : SOCl2, PBr3, PCl3, PCl5 + 1차 또는 2차 알코올
○ 1차 알코올, 2차 알코올 : X-는 약염기이므로 E2가 아니고 SN2 반응이 일어남
○ 반응성 : 2차 알코올 < 1차 알코올
○ 3차 알코올 : SN1/E1 반응이 일어나나 매우 느리므로 반응이 안 일어난다고 봄
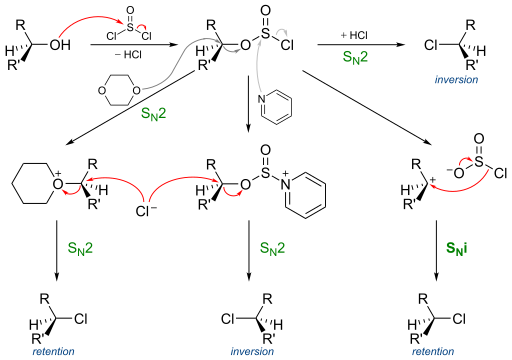
○ (참고) 용매에 따른 알코올과 SOCl2의 반응
○ 피리딘 용매 : 배위 반전
○ 에터 용매 : 배위 보존
○ 가설 1. 에터가 친핵체로 작용하는 경우 2번의 SN2 반응이 일어난다는 설명
○ 가설 2. SNi (SN internal ) : 분자 내 SN2 반응에 의하여 배위가 그대로 유지된다는 설명
② SOCl2 메커니즘
○ 알코올을 좋은 이탈기로 만듦
Figure. 1. SOCl2 존재 하 알코올의 SN2 반응
Figure. 2. SNi 반응
○ 특징
○ carbocation 없음
○ 자리옮김반응 없음
○ 1, 2차 알코올과 반응 : 3차 알코올과 반응하지 않음
○ 배위반전
○ 3차 아민은 염기로서 HCl과 반응으로 친핵체인 Cl-를 형성시켜 반응 촉진
○ 르샤틀리에 원리 : SOCl2 반응에서 피리딘을 쓰는 이유는 SO2(g)를 발생시켜 정반응을 촉진시키기 위함
○ 항상 SN2 반응만 하는 건 아님
○ 위 메커니즘은 알코올뿐만 아니라 카르복실산에서도 발생함
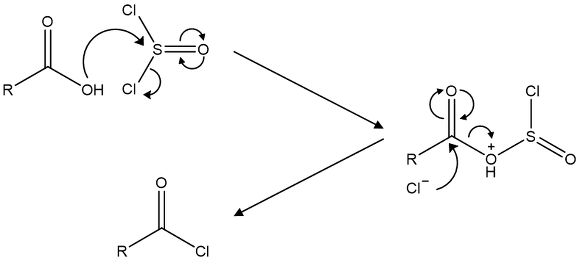
Figure. 3. 카르복실산으로부터 아실 클로라이드를 생성하는 반응
③ PBr3, PCl3 메커니즘
○ 알코올을 좋은 이탈기로 만듦
○ PBr3, PCl3 반응에서 반응속도를 높이기 위해 약염기인 피리딘을 쓸 수 있음
○ 시약 과다사용 규제로 인해 최근에는 피리딘을 사용하지 않음
Figure. 4. PX3 존재 하 알코올의 SN2 반응
○ 특징
○ carbocation 없음
○ 자리옮김반응 없음
○ 1당량의 PX3는 3당량의 알코올과 반응 가능
○ 1,2차 알코올과 반응 진행 : 3차 알코올과 반응하지 않음
○ 배위반전
④ PCl5 메커니즘
Figure. 5. PCl5 존재 하 알코올의 SN2 반응
⑶ 1-2. SN1 반응
① 시약 : HCl, HBr, HI + 2차 또는 3차 알코올
○ HCl은 반응이 상대적으로 약하여 ZnCl2와 같은 촉매를 사용하여 반응시킴
○ HF ≪ HCl < HBr < HI
○ 1차 알코올 : SN2 반응. X-가 이탈기(H3O+)가 떨어질 때까지 기다려주지 않고 친핵체 공격
○ 2차 알코올, 3차 알코올 : SN1 반응. HX는 매우 강산이므로 매우 좋은 이탈기인 -OH2+를 쉽게 생성
② 메커니즘
Figure. 6. HX 존재 하 알코올의 SN1 반응
③ 카보양이온 : 라세미화, 자리옮김반응
④ 루카스 시험(Lucas test) : HCl과 ZnCl2를 이용하여 1차, 2차, 3차 알코올을 구별하는 시험
○ 반응이 일어나는 용액이 흐릿해짐
○ 반응식 : ROH + HCl → RCl (촉매 : anhydrous ZnCl2, 조건 : 상온)
○ primary alcohol : 반응 없음 (SN2)
○ secondary alcohol : 5분쯤에 반응 (SN2 and SN1)
○ tertiary, allylic, or benzylic alcohol : 즉시 반응 (SN1)
⑷ 1-3. E2 반응
① 시약 : POCl3 + 2 eq. 피리딘 + 2차 또는 3차 알코올
○ 팁. E2 반응시약은 거의 POCl3만 사용
○ 1차 알코올
○ 2차 알코올, 3차 알코올 : E2 반응이 일어남
② 메커니즘
Figure. 7. POCl3 존재 하 알코올의 E2 반응
③ Zaitsev's rull
Figure. 8. POCl3 존재 하 알코올의 E2 반응
⑸ 1-4. E1 반응
① 시약 : H2SO4, H3PO4, TsOH 등의 비할로겐산 + 2차 또는 3차 알코올 + heat
○ 1차 알코올 : E2 반응 (E1도 가능)
○ 2차 알코올, 3차 알코올 : E1 반응
② 메커니즘
Figure. 9. H2SO4, H3PO4 존재 하 알코올의 E1 반응
③ (공식) H+를 O에 붙인 뒤 고리화반응을 검토. 고리화반응이 일어나지 않으면 H2O 이탈 후 Saytzev's rull 검토
④ 탄소양이온 : 자리옮김반응, 라세미화
⑤ 한 분자 내 알켄과 -OH기가 동시에 존재하는 경우 알켄이 먼저 반응함 (∵ 알켄의 반응성 ↑)
○ 보충하자면, -OH기의 산·염기 반응은 가장 빠르게 일어나지만 역반응이 일어나 minor product를 구성할 수 있음
○ 또한, -OH기가 반응을 진행하는 경우 나쁜 이탈기인 H2O가 이탈되는 반응에서 속도가 지연되는 측면도 있음
⑥ 1차 알코올은 동일한 시약 조건에서 E2 메커니즘에 의해 반응이 전개됨 (∵ primary carbocation인 불안정)
⑹ 2-1. 알코올 보호반응
① 개요
○ 좋은 이탈기화 반응이라고도 함
○ 알코올 보호반응은 Grignard 시약 제조 시 이용
○ 기본적으로 에터의 제법을 이용함
② 종류 1. 설폰산 에스터 보호기 : 알코올의 이탈기 유도체로서 더 많이 사용
○ 토실화(tosylation) : TsCl (촉매 : 피리딘) + 알코올인 경우 -OH기가 -OTs가 됨 (배위보존)
○ 반응식 : ROH + TsCl + 피리딘 → ROTs
○ TsCl : para-toluenesulfonyl chloride
○ 메커니즘
Figure. 10. TsCl에 의한 알코올 보호반응
○ 메실화(mesylation) : MsCl (촉매 : Et3N) + 알코올인 경우 -OH가 -OMs가 됨 (배위보존)
○ 반응식 : ROH + MsCl + 피리딘 → ROMs
○ MsCl : methanesulfonyl chloride
○ 메커니즘
Figure. 11. MsCl에 의한 알코올 보호반응
○ 트리플릴화(triflylation) : TfCl (촉매 : 피리딘) + 알코올인 경우 -OH가 -OTf가 됨 (배위보존)
○ 반응식 : ROH + TfCl + 피리딘 → ROTf
○ TfCl : trifluoromethanesulfonyl chloride
○ -OTf는 유기화학에서 등장하는 이탈기 중 가장 이탈을 잘 함
○ 심지어 SN1 반응으로 불안정한 vinyl cation을 형성할 수도 있음
○ 공통 특징
○ 배위보존 : 알코올이 공격하므로 자기 배위가 바뀌지 않음
○ 배위보존과 절대배열(R, S) 보존은 완전히 다름을 유의
○ 알코올이 친핵체 공격을 하는 SN2 반응 : 입체장애가 작은 1차 알코올이 우선적으로 반응
○ 염기로서 피리딘이나 Et3N가 사용
② 종류 2. 실릴 에터 보호기 : 실리콘 화합물(실릴 에터)로서 촉매로 Et3N를 보통 사용
○ 실리콘 화합물 : R'OSiR3로 표시
○ TMSCl : (CH3)3SiCl
○ TBDMSCl : tert-SiMe2Cl
○ 특징
○ 입체장애가 크지만 Si는 3주기로 C보다 긴 결합이 가능해 반응 진행
○ pH 4 ~ 12에서 안정
○ imidazole이나 pyridine은 알콕시 이온을 생성시키고, 부산물인 HCl을 제거시킴
③ 종류 3. t-뷰틸 에터 보호기
○ (공식) 1. H2SO4, 2. CH2=C(CH3)2 (isobutylene)
○ 에터에 묽은 산으로 처리 시 안정한 이탈기로 떨어져 나가므로 쉽게 제거 가능
⑺ 2-2. 알코올 탈보호 반응
① TBAF(tetrabutylammonium fluoride), 즉 Bu4NF를 통해 실릴 에터로부터 알코올 작용기를 복구할 수 있음
○ Si-O 결합 세기 : 약 110 kcal/mol
○ Si-F 결합 세기 : 약 140 kcal/mol
② 강산 조건을 통해 실릴 에터로부터 알코올 작용기를 복구할 수 있음
⑻ 3. 산 · 염기 반응
① 알코올의 경우 pKa 값이 16 ~ 18로 산으로 작용할 수 있음
② ΔpKa > 0이어야 정반응이 일어나며, ΔpKa > 7이어야 정반응이 일방적으로 일어남
③ 반응 예
Figure. 12. 산·염기 반응 예
⑼ 4. 산화반응
① 알코올의 산화단계
Figure. 13. 알코올의 산화단계
② 1차 알코올의 강한 산화반응 : 1차 알코올을 카르복실산으로 산화시키는 반응
○ 관련 시약
○ K2Cr2O7
○ H2CrO4
○ CrO3
○ KMnO4
○ KMnO4가 알코올 산화반응에서 자주 사용되지 않는 이유
○ 크로뮴 계열 산화제는 분자 내 알켄이나 알카인을 산화시키지 않고, 알코올만을 선택적으로 산화
○ 이는 KMnO4가 알코올 산화뿐만 아니라 알켄이나 알카인과도 반응함과 대비됨
○ Jones 시약 : CrO3의 조합, 즉 CrO3 + H2SO4 + H2O
○ 1차 알코올의 강한 산화반응을 수행함
○ mild한 조건에서 약한 산화반응까지만 도달하기도 함
③ 1차 알코올의 약한 산화반응 : 1차 알코올을 알데하이드로 산화시키는 반응
○ 관련 시약
○ PCC(pyridimium chlorochromate) : 무수 조건
○ DMP(Dess-Martin periodinane)
○ HOCl
○ NaOCl / CH3COOH / 0 ℃
○ Swern oxidation 시약
○ Collins 시약
○ Magtrieve 산화제 (CrO2)
○ TEMPO
○ Ag2CO3
○ (공식) 1차 알코올 + NaOCl + RCOOH (예 : acetic acid) + 0 ℃ → 알데하이드
○ NaClO(차아염소산나트륨, 락스) + RCOOH → HClO
○ 메커니즘 1. R-CH2-OH + HClO → R-CH2-OH2+ + OCl-
○ 메커니즘 2. R-CH2-OH2+ + OCl- → RCH2OCl + H2O (SN2 반응)
○ 메커니즘 3. RCH2OCl + :B- → RCHO + HB + Cl- (E2 반응)
○ (공식) 1차 알코올 + TsCl → R-OTs, R-OTs + DMSO → R-OSMe2, R-OSMe2 + NaHCO3 → RCHO
○ 알데하이드 제법에 활용
④ 2차 알코올의 산화반응
○ 관련 시약
○ K2Cr2O7
○ Na2Cr2O7
○ H2CrO4
○ CrO3
○ KMnO4
○ PCC
○ Dess-Martin periodinane
○ DMSO / oxalyl chloride
○ CrO3의 2차 알코올 산화반응 메커니즘
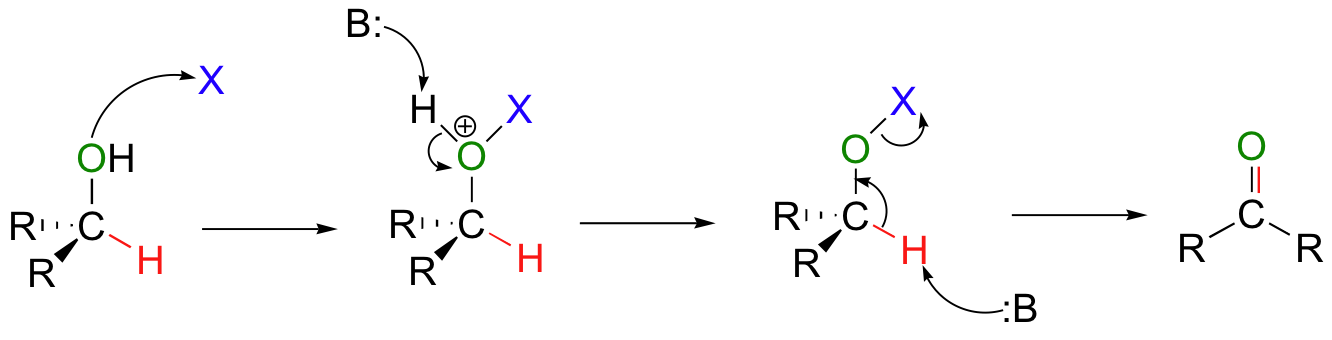
Figure. 14. CrO3의 2차 알코올 산화반응 메커니즘
○ HOCl의 산화반응 메커니즘
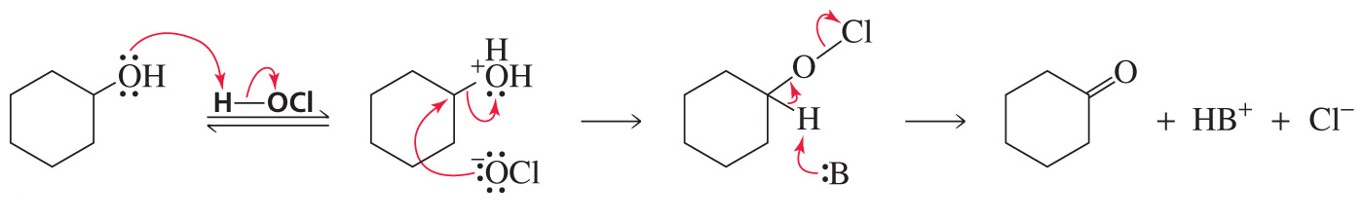
Figure. 15. HOCl의 산화반응 메커니즘
○ NaOCl의 산화반응 : 2차 알코올 + NaOCl + RCOOH (예 : acetic acid) + 0 ℃ → 케톤
○ cyclohexyl alcohol의 산화 반응 : H2CrO4를 기준으로,
○ -OH기가 axial 방향으로 있을 때 산화 반응이 더 빠름
○ 이유 1. -OH기가 axial에 있으므로 수소는 equatorial 배향으로 있는데, equatorial 배향으로 있는 수소를 떼기 위해 염기가 접근하는 게 더 쉬움
○ 이유 2. 크롬산 에스터가 axial로 배향 시 반응물이 더 불안정하여 활성화에너지가 더 작아지기 때문
⑤ 3차 알코올의 산화반응 : 일반적으로 산화반응이 일어나지 않음
○ 반례 : Clemmensen 환원
⑥ 알릴, 벤질 알코올의 선택적 산화제 : MnO2
○ 보통의 알코올은 산화되지 않음
⑦ 다이올(diol)의 산화성 분해 반응
○ 반응시약 : HIO4
○ (공식) 다이올이 있을 때 탄소-탄소 결합을 끊은 뒤 각각 -OH기를 연결, 케톤이나 알데히드기 생성
Figure. 16. 다이올의 산화성 분해반응 공식
○ 메커니즘
○ 공통 : 5각형 전이체를 경유함
○ 경우 1. metaperiodic acid 조건
○ 경우 2. orthoperiodic acid 조건
⑽ 5-1. 에터 합성
① 대칭 에터 합성
○ 요약 : 고온에서는 제거반응이, 저온에서는 첨가반응이 우세. 엔트로피 변화 및 ΔG = ΔH - TΔS로 설명 가능
○ (not desirable) H2SO4, 180℃ : R-CH2OH + H2SO4 → R=CH2. 알코올의 E1 제거반응
○ (desirable) H2SO4, 140℃ : R-CH2OH + H2SO4 → R-CH2-O-CH2-R
○ 단점 : 대칭 에터 합성법은 다양한 에터(즉, ROR, R'OR, R'OR')가 생성되므로 부적절
○ 예외적으로 3차 알코올을 한 성분으로 사용하면 성공적으로 비대칭 에터를 합성 (∵ SN1 반응)
② Williamson-ether 합성법 : 비대칭 에터 합성법
○ 1단계. ROH + NaH → RO-Na+ + H2
○ 2단계. RO- + R'I → ROR' + I- (SN2) : R'의 입체배열은 반전됨
○ 한계 : R'X가 메틸 할라이드나 1차 할로젠화 알킬이 아닌 경우 제거반응이 우세하여 부적절
○ 알켄의 옥시수은화-탈수은화와 동일한 반응
○ 시약 : 1. Hg(O2CCF3)2, HOCH(CH3)2, 2. NaBH4, HO-
○ Williamson-ether 합성법이 불가한 경우 유용
⑾ 5-2. 에스터 합성
① 아실 클로라이드, 산 무수물과 알코올의 반응으로 에스터 합성
② 카르복실산과 산 촉매 반응에 의한 에스터 합성(Fischer esterification)
⑿ 5-3. 피나콜 자리옮김 반응
① 피나콜 자리옮김반응(pinacol rearrangement) : 분자내 SN2 반응으로 배위반전 고려
Figure. 17. 피나콜 자리옮김반응 메커니즘
② 세미-피나콜 자리옮김반응(semi-pinacol rearrangement)
○ 유형 1. 분자내 SN2 반응으로 배위반전 고려
Figure. 18. 세미-피나콜 자리옮김반응 유형 1
○ 유형 2. 탄소양이온이 형성되므로 라세미 혼합물
Figure. 19. 세미-피나콜 자리옮김반응 유형 2
○ 유형 3. 분자내 SN2 반응으로 인한 배위반전 고려
Figure. 20. 세미-피나콜 자리옮김반응 유형 3
4. 제법 [목차]
⑵ 알켄, 알카인
⑤ 알카인 : 수화반응 결과 enol이 생성되어 토토머화로 ketone으로 변하기 때문에 알코올 생성 불가
⑷ 산화환원반응
① NaBH4 : 약한 환원제
○ 카르복실산을 알코올로 환원할 수 없음
○ 알데하이드를 1차 알코올로 환원
○ 케톤을 2차 알코올로 환원
○ 장시간 반응시키면 알코올을 H로 환원할 수 있음
② LiAlH4 : 강한 환원제
○ 카르복실산을 1차 알코올로 환원
○ 케톤을 2차 알코올로 환원
○ 장시간 반응시키면 알코올을 H로 환원할 수 있음
○ 시약으로 사용되는 LiAlH4는 NaBH4보다 훨씬 강한 환원제
③ (공식) NaBH4와 LiAlH4는 환원제로 H-를 제공하는 것으로 간주
Figure. 21. LiAlH4에 의한 알코올 제법 예
○ H2O는 H+ 공급원으로 다른 산으로 대체 가능
○ 카르복실산 해석 : -COOH는 일시적으로 -C+O-OH가 되어 H-가 C+에 붙으면 -CHO-OH가 된 뒤 -CHO가 됨
○ 알데하이드 해석 : -CHO는 일시적으로 -C+O-OH가 되어 H-가 C+에 붙으면 -CH2O-가 됨
○ 케톤 해석 : -CO-는 일시적으로 -C+O--가 되어 H-가 C+에 붙으면 -CHO--가 됨
○ 알코올 : 알코올도 환원될 수 있음, -COH는 -C+가 된 뒤 H-가 C+에 붙어 -CH가 됨
⑸ 탄소-탄소 짝지음 반응 (유기금속시약 반응)
① 그리냐르 시약(Grignard reagent) : RMgX
○ (공식) RMgX에서 Mg가 δ+가 되어 R은 강한 음하전을 띰. 친전자체 탄소를 찾아 R부터 연결하고 생각
Figure. 22. 에스테르의 Grignard 시약 반응 예
○ 그리냐르 시약은 카르복실산과 반응하지 않음
② 알킬리튬 시약(alkyl lithium reagent) : RLi
○ (공식) RLi에서 Li가 δ+가 되어 R은 강한 음하전을 띰, 친전자체 탄소를 찾아 R부터 연결
③ 길만 시약(Gilman reagent) : R2CuLi
○ (공식) R2CuLi에서 CuLi가 δ+가 되어 R은 강한 음하전을 띰, 친전자체 탄소를 찾아 R 1개만 연결
입력: 2019.01.11 15:11
수정: 2022.02.01 21:57
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 14강. 에폭사이드 (2) | 2019.01.04 |
|---|---|
| 【유기화학】 13강. 에터 (0) | 2019.01.04 |
| 【유기화학】 11강. 방향족 화합물 (31) | 2019.01.04 |
| 【유기화학】 10강. 콘쥬게이션 화학 (9) | 2019.01.04 |
| 【유기화학】 9강. 라디칼 반응 (11) | 2019.01.04 |
























최근댓글