3강. 세포와 물질대사(영양생물학)
추천글 : 【생물학】 생물학 목차
d. 영양과 조리
1. 영양소 [목차]
⑴ 영양소의 분류
① 영양소 : 식품의 성분 중 체내에서 영양적인 작용을 하는 유효 성분
○ 필수영양소 : 직접 합성하지 못하는 물질
② 다량 영양소 vs 소량 영양소
○ 다량 영양소 : 다량 요구되는 물, 탄수화물, 단백질, 지방
○ 미량 영양소 : 미량 요구되는 비타민, 무기물
③ 3대 영양소 vs 부영양소
○ 3대 영양소 : 에너지원으로 사용되는 탄수화물, 단백질, 지방
○ 부영양소 : 에너지원으로 쓰이지는 않지만 우리 몸에 꼭 필요한 비타민, 무기염류, 물
⑵ 물
① 물의 역할
○ 용매
○ 화학반응 매개, 산염기 평형, 농도 평형
○ 세포 활동
○ 장기 보호 및 윤활유
○ 영양소 용해 및 운반
○ 노폐물 제거
○ 혈압 및 체온 유지
② 인체의 체액분포
○ 남자의 체내 수분함량 : 60%
○ 여자의 체내 수분함량 : 50 ~ 55%
○ 갓난아기의 체내 수분함량 : 75% 이상
Table. 1. 인체의 체액분포
③ 수분 손실 : 성인은 매일 약 3 L의 물을 필요로 함 (음식에서 1.5 L, 음료로 1.5 L)
Table. 2. 수분손실의 증상
⑶ 탄수화물
① 세포의 주요 에너지원
○ 4 kcal/g. 에너지는 화학결합에 저장
② 흡수속도 : 단당류 > 이당류 > 다당류
③ 전분(녹말) : 식물의 포도당 중합체
④ 글리코겐 : 동물의 포도당 중합체
○ 탄수화물을 간과 근육에 글리코겐 형태로 저장
○ 하루 만에 소진되는 에너지원
⑤ 식이섬유 (셀룰로오스 등)
○ 대장의 소화폐기물 청소 : 식이섬유는 소화되지 않음
○ 소화폐기물 : 세균, 독성 물질, 기생충 등
○ 소장의 콜레스테롤 흡수 ↑, 암 위험 ↓
○ 지구상에서 가장 풍부한 탄수화물
⑥ 검출시약
○ 녹말 : 아이오딘-아이오딘화 칼륨 수용액, 요오드 반응, 보라색
○ 포도당, 과당, 엿당 등 : 베네딕트 반응 (황적색, 가열 필요)
⑷ 단백질
① 세포의 주요 에너지원, 세포의 주요 구성요소
○ 4 kcal/g, 에너지는 화학결합에 저장 (최후 보루의 에너지원)
② 20종 아미노산의 중합체, 아미노산은 펩티드 결합으로 연결
③ 필수 아미노산
○ 음식으로 섭취해야 할 아미노산. 어른 8종과 어린이 +2종
○ 발린, 류신, 이소류신, 메티오닌, 트레오닌, 리신, 페닐알라닌, 트립토판, 히스티딘, 아르기닌
○ 동물성 단백질 : 필수 아미노산이 모두 포함 vs 식물성 단백질 : 필수 아미노산이 모두 포함된 경우가 거의 없음
○ 아미노산은 친수성이므로 저장되지 않으며 매일 공급되어야 함
④ 완전단백질
○ 모든 필수 아미노산을 포함한 단백질 : 육류, 달걀
○ 식물 단백질 : 완전 단백질이 아님, 채식만 하는 경우 다양한 식재료의 배합이 필요
⑤ 제한단백질
○ 하나라도 필수 아미노산을 포함하지 않은 단백질
⑥ 검출시약 : 뷰렛반응 (보라색)
⑸ 지방
① 주요 저장 에너지 분자, 중요 기관의 보호, 보온, 기근 대비
○ 9 kcal/g. 에너지는 화학결합에 저장
○ 사용하고 남은 탄수화물은 지방으로 저장
② 글리세롤 + 지방산(탄화수소) 꼬리
③ 지방산
○ 단쇄지방산(SCT) : 탄소수 6개 이하
○ 중쇄지방산(MCT) : 탄소수 8 ~ 10개
○ 장쇄지방산(LCT) : 탄소수 12개 이상
○ 지방산은 아세틸-CoA (C2)로 합성하므로 짝수 개의 탄소수를 가짐
④ 필수 지방산 : 체내에서 합성하지 못하는 불포화 지방산
○ 리놀레산, 리놀렌산 : 다중불포화 지방산으로 옥수수 및 홍화 씨 기름에 함유. 세포막에 존재하는 인지질 생성
○ 아라키돈산(archidonic acid) : 프로스타글란딘 등의 중요 신호물질의 전구체
○ 오메가-3, 오메가-6 : 한류 어류(예 : 연어, 정어리) 및 아마종자 기름의 불포화 지방산 → 심장 보호 기능
⑤ 트랜스 지방 (전이지방)
○ cis-불포화지방산에 수소첨가하여 포화지방산을 만들 때 trans-불포화지방산 또는 트랜스지방이 만들어짐
○ 예 : 쇼트닝, 마가린
○ 심장병 및 당뇨병의 위험 증가
○ WHO 권장량 : 섭취하는 열량 중에서 트랜스 지방의 비율이 1% 미만
⑥ 검출시약 : 수단 Ⅲ (선홍색)
⑹ 비타민
① 기능 : 일반적으로 효소의 기능에 요구되는 조효소 작용하여 물질대사, 생리기능을 조절
② 프로비타민 : 아직 활성을 갖기 전의 비타민
○ 예 : 베타 카로틴, 에르고칼시페롤
③ 수용성 비타민 (B, C)
○ 개요
○ 조리 과정에서 유실, 신선한 채소로 섭취, 저장되지 못하므로 결핍 가능성
○ 식품 형태 : 압축된 정제로 포장된 보충제
○ 혈액, 조직액 등의 체액에 녹아 분포
○ 오줌으로 배출되므로 결핍증을 일으키기 쉬움
○ 리보플라빈(비타민 B2) : FAD, FMN
○ 나이아신(비타민 B3) : NAD+, NADP
○ 비오틴(비타민 B7) : 조효소에 존재
○ 엽산(비타민 B9) : folate라고도 함
○ 기능 : 퓨린 뉴클레오티드 생합성에 필요, 적혈구의 재료, 세포분열에 필요한 아미노산의 재료
○ 음식에서 흡수된 엽산은 엽산 대사 경로로 들어가 tetrahydrofolate로 환원됨
○ tetrahydrofolate는 퓨린 생합성 과정에서 단순 원자를 제공
○ methotrexate : 항엽산제. DHFR(dihydrofolate reductase)을 억제함
○ 코발라민(비타민 B12)
○ 핵산 합성, 적혈구의 재료
○ 결핍증 : 악성 빈혈
○ Co 이온과 함께 작용
○ 호모시스테인(homocystein)을 시스테인(cystein)으로 전환
○ 동물성 단백질에 포함돼 있음
○ 비타민 C
○ 기능 1. 콜라겐 합성
○ 1st. 비타민 C가 prolyl hydroxylase의 조효소로 작용
○ 2nd. prolyl hydroxylase는 콜라겐 내에 상당한 양이 있는 prolin을 hydro-prolin으로 만듦
○ 3rd. hydro-prolin은 강한 결합력이 생겨 ECM에서 다양한 결합기능을 수행
○ 기능 2. 장의 철 흡수를 증가
○ 위장에서 Fe3+을 Fe2+으로 환원시키면 비타민 C와 결합하여 철분이 흡수가 촉진됨
○ 결핍증 : 괴혈병
④ 지용성 비타민 (A, D, E, K)
○ 개요
○ 지용성 비타민은 쉽게 방출되지 않으므로 과잉증이 나타날 수 있음
○ 비타민 A, D를 포함한 대부분의 지용성 비타민은 간에서 저장
○ 식품 형태 : 기름 젤 캡슐로 포장된 보충제
○ 세포막 조직과 같은 구조에 분포
○ 소변으로 배설되지 않고 담즙으로 배설
○ 비타민 A
○ 1912년 홉킨스 박사가 우유 중에 동물 성장 인자가 있음을 알게 되면서 최초로 발견
○ 간상세포에 함유된 색소 단백질인 로돕신의 구성 성분
○ 종류 1. 레티놀 : 동물의 간, 우유, 전지 분유, 버터, 난황, 대구, 간유 등 동물성 식품에 포함
○ 종류 2. 카로티노이드 : 식물성 식품에 포함된 주황색 색소
○ 체내에서 비타민 A로 바뀜
○ 카로티노이드 중 가장 활성이 높은 것은 베타-카로틴 : 당근, 시금치과 같은 녹색 채소 및 해조류에 많음
○ 결핍증 1. 야맹증 : 사람들은 밝은 광선 속에서 어두운 곳에 들어갔을 때 시각이 둔해지는 증세
○ 결핍증 2. 안구건조증
○ 비타민 D (칼시페놀) : 신체가 합성할 수 있는 유일한 비타민
○ 1st. 피부 : 7-dehydroxycholesterol이 자외선을 받아 콜레칼시페롤(vitamin D3)이 됨
○ 2nd. 간 : 콜레칼시페롤은 25-hydroxylase에 의해 25-OH vitamin D3가 됨
○ 3rd. 신장 : 25-OH vitamin D3는 1α-hydroxylase에 의해 칼시트리올(1,25-(OH)2 vitamin D3)이 됨
○ 4th. 소장 : 칼시트리올은 활성 비타민 D로서 칼슘 펌프를 활성화하여 칼슘 흡수를 촉진함
○ 결핍증 : 구루병
○ 비타민 E : 알파-토코페롤·토코트리에놀. 지방 항산화제. 불임 예방
○ 결핍증 : 노화
○ 비타민 K : 혈액응고 단백질 활성화
○ 혈액응고 과정에서 프로트롬빈의 글루탐산 잔기를 카르복실화함
○ 결핍증 : 혈액응고의 지연
⑤ 비타민의 종류
Table. 3. 비타민의 종류
⑺ 무기물 : 미네랄(mineral), 광물질이라고도 함
① 개요
○ 정의 : 생물체를 구성하는 원소 중 탄소, 수소, 산소 등 3원소를 제외한 생물체의 구성 요소
○ 구성 : 사람 몸의 구성 성분 중 약 4%를 차지
○ 기능 : 신체 성장, 신체 유지, 생식에 관여
② 무기이온의 주요 기능
○ 나트륨 (Na)
○ 세포 외액의 삼투압 요소
○ 활동전위 유발
○ 권장섭취량 : 7 g
○ 한국인 평균섭취량 : 15 ~ 30 g
○ 과다증 : 고혈압 (혈관이 수축되고 호르몬을 변화시키므로)
○ 과다증 : 체액의 삼투압이 높아져서 세포에서 수분이 빠져나가 세포 내 산도가 증가하므로 단백질 구성이 무너짐
○ 과다증 : 소금의 과잉 섭취는 소화관을 자극하여 영양소의 흡수를 방해
○ 마그네슘 (Mg)
○ 분자생물학 및 중합효소는 무조건 Mg2+라고 할 수 있을 정도로 Mg2+가 중요하게 기여함
○ ATPase
○ DNA 중합효소
○ RNA 중합효소 : Mg2+ 두 개를 가져서 하나는 앞선 3'-OH의 O를 잡아주고, 다른 하나는 dNTP를 잡아줌
○ ribozyme : 기능을 하려면 Mg2+와 단백질 도움이 필요함
○ 인 (P)
○ 인지질, 핵산 구성
○ 인산의 경우 탄산과 함께 수소 이온의 완충용액으로 기능
○ 뼈와 치아의 구성성분 : 인의 대부분은 인산칼슘의 형태로 뼈와 치아에 있음
○ 모든 자연 식품에 널리 분포하며 특히 우유, 유제품, 육류 등의 동물성 식품에 많음
○ 현미에도 인이 많으나 대부분 피틴산의 형태로 존재 : 피틴산은 인의 흡수를 방해하는 물질
○ 인을 너무 많이 섭취하면 칼슘 흡수가 저해됨
○ 염소 (Cl)
○ 삼투압 조절에 관여 : 무기 양이온에 대응 이온
○ 위액 위에 염산으로 존재 : 위액의 산도를 유지, 세균 발효 방지, 소화 촉진
○ 과다증 : 고혈압
○ 칼륨 (K)
○ 세포 내액의 삼투압 요소
○ 산염기 평형 : 저칼륨 혈증의 경우 H+ 감소
○ 소변을 만들어내는 요소 대사에 필요
○ 칼륨을 많이 섭취하면 소변 배설 : 신장은 나트륨만큼 칼륨을 저장하지 못함
○ 전기생리학에 관여 : 막의 재분극 유발, 휴지전위 확립
○ 글리코겐 및 단백질 합성 관여
○ 과다증 : 근육 약화, 마비, 심장 마비
○ 칼슘 (Ca)
○ 외포작용 : 신경세포에서 신경전달물질의 분비와 관련
○ 혈액 응고 반응의 보결족
○ 골격근 수축, 심장근 수축
○ 세포 간 결합 : 데스모좀에서 카드헤린 안정화
○ 뼈와 치아의 구성성분 : 칼슘의 99%가 뼈와 치아에 분포
○ 2차 신호전달자
○ 칼슘 이온이 적을 때는 나트륨 통로가 많이 열림 : 과활성
○ 칼슘 이온이 많을 때는 나트륨 통로가 많이 닫힘 : 힘이 안 남
○ 중년 여성에게 칼슘이 많아 힘을 잘 못 냄
○ 결핍증 : 골다공증, 왜소증
○ 과다증 : 신장 결석
○ 망간 (Mn)
○ 철 (Fe)
○ 조혈작용 : 몸 안에서 철분의 절반 이상이 헤모글로빈의 구성성분
○ 산소운반 : 무기철염이 산소 흡수가 빠름. 2가 철염이 3가 철염보다 흡수가 좋으나 어느 쪽이든 10% 이내
○ 위장에서 Fe3+을 Fe2+으로 환원시키면 비타민 C와 결합하여 철분이 흡수가 촉진됨
○ 곡류의 껍질에 많은 피틴산과 시금치, 무청 등과 같은 물질은 철분과 결합하여 불용성 복합체 형성 → 철분 흡수 방해
○ 차, 커피에 많은 탄닌과 식이섬유질은 철분의 흡수 방해
○ 결핍증 : 빈혈
○ 코발트 (Co)
○ 구리 (Cu)
○ 아연 (Zn)
○ 성장, 상처 회복, 건강한 피부 유지에 필요한 단백질과 콜라겐의 합성에 반드시 필요
○ 아연은 파괴되기 쉬워 식품을 통해서는 거의 섭취되지 않음
○ 아연은 해산물, 붉은 색을 띤 육류, 견과류, 콩, 우유 등에 많이 들어 있음
○ 단백질 분해효소가 완전한 활성을 가지기 위해 아연 이온을 필요로 함 (ref)
○ 결핍증 : 철과 달리 아연은 잠재적인 결핍상태가 오랫동안 계속되어도 결핍 증세가 쉽게 나타나지 않음
○ 과다증 : 급성아연독성
○ 셀레늄 (Se)
○ 항산화제의 기능 : 세포 구조의 손상 방지
○ 글루타티온
○ 과산화수소의 주요 성분
○ 요오드 (아이오딘, I)
○ 갑상선이 유일하게 요오드를 섭취 : 갑상선암 방사선 치료의 원리
○ 티록신 등 갑상선 호르몬의 구성 성분으로 태아와 아동의 세포 발달과 성장에 영향을 미침
○ 백혈구의 구성에 관여
○ 수유하는 모체의 유즙 분비를 적당히 조절해 줌
○ 결핍증 : 갑상선 비대증, 바세도우씨 병(그레이브스 병) 등의 갑상선 항진증, 크레틴증
③ 무기물의 종류 요약
Table. 4. 무기물의 종류
④ 섭취
○ 무기질은 합성할 수 없음
○ 비교적 적은 양이 필요 : 간단한 무기질로 하루에 1 mg 미만에서 2500 mg 정도의 적은 양 필요
○ 수용성이므로 끓이면 유실
⑻ 비타민과 무기질의 비교
① 비타민은 탄소를 포함하는 유기물질이고 무기질은 아님
② 식물과 세균 등은 몇 가지 비타민들을 합성할 수 있지만 무기질은 합성할 수 없음
③ 비타민은 공기, 빛, 열 등 여러 가지 처리에 의하여 쉽게 파괴되지만 무기질은 화학적 방법에 의하여 파괴되지 않고 매우 안정적
⑼ 파이토케미컬(피토케미컬, phytochemical) : 식물에 들어있는 화합물 중 강한 생리적 활성을 갖는 것
① 색소 : 항산화 작용을 가지고 있어 노화 예방이나 만성 질병 예방에 기여
② 이소플라본(isoflavone) : 콩에 많고, 여성호르몬과 비슷한 작용을 하여 갱년기 증상을 완화하며 골다공증을 예방
③ 마늘이나 양파에는 심장병에 도움이 되는 물질이 들어 있음
⑽ 칼로리(calorie)와 물질대사율
① 칼로리 : 물 1g을 1℃ 높이는 데 필요한 에너지, 킬로칼로리(kcal)를 C로 줄여서 쓰기도 함
② 세포는 영양소의 에너지를 일을 하고 체온 유지에 사용
③ 물질대사율 : 생체의 효소 반응 속도를 측정하는 척도
○ 일일권장섭취량 : 성인 남성 평균 2700 kcal/day, 성인 여성 평균 2100 kcal/day가 필요
○ 기초대사율(75 %) : 휴식상대에서 에너지 소모율, 갑상샘 호르몬 등과 관련
○ 활동대사율(25 %) : 특정 활동에 요구되는 시간 당 에너지 소모율
④ 에너지원으로 사용되는 화학반응
○ C-C 결합 : 장기 에너지 저장
○ C-H 결합 : 장기 에너지 저장
○ C-OH 결합 : 단기 에너지 저장
⑾ 영양불균형
① 영양부족상태
○ 섭취하는 열량이 만성적으로 부족한 상태로 체내에서 필요한 화학적 에너지를 지속적으로 적게 공급함으로써 발생
○ 저장된 글리코겐, 지방, 단백질 분해 → 근육 크기가 줄고 뇌에서 단백질 부족 현상이 나타남
○ 예 : 가뭄, 전쟁, 에이즈 유행이 있는 사하라 사막 이남의 아프리카는 약 2억 명이 충분한 영양 섭취 불가
○ 예 : 신경성 거식증(강박적인 단식)
② 영양과다
○ 동물이 에너지 요구량보다 더 많은 음식을 섭취하는 경우 3대 영양소를 글리코겐이나 체지방으로 저장
○ 동면동물에게 중요
③ 영양실조
○ 하나 또는 그 이상의 필수영양소가 부족한 상태
○ 예 1. 비타민 A 결핍 → 베타 카로틴 공급으로 해결 (황금쌀)
○ 예 2. 인이 부족한 토양에서 자란 식물을 뜯어 먹을 경우 → 초식동물 뼈가 쉽게 부러짐
○ 예 3. 필수아미노산이 충분히 들어있지 않은 식이 → 단백질 결핍증
⑿ 영양소 요구의 평가
① 연구 목적으로 인간을 이용하는 것은 윤리적인 문제 야기
② 헤모크로마토시스(hemochromatosis) : 비정상적인 철 소비가 없어도 철이 축적되는 유전병
③ 역학연구(epidemiology) : 건강과 질병을 집단 수준에서 연구하는 것
○ 예 : 신경관 결함은 발생중인 뇌·척수가 닫히지 않아 생기고 엽산 섭취는 태아 출생에 치명적인 신경관 결함을 상당히 줄임
⒀ 산성 식품과 염기성 식품
① 산성 식품
○ 정의 : 식품을 연소시켰을 경우, 그 재 속에 인, 황, 염소 등 산성을 나타내는 원소를 많이 포함하고 있는 식품
○ 예 : 달걀 노른자 (인단백을 많이 포함하므로), 과일 (시트르산, 말산 때문), 주로 에너지와 단백질의 공급원이 되는 식품
② 염기성 식품
○ 정의 : 식품을 연소시켰을 경우, 그 재 속에 칼슘, 칼륨, 나트륨, 철 등 염기성을 나타내는 원소를 많이 포함하고 있는 식품
○ 예 : 달걀 흰자위
2. 효소 [목차]
⑴ 물질대사 : 신체에서 일어나는 모든 화학반응
① 깁스 자유에너지 : ΔH - TΔS < 0이면 반응은 자발적
② 생물학에서 ΔH ≒ ΔG로 간주
○ 발열반응(exergonic reaction) : ΔH < 0, 이화작용(catabolism)과 관련
○ 흡열반응(endergonic reaction) : ΔH > 0, 동화작용(anabolism)과 관련
③ 반응이 자발적이라도 활성화에너지(문턱 에너지)가 너무 높으면 반응속도가 느릴 수 있음
④ 활성화에너지
○ 정의 : 반응분자들이 화학반응을 일으키기 위해 필요한 최소한의 에너지
○ 활성화에너지가 낮아지면 반응할 수 있는 분자 수가 증가하여 반응속도 증가
○ 촉매(catalyst) : 반응물인 기질과 결합하여 활성화에너지를 낮춰 반응속도를 증가
○ 효소(enzyme) : 생체 촉매
⑵ 특징
① 특징 1. 기질특이성 : 효소는 자신의 활성부위와 입체구조가 맞는 특정 기질에만 작용하여 반응 촉매
○ 자물쇠·열쇠 모델(lock and key model) : 효소의 활성부위가 기질과 완전히 일치한다는 모델
○ 유도적합 모델(induced fit model) : 효소가 기질과 결합 시 기질에 맞는 완전히 상보적인 구조로 변한다는 모델
○ 1st. 기질의 모양은 효소 활성 부위와 대략적으로 유사
○ 2nd. 기질이 활성부위에 결합 시 효소는 모양이 변하고 화학결합이 압박
○ 3rd. 모양의 변화는 기질을 분해하고 단위체를 방출
○ 유사효소(isozyme, enzyme multiplicity)
○ 같은 생화학 반응에 관여하는 서로 다른 효소
○ 작용하는 세포에 따라 다른 특징을 가짐 (예 : hexokinase, LDH(lactose dehydrogenase))
○ 각각 다른 최종산물에 의해 피드백 조절을 받음, 그 결과 최종산물 종류에 따라 다른 효소가 작용
② 특징 2. 재사용 : 반응 전후 효소의 양은 동일
④ 특징 3. 효소는 반응속도에만 영향을 미칠 뿐 반응열의 크기에 영향을 주지 않음
⑤ 특징 4. 공통조상에서 유래 : 다른 생물들이 같은 효소를 이용하는 경우 ↑
⑵ 효소의 구성
① 효소의 분류 : RNA 효소(ribozyme이라고 함)와 단백질 효소로 구분. 효소는 일반적으로 단백질 효소를 지칭
② 활성부위(active site) : 기질(substrate)과 결합하는 부위
③ 전효소(holoenzyme) : 완전한 활성을 나타내는 효소
④ 주효소(apoenzyme) : 전효소 중 단백질 부분
⑤ 보조인자 : 전효소 중 비단백질 부분. 활성부위에 붙어 활성부위를 완성시킴
○ 조효소(coenzyme) : 효소의 활성을 위해 필요한 유기물 분자
○ 예 : 비타민 유도체, NAD+, FAD
○ 무기이온 : Fe2+, Cu2+, Mg2+, Zn2+ 등의 금속 원소
○ 보결족(prosthetic group) : 보조인자 중 효소와 매우 강하게 결합되어 있어 영구적인 결합을 하는 것
○ 포르피린 고리는 보결족을 형성하는 대표적인 화학 구조로 다음과 같은 예가 있음
○ 예 1. 헤모글로빈 헴 그룹 : 포르피린 고리에 Fe2+이 포함된 유기화합물
○ 예 2. 미오글로빈
○ 예 3. 엽록소
○ 예 4. 시토크롬 P450(cytochrome P450, CYP)
⑥ 아밀레이스, 펩신, 라이페이스 등의 가수분해 효소는 대부분 단백질로만 구성돼 있음
⑶ 효소의 촉매 기작
① 산-염기 촉매(acid-base catalysis)
② 공유 촉매(covalent catalysis)
③ 금속 이온 촉매(metal ion catalysis)
④ 정전기적 촉매(electrostatic catalysis)
⑤ 근접과 배향효과(proximity and orientation effects)
⑥ 전이상태 복합체의 차별적 결합(preferential binding of the transition state complex)
⑷ 효소의 작용에 영향을 미치는 요인
① 요인 1. 기질 농도
○ 미카엘리스-멘텐 방정식과 관련
○ 기질의 농도가 증가함에 따라 초기 반응속도가 증가하다가 일정 수준에 이르면 일정해짐
○ 모든 효소가 기질로 포화되면 기질의 농도가 증가해도 초기 반응속도는 더이상 증가하지 않음
② 요인 2. 온도
○ 온도가 높아질수록 활성화에너지 이상의 운동에너지를 가지는 분자수가 증가하여 반응속도 증가
○ 효소가 관여하는 화학반응은 효소가 최적 입체구조를 갖는 최적 온도에서 가장 반응속도가 빠름
○ 최적 온도 이상이 되면 단백질이 열에 의해 비가역적으로 변성되어 온도를 낮추어도 회복되지 않음
③ 요인 3. pH
○ 효소가 관여하는 화학반응은 최적 pH에서 가장 반응속도가 빠름
○ 효소를 구성하는 아미노산 잔기의 하전 상태는 수소 이온의 농도 변화에 따라 달라지므로 최적 pH를 벗어나면 단백질의 알짜 전하를 변화시켜서 정전기적 반발을 일으키고 효소의 입체구조를 변화시킴
○ 최적 pH 예
○ 펩신 : pH = 1.5
○ 카탈레이스 : pH = 7.6
○ 트립신 : pH = 7.7
○ 퓨마레이스(fumarase) : pH = 7.8
○ 라이보뉴클리에이스 : pH = 7.8
○ 아르지네이스(arginase) : pH = 9.7
④ 효소의 반응속도 지수
○ 효소 1 유닛(unit) : 1분 동안에 1 μmol의 생성물을 생성할 수 있는 효소의 활성
○ 효소 활성(activity) = 효소 유닛(unit) / 효소의 양(ml)
⑸ 효소의 분류 : IUPAC에 의해 규정. enzyme commission number라고도 함
① EC1 : 산화환원효소(oxidoreductase)
○ 산화환원을 매개하는 효소로 수소, 산소, 전자의 전달 기작이 발생
○ 종류 1. "반응물 + dehydrogenase" (예 : lactose dehydrogenase, alcohol dehydrogenase)
② EC2 : 전이효소(transferase)
○ 메틸기, 아실기, 아미노기 등의 작용기를 다른 물질로 전달
○ 종류 1. "trans + 반응물 + -ase" (예 : 아미노기전이효소(transaminase), 아세틸기전이효소(transacetylase))
○ 종류 2. "반응물 + -kinase" (예 : 육탄당인산화효소(hexokinase))
③ EC3 : 가수분해효소(hydrolase)
○ 가수분해(hydrolysis) 및 탈수축합반응(condensation)에 참여
○ 종류 1. "반응물 + -ase" (예 : protease, peptidase)
④ EC4 : 분해효소(lyase)
○ 기질의 C-C, C-O, C-N, C-S 결합 등을 절단하여 원자단의 첨가나 제거를 촉매
○ 부가반응은 2기질 반응, 탈리반응은 1기질 반응
○ EC4.4 : C-N 분해효소
○ EC4.5 : C-할로겐 분해효소
○ EC4.6 : P-O 분해효소
○ 종류 1. "반응물 + decarboxylase" (예 : pyruvate decarboxylase)
⑤ EC5 : 이성질화효소(isomerase)
○ 물질의 구조를 재배열하는 효소
○ 종류 1. "반응물 + isomerase" (예 : phosphoglucose isomerase)
○ 종류 2. "반응물 + mutase"
⑥ EC6 : 연결효소(ligase)
○ ATP를 사용하여 두 물질 간에 새로운 결합을 형성
○ 종류 1. "반응물 + ligase" (예 : DNA ligase)
⑺ 저해제 : 생체 내에서도 되먹임 억제를 위해 효소 저해 기작이 있으나 저해제와 달리 반응이 가역적
① 비가역적 저해(irreversible inhibition)
○ 예 1. 페니실린(penicillin)
○ 세균의 세포벽(펩티도글리칸) 합성효소(transpeptidase) 저해제
○ 활성부위와 반영구적인 공유결합을 하기 때문에 강력함
○ 예 2. 사린 가스
○ 아세틸콜린 에스터라제의 정상 활성 : 아세틸콜린은 콜린과 아세트산으로 분해. 아세트산은 아세트산 이온과 H+로 해리
○ 1st. 사린 가스가 아세틸콜린 에스터라제의 활성부위에 비가역적으로 결합
○ 2nd. 아세틸콜린↑
○ 3rd. 근육경련, 동공축소, 정신착란, 호흡곤란
② 가역적 저해(reversible inhibition) : 경쟁적 저해, 반경쟁적 저해, 비경쟁적 저해로 구분
○ (주석) 경쟁적, 반경쟁적, 비경쟁적 저해를 말할 때 가역적, 비가역적을 굳이 따지지 않는 경우도 많음
③ 경쟁적 저해(competitive inhibition)
○ 기질과 같은 활성부위를 놓고 효소반응에 경쟁적으로 참가하여 효소반응을 저해
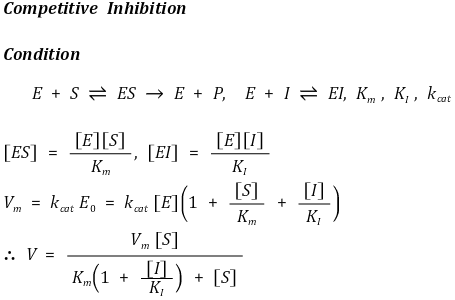
○ 활성효소의 형태를 변형시키지 않음
○ 예시
○ 이부프로펜(Ibuprofen) : 프로스타글란딘 생산 억제
○ 말론산-숙신산탈수소효소 : 숙신산 탈수소 효소는 숙신산을 산화시키는데, 숙신산의 경쟁적 저해제인 말론산이 숙신산 탈수소 효소의 활성 부위에 결합하면 숙신산의 산화 반응이 저해됨
○ 스타틴-HMG-CoA reductase
○ 글리벡-Bcl-abr의 Ras 인산화작용
○ HIV 단백질 분해효소
○ 기타 항우울제, 항생제, 살충제
④ 반경쟁적 저해(무경쟁적 저해, uncompetitive inhibition)
○ 효소-기질 복합체에 저해제가 결합하여 효소반응을 저해
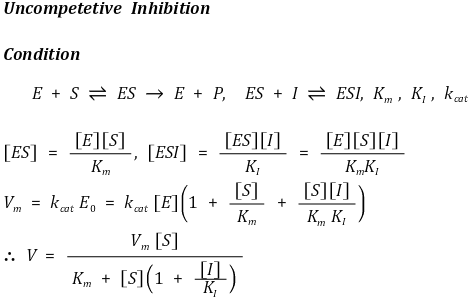
⑤ 비경쟁적 저해(noncompetitive inhibiton)
○ 활성부위가 아닌 다른 자리(allosteric site)와 결합하여 효소반응에 비경쟁적으로 참가하여 효소반응을 저해
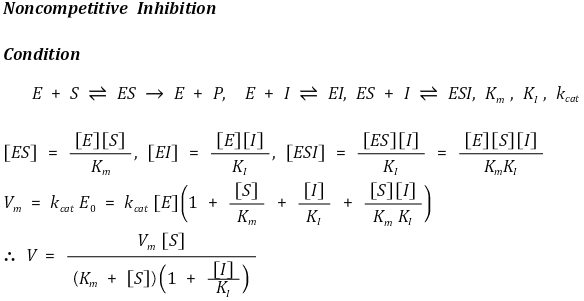
○ 활성효소의 형태를 변화시킴
⑻ 협동성
① 억제자 혹은 활성자 대신 기질 자체가 효소 활성을 조절하는 것
② 양성적 협동성 : 다기질 효소에서 이미 결합된 기질이 다른 기질의 결합을 도와주는 것
③ 음성적 협동성 : 있긴 있으나 극히 드묾
④ 반응식 : 협동성이 있으면 ES1이 생긴 이후 순식간에 ESn이 생기므로 ES1, ···, ESn-1을 고려할 필요가 없음
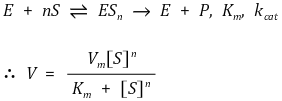
⑤ 예 : 헤모글로빈의 산소포화도
○ 헤모글로빈은 4개의 소단위로 구성되어 있으며, 각 소단위는 하나의 산소결합 부위를 가짐
○ 헤모글로빈은 sigmoid 곡선 개형의 산소포화도 곡선을 나타냄
○ 산소 한 분자가 하나의 결합 부위에 붙으면 나머지 결합 부위들에서 산소 친화력 정도가 증가
○ 하지만 산소가 없는 지역에서 산소 분자가 하나 떨어지기 시작하면 나머지도 떨어짐
○ 미오글로빈은 하나의 서브유닛으로 되어 있어 협동성이 없으므로 hyperbolic 곡선 개형의 산소포화도 곡선을 나타냄
⑼ 효소 활성 조절 메커니즘
② 협동성에 의한 조절
③ 알로스테릭 조절 (다른 자리 입체성 조절, allosteric control)
○ 조절 분자체 : 단백질에 붙어 단백질의 입체 구조를 바꾸어 단백질의 기능이 달라지도록 하는 작은 분자
○ 조절 분자체는 기질이 아님
○ 조절 분자체에는 억제자 혹은 활성자가 존재함
○ 다른 자리 입체성 조절 (알로스테릭 조절)
○ 효소에 활성자 혹은 억제자가 기질 결합 부위가 아닌 다른 조절 부위에 붙어 기질의 반응을 활성 혹은 억제시키는 것을 말함
○ 이때 다른 조절 부위를 알로스테릭 부위라고 함
○ 알로스테릭 조절은 가역적인 반응을 촉매하는 효소에서도, 비가역적인 반응을 촉매하는 효소에서도 모두 일어날 수 있음
○ 예시 : ATP는 세포 호흡에 관여하는 효소에 억제자로, ADP는 활성자로 작용하여 세포호흡을 조절함
○ PFK-1은 F-6-ⓟ을 F-1,6-bisphosphate로 생성하는 데 관여하는 효소임
○ ATP는 PFK-1의 기질이기 때문에 PFK-1은 ATP의 알로스테릭 조절을 받음
○ ATP의 양을 x축, PFK-1의 활성을 y축으로 하는 그래프는 종 모양의 그래프(bell-shaped graph)를 보임
○ 응용 1. 저해제 (억제제)
○ 일반적인 알로스테릭 조절은 저해제처럼 반응을 완전히 차단하지는 않음
○ 효소에 억제자가 붙어 다른 자리 입체성 조절을 발현하는 것을 비경쟁적 억제라고 함
○ 경쟁적 억제제는 다른 자리가 아니라 기질이 달라붙는 그 활성부위에 붙는 것이므로 알로스테릭 조절이 아님
○ 응용 2. 되먹임 억제(feedback inhibition)
○ 경로의 초기에 작용한 효소에 최종 생성물이 억제적으로 결합함으로써 물질대사 경로가 조절되는 기작을 꺼지게 하는 것
④ 인산기를 통한 조절
⑤ 조절단백질
○ 예 : Ca2+-칼모듈린의 NO synthase 조절
⑽ 효소 고정화(enzyme immobilization) : 효소를 특정 위치에 고정시키는 것
① 포획법(entrapment, encapsulation) : 물리적인 효소 고정화 방법으로 가장 널리 사용
○ porous hollow fiber
○ spun fiber
○ gel matrix
○ micro-capsule
② 결합법 : 화학적인 효소 고정화 방법, 담체 표면의 작용기와 효소의 작용기간 화학적 힘으로 고정시키는 방법
③ effective factor = reaction rate with diffusion limitation / reaction rate without diffusion limitation
○ 효소를 고정화함으로써 반응률이 얼마나 좋아졌는지를 나타냄
○ 효소의 농도 ↑ → effective factor ↓ (고정 여부에 관계없이 농도가 높으므로 반응이 잘 일어난다는 의미)
⑾ 효소 정량법
① UV spectrometer : Phe, Trp, Tyr의 페닐기의 흡광도인 280 ㎚를 대표적으로 사용함
② Bradford method : Coomassie Blue G 염색약이 단백질과 결합함으로써 생기는 파장의 변화 측정
○ 장점 : 정량 시간이 매우 빠르고 간단함
○ 단점 : 단백질마다 염색약과 결합하는 정도가 다름
○ 응용 1. Pierce 660 nm protein assay
③ BCA method(bicinchoninic acid method) : 아미노산 내 아마이드 결합에 의한 구리 이온의 환원을 토대로 측정
○ 현재 가장 자주 사용되고 있는 단백질 정량 프로토콜
○ 장점 : 단백질 간의 차이가 근소. sensitivity가 우수함
Figure. 1. BCA method와 Bradford method의 sensitivity 차이
○ 단점 : 준비시약이 많음. 절차가 복잡함. 다른 환원제, 구리 킬레이터, 고농도의 버퍼에 의해 간섭을 받을 수 있음
○ 환원제의 예 : DTT, β-ME
○ 구리 킬레이터의 예 : EDTA, EGTA
○ 단계 1. Cu2+ → Cu+
○ 주로 시스테인(cysteine), 시스틴(cystine), 티로신(tyrosine), tryptophan에 의해 환원됨
○ Bradford method와 달리 peptide backbone도 환원반응에 관여하기 때문에 단백질 간 차이가 적어짐
○ 단계 2. reagent가 Cu+와 착물을 형성하여 색깔이 변함
○ apple green의 Cu2+에서 보라색의 Cu+-BCA complex가 형성됨
○ 뷰렛 반응(biuret reaction), Lowry method, Peterson method, 뷰렛 반응 등 변형된 프로토콜이 있음
○ Thermo Scientific Quanti-iT, Qubit and NanoOrange protein assay
○ NanoOrange Protein Quantitation Kit
○ CBQCA Protein Quantitation Kit
○ EZQ Protein Quantitation Kit
○ Fluorometer
○ Invitrogen Qubit Fluorometer
⑿ 효소의 예
① 예 1. 포도당 운반체(GLUT, glucose transporter) : 세포막에서 포도당 운반
○ 특징 : 양방향성. D형 포도당만 포도당 운반체로 운반될 수 있음. 세포막을 12번 통과
○ GLUT1 : 모든 세포에 존재. 암세포에 많음. Km = 1 mM
○ GLUT2 : 간, 이자 β세포, 소장에 존재. Km = 10 ~ 20 mM. 애초에 포도당이 많으므로 감도 낮음
○ GLUT3 : 뇌에 존재. 면역세포에 많음. Km = 1 mM . 뇌는 에너지 수요가 높으므로 감도 높음
○ GLUT4 : 근육, 지방에 존재. Km = 5 ~ 10 mM. 인슐린에 의해 조건부 발현
○ GLUT5 : 과당 운반체. 소장에 존재
○ GLUT와 인슐린 분비 메커니즘
○ 1st. 혈중 포도당 농도 증가
○ 2nd. 포도당은 GLUT2를 통해 췌장 베타세포 내로 들어감
○ 3rd. 포도당은 해당과정과 TCA cycle을 통해 다량의 ATP를 생성. 포도당인산화효소는 glucose sensor로 작용
○ 4th. 생성된 ATP는 ATP-민감성 K+ 통로를 차단하여 세포 내부의 양이온 함량을 증가시킴
○ 5th. 세포막이 탈분극되면서 Ca2+ 통로가 열림
○ 6th. Ca2+는 베타세포 내로 들어온 뒤 인슐린 소낭의 방출을 촉진하여 혈류 내 인슐린 농도를 높임
○ 7th. 인슐린은 근육세포에 들어간 뒤 GLUT4 소낭의 세포막 이동을 촉진시킴
○ 8th. GLUT4 소낭 내 GLUT4는 근육세포 세포막에 발현됨
○ 9th. GLUT4가 GLUT2보다 감도가 높아 포도당이 근육과 지방으로 집중 → 혈당량 감소
② 예 2. 설탕 가수분해효소
○ 설탕을 포도당과 과당으로 분해하는 가수분해효소
○ 작용부위만 갖는 단량체 구조로 다른 자리 입체성 구조를 갖지 않음
③ 예 3. 젖산탈수소효소(LDH, lactose dehydrogenase)
○ H (heat form) 또는 M (muscle form) 단위체 4개로 구성
○ 총 5 종류 : H4, H3M, H2M2, HM3, M4
○ H의 등전점은 5.7, M의 등전점은 8.4임
○ 근육 : muscle form LDH에 의해 피루브산 → 젖산 (∵ 근육은 젖산발효가 일어나므로)
○ 간 : muscle form LDH에 의해 젖산 → 피루브산 (∵ 간은 포도당 신생합성이 일어나므로)
○ 심장 : heart form LDH에 의해 젖산 → 피루브산 (∵ 심장은 젖산을 에너지원으로 이용해야 하므로)
④ 예 4. 육탄당인산화효소(hexokinase)
○ hexokinase Ⅰ : 근육에 존재, 포도당에 대한 기질 친화성이 매우 높음
○ hexokinase Ⅳ : 간에 존재, 포도당에 대한 기질 친화성이 낮음
⑤ 예 5. 에탄올 분해
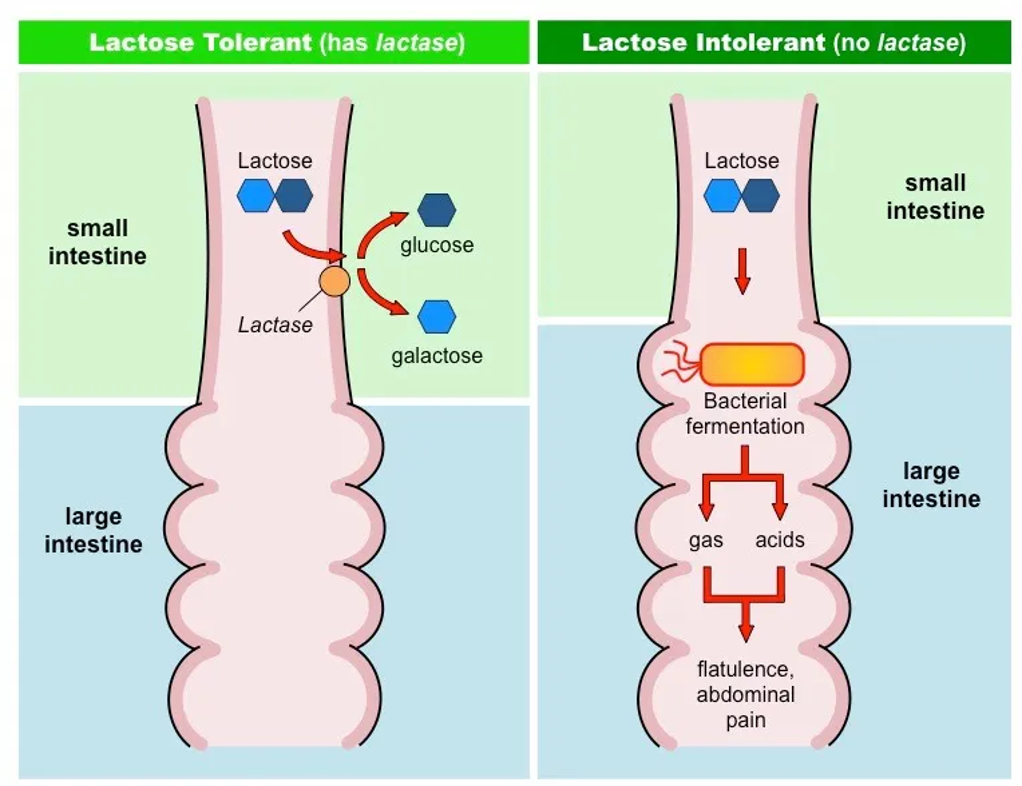
⑥ 예 6. 젖당 비내성(유당불내증, lactose intolerance)
○ 유아에게는 젖당 분해효소가 잘 분비되지만 성인이 되면서 결핍
○ 유럽 국가에서는 젖당 비내성이 잘 나타나지 않음
○ 과정 : 소장에서 락타아제 결핍 → 젖당 소화 불가 → 세균이 젖산 분해 → 가스 및 설사 원인
Figure. 5. 젖당 비내성
3. 막을 통한 수송 [목차]
⑴ 구성 1. 원형질막 : 유동모자이크 모델을 따름
⑵ 구성 2. 막단백질(membrane protein)
① 개요
○ 막단백질은 사람 유전자의 대략 1/3을 차지함
○ 사람에 투여되는 약물의 50% 이상이 막단백질을 타겟팅함
② 종류 1. 내재성 단백질(integral membrane protein)
○ 세포막 내부 소수성 내부까지 침투한 막단백질
○ 특징 1. 막 관통 부위는 알파나선 구조을 취함
○ 특징 2. Pro, Gly는 알파나선을 형성하지 않으므로 막 관통 부위에 존재할 수 없음
○ 예 : channel 단백질, 운반체 단백질, pump
○ 기능 : 효소 반응(한쪽만 돌출된 경우가 많음), 신호전달(signal transduction)
③ 종류 1-1. 수송단백질(transport protein) : 물질의 수송을 맡음
○ 분류 1. 수송 방식에 따른 분류 : 운반체 단백질, 채널 단백질, 펌프 단백질 (아래 참고)
○ 분류 2. 에너지 사용에 따른 분류 : 수동수송과 능동수송
○ 수송되는 분자가 굉장히 큰 경우 능동수송으로 부르지 않음 : 세포내 섭취, 세포외 배출로 불림
○ 공동수송(공수송, cotransport) 여부에 따른 분류
○ 단분자 수송 : 아쿠아포린, 포도당 운반체(GluT) 등
○ 동방향 공동수송체 : Na+-포도당 공동수송체, H+-설탕 공동수송체 등
○ 역방향 공동수송 : Na+-H+ 교환 운반체, Na+-Ca2+ 교환 운반체, G3P-pi 교환 운반체 등
④ 종류 1-2. 인테그린(integrin) : ECM과 상호작용
⑤ 종류 2. 표재성 단백질(주변부 단백질, peripheral membrane protein)
○ 세포막에 부착한 형태 : 막에 정전기적 인력으로 붙음
○ 당단백질이 붙어 있음
⑥ 소수성 지표(hydropathy plot) : 막관통 영역을 식별
⑦ 내재성 단백질(membrane fraction)과 용해성 단백질(표재성 단백질 + 용해된 단백질, soluble fraction) 단순 분리 실험
○ 1st. 물리적 방법(e.g., sonification)으로 세포막 부분 파괴
○ 2nd. 원심분리(centrifugation)
○ 3rd. 상층액이 용해성 단백질
○ 4th. 하층부에 계면활성제(e.g., detergent)를 첨가하면 막단백질을 얻을 수 있음
⑧ 막단백질의 추출
○ 내재성 단백질 : 계면활성제, SDS, Triton X-100 (세포막 파괴)
○ 표재성 단백질 : pH, 열, NaCl, 요소 (친수성 ↑)
○ 요소는 강한 친수성을 가지기 때문에 이황화결합을 제외하고 모든 R-R 상호작용을 제거함
⑶ 수송 방식 1. 수동수송(passive transport) : 농도 기울기에 따른 확산(diffusion), 에너지 사용 안 함
① 단순확산 : 고농도에서 저농도로 분자가 이동하는 것 (농도구배가 클수록 빠름)
○ 인지질을 통한 작은 소수성 분자의 이동
○ 에너지가 필요하지 않음
○ 평형에 도달할 때까지 계속
② 촉진확산 : 막 단백질을 통한 친수성 및 전하성 물질의 확산
○ 채널 단백질(통로 단백질, channel protein, pore protein)
○ 정의 : 통로 형태로 물분자나 친수성 용질을 촉진확산을 통해 수송하는 형태
○ 이온선택적
○ 단순확산과 유사한 양상을 보이며 포화되지 않음
○ 분류 1. 의존성 채널 : 리간드 의존성 채널, 전압 의존성 채널, 기계 자극 의존성 채널
○ 리간드 의존성 채널 : 아세틸콜린 수용체 등
○ 전압 의존성 채널 : 활동전위 유발 채널 등
○ 기계 자극 의존성 채널 : 청각 털세포 등
○ 분류 2. 이온채널(ionophore) : 세포막에 대한 특정 무기이온의 투과도를 급격히 증가
○ 예 : H+ 이온채널(DNP), K+ 이온채널(valinomycin)
○ 운반체 단백질(carrier protein, porter protein)
○ 정의 : 특정 용질에 대해 단백질의 입체 구조가 바뀌면서 물질을 수송하여 촉진확산을 함
○ 채널 단백질의 수송속도보다 1000배 이상 느림
○ 효소처럼 미카엘리스-멘텐 방정식이 성립되고 포화될 수 있음
○ 물은 이온통로와 운반체 단백질을 모두 경유하는 유일한 물질
③ 삼투(osmosis) : 물만 통과할 수 있는 반투과성 막에서 free H2O가 고농도(저염액)에서 저농도(고염액)으로 확산하는 현상
○ 수식화

○ 저장액(hypotonic solution) : 세포 내부의 삼투 농도보다 낮은 용액, 동물세포 용혈, 식물세포의 환경(팽윤)
○ 식물세포와 저장액
○ 흡수력 = 삼투압 - 팽압 (단, 팽압 ≥ 0인 조건)
○ 흡수력 = 0 또는 팽압 = 삼투압인 조건 : 팽윤
○ 등장액(isotonic solution) : 세포 내부의 삼투농도와 같은 용액, 동물세포의 환경, 식물세포 시듦
○ 세포 내부의 삼투농도 = 0.9 % = 0.3 M = 300 mOsmol
○ 고장액(hypertonic solution) : 세포 내부의 삼투 농도보다 높은 용액, 동물세포 수축, 식물세포 원형질 분리
○ 아쿠아포린은 형태는 채널이지만 일반 채널 단백질과 달리 포화될 수 있음
⑷ 수송 방식 2. 능동수송 : 수송 단백질이 특정 이온 및 분자를 전기·화학적 농도 차에 역행하여 수송
① 특징
○ 펌프라는 운반체 단백질이 관여 : 채널 형태의 능동수송은 없음
○ ATP의 인산화 혹은 빛에너지에 의한 들뜸을 이용
○ 일방향 수송
② 펌프(pump) : 능동수송에 관여하는 수송 단백질. P형, V형, F형으로 구분
③ P형 펌프 : ATP의 분해로 펌프에 인산기를 붙여 펌프의 구조를 변형하여 물질수송을 하는 것
○ Na+ / K+ 펌프 : 동물에만 존재. Na+ 3 분자를 세포 밖으로, K+ 2 분자를 세포 내로 펌핑
○ 예 : 소장에서 포도당 흡수 시
○ K+ 펌프 : 식물, 세균, 균계에 존재. 설탕 등의 친수성 양분 펌핑
○ H+ 펌프 (P형) : 식물, 세균, 균계에 존재. 설탕과 젖당의 공수송
○ H+ / K+ 펌프 : 위벽 부세포의 염산 분비에 관여. Cl-는 수동수송
○ Ca2+ 펌프 : 활면소포체에서 칼슘 저장시 사용
④ V형 펌프 : ATP가 분해될 때 발생하는 에너지를 직접 이용
○ vacuolar membrane proton pump
○ H+ 펌프 (V형) : 리소좀과 액포 내부를 산성 환경으로 만듦
○ 억제제 : bafilomycin
⑤ F형 펌프 : ATP 합성효소가 펌프로 작용하여 H+를 펌핑하는 경우
○ 박테리오 로돕신
○ 광수송 (빛 의존 수송)을 수행함
○ 진정세균, 고세균은 빛을 받으면 H+를 펌핑함
○ C-P-Q(carotene-porphyrin-naphthoquinone) : 세균에서 분리한 양성자 펌프
⑥ 직접능동수송(1차 능동수송) : 에너지를 직접 이용하여 수송하는 경우
⑦ 간접능동수송(2차 능동수송) : 다른 물질의 능동수송을 이용하여 수송하는 경우
⑧ 약제
○ 푸시코신(fusicoccin) : 양성자 펌프를 활성화
○ 바나듐산(vanadate) : 양성자 펌프 억제
⑸ 수송 방식 3. 세포내 섭취, 세포외 배출 : 큰 분자는 수동 수송 혹은 능동 수송 불가
① 특징 : ATP 이용
② 종류 1. 세포외 배출(exocytosis) : 막에 싸인 소낭이 세포막과 융합하고 큰 분자를 방출
○ 예 : 인슐린. 인슐린은 촉진확산으로 분비되지 않음
③ 종류 2. 세포내 섭취(endocytosis) : 큰 분자 주위로 소낭이 형성되어 세포 안으로 운반. ④ ~ ⑥으로 구분
○ 예 : 혈액 내 철은 트랜스페린 단백질 수송체와 함께 결합하여 세포내 섭취
○ 과량의 cytochalasin D는 세포내 섭취를 억제함 : 액틴 중합을 억제하기 때문
④ 2-1. 식세포작용(외포작용, phagocytosis) : 위족(pseudopodia)을 통해 적극적으로 흡수
○ 소량의 cytochalasin D(10 μM)는 식세포작용을 억제할 수 있음
⑤ 2-2. 음세포작용(내포작용, pinocytosis) : 특정 세포막을 함입하여 무작위적으로 흡수
○ 수용체 매개 세포내 섭취까지 음세포 작용으로 분류하기도 함
○ 대음세포작용(macropinocytosis)
○ 암세포의 주요한 특징 중 하나
○ 메커니즘 : RAS pathway에 의해 촉진되며 암세포의 약물 섭취에 관여함이 입증됨 (ref)
○ 기능 1. 영양 부족, 성장인자 부족 등의 상황에서 촉진 : 세포외 물질을 글루타민 등을 생산할 때 사용
○ 기능 2. RAS에 의해 과발현된 macropinocytosis는 non-apoptotic cell death인 methuosis를 일으킬 수 있음 (ref)
○ 신호전달자 : CTBP1, Rac1, Rabankyrin-5
○ 억제제 : EIPA (5-(N-ethyl-N-isopropyl)amiloride)
⑥ 2-3. 수용체 매개 세포내 섭취(receptor mediated endocytosis)
○ 기질과 결합된 수용체와 함께 소낭을 형성하여 선택적으로 흡수
○ 예 1. CME(clathrin-mediated endocytosis) : LDL의 수용체 매개 세포내 섭취 등
○ 1st. LDL이 수용체에 결합한 뒤 수용체 매개 내포작용으로 소낭에 싸여 세포 내로 유입
○ 2nd. 세포 내로 막이 함입될 때 어댑틴(adaptin), 클라트린(clathrin-coated pit), 디나민(dynamin) 관여
○ 클라트린 : 엔도사이토시스 과정에서 소낭의 막을 감싸는 단백질. 피막을 형성함
○ 디나민 : 소포 형성과 관련된 GTPase. 자르는 역할
○ 탈피복 : 어댑틴, 클라트린 제거
○ 3rd. 수용체 소낭이 초기 엔도좀과 결합
○ 4th. 수용체와 LDL이 분리된 후, LDL이 초기 엔도좀으로 이동
○ 5th. 재활용 : 수용체 소낭이 분리되어 세포막으로 이동
○ 6th. 수용체 소낭과 분리된 초기 엔도좀은 골지체 유래 1차 리소좀 소낭과 결합
○ 7th. 결합 후 2차 리소좀 소낭(성숙 엔도좀)이 됨
○ 8th. 성숙 엔도좀이 mannose pathway와 합쳐져 리소좀으로 완성
○ 9th. 콜레스테롤 분리
○ 억제제 : dynasore (dynamin 억제제), chlorpromazine, pitstop 2
○ 예 2. CvME(카베올라, caveolar-mediated endocytosis, caveolae)
○ 60 nm 정도의 vesicle이 형성됨
○ 억제제 : dynasore (dynamin 억제제), nystatin, filipin
○ 예 3. albumin pathway
○ 3-1. gp60-mediated endocytosis
○ 3-2. SPARC-mediated endocytosis
○ 3-3. gp18, gp30-mediated endocytosis
○ 3-4. megalin/cublin-mediated endocytosis
○ 3-5. FcRn-mediated endocytosis
○ 예 4. 트랜스사이토시스(transcytosis) : 내포작용이 일어난 소낭이 막을 관통
○ 예 5. B cell receptor
○ 미성숙 B cell은 IgD를 발현하고 있음
○ 미성숙 B cell은 IgD를 통해 항원을 섭취한 후 리소좀을 통해 절편화 시킴
○ 절편화된 항원은 조면소포체에서 MHC class Ⅱ에 표지 : 3차 구조가 1차 구조가 됨
○ 예 6. Fc receptor-mediated endocytosis
○ 저해제 : piceatanol
○ 예 7. mannose receptor-mediated endocytosis
○ 억제제 : mannan
○ 예 8. 소장상피세포 : 소장상피세포는 IgA를 transcytosis를 통해 소장의 내강쪽으로 위치하게 하여 박테리아 제거
○ 일반적인 target receptor와 target ligand
입력: 2015.06.25 10:01
수정: 2020.02.08 21:45
'▶ 자연과학 > ▷ 일반생물학' 카테고리의 다른 글
| 【생물학】 3-2강. 효소의 활성도와 기질의 관계 (0) | 2019.02.16 |
|---|---|
| 【생물학】 3-1강. 단백질 분해효소 메커니즘 (0) | 2019.02.16 |
| 【생물학】 2강. 세포 이론 (0) | 2019.02.16 |
| 【생물학】 1강. 생명체의 구성 (0) | 2019.02.16 |
| 【생물학】 32-7강. 히드라의 재생 및 이식 (0) | 2019.01.27 |













최근댓글