1강. 생명체의 구성
추천글 : 【생물학】 생물학 목차, 【유기화학】 생체고분자 : 탄수화물, 단백질, 지질, 핵산
a. 생체고분자 소수성 지표
b. 파마와 이황화결합
c. 생체고분자 라이브러리
1. 생명체의 정의 [목차]
⑴ 정의 1. 생물은 생장, 운동, 증식을 함. 자극에 반응함. 물질대사를 함
① 불은 생물이고 노새는 생물이 아닌가?
⑵ 정의 2. 다음 조건을 모두 만족하는 경우 생물이라고 정의
① 공통적인 생체 분자 세트를 가짐
② 항상성을 유지
③ 진화할 수 있음
④ 물을 필요로 함
2. 물과 탄소 [목차]
⑴ H2O
① 극성 : 산소는 전기음성도가 커서 수소의 전자를 유인하여 약한 음전하를 띰. 반대로 수소 쪽은 약한 양전하를 띰
② 수소결합 : 수소와 전기음성도가 큰 원자(F, O, N)와의 분자 간 인력
○ 물 분자들은 수소결합으로 인하여 상호간 응집력이 있음
○ 한 분자의 물은 네 곳에서 수소결합을 형성할 수 있음

③ 높은 열용량(∵②) : 온도 조절에 중요한 역할을 함
④ 좋은 용매(Universal Solvent)(∵①)
○ 물은 다른 극성물질(예 : 염, 알코올, 산, 염기)을 녹일 수 있음
○ 화학반응을 도움
○ 수화층 : 물 분자가 용질을 둘러싸는 층으로 물에 녹았을 때 이온들의 사이즈가 훨씬 커지는 이유
⑤ 응고 시 부피 팽창
○ 이유 : 얼음은 육각결정을 형성하기 때문
○ 대기압 하에서 물의 밀도는 항상 얼음보다 큼

⑵ C (탄소)
① 탄소는 4개의 원자와 결합할 수 있어 생체 고분자의 골격으로 사용
② 탄소는 생물체 질량의 많은 부분을 차지
③ 유기화학 : 탄소의 화학
○ 탄소를 기반한 분자들을 유기 물질(organic compounds)이라고 부름
○ 탄소와 수소로만 이루어진 물질을 탄화수소(hydrocarbon)라고 부름 (예 : CH4)
④ 화성의 운석에는 탄소와 산소를 함유한 탄산염과 탄소와 수소로 된 탄화수소 사슬이 있음
○ 단, 그것이 생물체에서 생산된 고분자라는 확증은 없음
⑶ 작용기

3. 생체 고분자(macromolecule) [목차]
⑴ 지구상의 생물은 동일한 고분자 세트(예 : 탄수화물, 단백질, 지질, 핵산)를 함유
⑵ 폴리머의 생성 : 모든 폴리머는 모노머들의 탈수 축합 반응(dehydration reaction)(물이 생성)으로 만들어짐
⑶ 폴리머의 분해 : 폴리머가 가수 분해(hydrolysis)되면 모노머들로 분해
⑷ 폴리머의 이점 : 세포의 삼투압을 적게 유발하고 세포 내 모노머의 농도를 낮게 유지할 수 있음
4. 생체고분자 1. 탄수화물(polysaccharide) = (CH2O)n [목차]
⑴ 기능 : 세포의 주요 에너지원, 구조적 역할
① 에너지원 : 4 kcal/g
② 수용성 분자
⑵ 글리코시드 결합 : 당 간의 탈수축합반응

⑶ 단당류 : 포도당(6C), 과당(6C), 갈락토오스(6C), 그 외(3C ~ 7C)

⑷ 이당류
⑸ 올리고당 : C3 ~ C12를 지칭
⑹ 다당류 : 글리코겐, 녹말, 셀룰로오스, 키틴, 펩티도글리칸
① 글리코젠(glycogen)
○ α 결합 포도당 중합체로 가지가 훨씬 많고 동물의 비교적 단기간의 에너지원
○ α 1 → 4 결합, α 1 → 6 결합
② 녹말(starch)
○ α 결합 포도당 중합체로 식물의 장기간 에너지원
③ 셀룰로오스(cellulose)
○ β 결합 포도당 중합체로 세포벽을 형성하며 지구상에서 가장 풍부한 탄수화물
○ β 1 → 4 결합
④ 키틴(chitin)
○ NAG(N-Acetylglucosamin) : 포도당 2번 탄소의 작용기가 아민기로 치환
○ 키틴은 NAG의 중합체 : 곤충과 갑각류의 외골격을 형성하는 데 쓰임
○ β 1 → 4 결합

Figure. 6. NAG의 구조
⑤ 덱스트린(dextrin)
○ α 1 → 4 결합
○ (참고) 덱스트란은 상표 이름이라는 것을 유의
⑺ α 결합과 β 결합

Figure. 7. α 포도당 (가)와 β 포도당 (다)
① α 결합 : 포도당의 상하 뒤집힘 없이 결합하는 것으로 입체 구조상 약간 비틀어져서 α 나선을 형성
② α 결합 포도당 : 1번 탄소의 -OH기와 4번 탄소의 -OH기가 같은 방향에 있어 불안정 → 에너지 저장
③ β 결합
○ 한 쪽 포도당의 위 아래가 뒤집혀서 1번 탄소와 4번 탄소가 맞붙어 입체구조상 곧은 직선을 형성하게 됨
○ β 결합 포도당 chain들 간에 단단한 수소 결합으로 응집
④ β 결합 포도당 : 1번 탄소의 -OH기와 4번 탄소의 -OH기가 다른 방향에 있어 안정 → 구조 형성
⑻ 녹말
① 아밀로오스는 α 결합 포도당 중합체 중에서 가지가 없는 것. 1번 탄소와 4번 탄소가 결합
② 아밀로펙틴은 α 결합 포도당 중합체 중에서 가지가 있는 것. 1번 탄소와 6번 탄소가 결합
③ 녹말이 불용성인 이유는 α 포도당 chain 간 수소결합으로 단단한 결정을 형성하기 때문
④ 대부분의 소화효소가 α 결합만 분해할 수 있는 이유는 공간이 비교적 넓어 효소의 접근성이 높기 때문

Figure. 8. 아밀로오스(amylose)와 아밀로펙틴(amylopectin)
⑼ 셀룰로오스
① 지구상에서 가장 풍부한 탄수화물
② β 1 → 4 결합

Figure. 9. β-glucose 체인 간의 수소결합
③ 셀룰라아제
○ 반추동물의 위 : 4개의 위 중 혹위(반추위), 벌집위에 있는 장내 공생 미생물이 셀룰라아제를 합성
○ 흰개미의 창자 : 장내 공생 미생물인 Trichonympha가 셀룰라아제를 합성
5. 생체고분자 2. 단백질(protein) = 아미노산 중합체 [목차]
⑴ 특성
① 구성원소 : C, H, O, N, S
② 기능
○ 대사작용의 효소
○ 세포 내·외 구조 형성 : 생체 건량의 반을 차지
○ 근육 수축
○ 면역 기능
○ 호르몬이나 신호 단백질
○ 세포 내부로 신호전달
○ 막의 물질수송
○ 에너지 전환 및 저장 : 4 kcal/g. 주로 태아에 해당
○ DNA 복제, 수선 및 재조합
○ 전사, 번역
○ 단백질 운반 및 분비
③ 단백질 : 한 개 또는 두 개 이상의 폴리펩티드로 구성
④ 폴리펩티드 : 아미노산의 펩티드 결합으로 구성
⑤ 펩티드결합 : 아미노기(-NH2)와 카르복실기(-COOH)의 탈수축합반응

⑵ 아미노산
① 아미노산은 총 20개가 있음 : selenocysteine (Sec)까지 포함하여 21개로 보기도 함

Table. 1. 아미노산의 기호 (ref)
② 구조 : 중심 탄소, 아미노기, 카르복실기, R기
③ 모든 아미노산은 동일한 등뼈를 가지고 있지만 촉쇄군(R로 표시)은 20가지 종류가 있음
○ 그 외는 단백질 합성 ×
○ selenocysteine 등 minor한 아미노산을 합치면 그 개수가 20가지를 초과할 수 있음
④ 양쪽성 이온 : 산 또는 염기로 작용. 등전점
⑤ 아미노산은 곁가지에 따라 성질이 달라짐
○ 비극성 아미노산 : Ala, Ile, Leu, Met, Phe, Pro, Trp, Val, Gly
○ 극성, 비전하 아미노산 : Asn, Cys, Gln, Ser, Thr, Tyr
○ 전하 아미노산 (+) : Arg, His, Lys
○ 전하 아미노산 (-) : Asp, Glu
○ -OH기 포함 아미노산 : Ser, Thr, Tyr, -OH기에 인산기가 첨가될 수 있어 신호전달에 이용
○ Ser, Thr : 신호전달에서 인산화 연쇄에 관여
○ Tyr : 신호전달에서 티로신 인산화효소 수용체에 존재
○ 황 포함 아미노산 : Cys, Met. Cys만 이황화결합 형성
○ 페닐기 포함 아미노산 : Phe, Trp, Tyr
○ 페닐기는 280 nm 흡광도를 보임. UV spectrometer 정량의 메커니즘이 됨
○ TCA cycle 미사용 아미노산 : Leu, Lys
⑥ 아미노산의 적정
○ 각 아미노산 별 pKa1, pKa2, pKaR, pI, 소수성 지표, 단백질에서의 비율과 관련
⑶ 단백질 1차 구조(the primary structure)
① 아미노산 서열
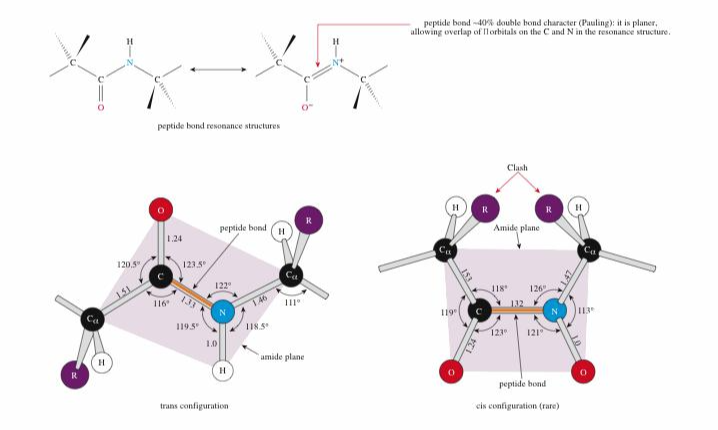
② 펩티드 결합의 평면속성(planar nature)
○ amide plane : 하나의 펩타이드 결합을 이룸. 2개의 알파 탄소와 그 사이의 C, O, N, H가 이루는 평면
○ 한 평면 내 여러 결합의 명칭

Figure. 11. 한 평면 내 여러 결합의 명칭
○ Φ 결합 : N - Cα 결합
○ ψ 결합 : Cα - C 결합
○ ω 결합 : C - N 결합
○ χ 결합 : Cα - R(작용기) 결합
○ C=O 결합은 ω 결합과 공명하면서 C=O 결합과 C-N 결합은 1.5중결합이 되어 회전이 안 되고 고정됨
⑷ 단백질 2차 구조(the secondary structure)
① 아미노산의 등뼈 간의 수소결합 (H와 O)에 의해 아미노산 서열이 입체적으로 휘는(coiling or folding) 구조
② 알파나선(α helix)

○ N 번째 아미노산의 C=O 결합과 N+4번째 N-H 결합이 수소결합을 구성
○ 실제 평균은 3.6 residues per turn (단, 편차가 있음)
○ 탄력 우수, 오른나선
○ 친수성 아미노산은 인력 및 척력이 있어 알파나선 형성을 방해함
○ 알파나선은 소수성 아미노산이 주로 형성
○ 막관통 단백질에서 자주 관찰
○ Gly : 작용기 R이 수소이기 때문에 크기가 작아 알파나선 구조를 생성하기 부적절
○ Pro : 이미노기를 형성하여 수소결합 제한 → 알파나선 구조 미형성
③ 베타병풍(β pleated sheet) : 지그재그(zig zag) conformation이라고도 함

○ 특징 : 아미노산 내 수소결합뿐만 아니라 아미노산 사슬 간의 수소결합도 존재함
○ 실크와 같은 섬유성 단백질에서 자주 나타나는 구조
○ 거미줄은 β 병풍 구조에 α 나선이 첨가된 구조
④ 라마찬드란 조사구(Ramachandran plot)
○ Φ 결합을 가로축, ψ 결합을 세로축으로 도시한 2차원 입체구조 표시 방법
○ 알파나선 구조는 (-60°, -60°)에 집중 분포. 베타병풍 구조는 (-120°, 120°)에 집중 분포
○ 용도 : 잔기가 적절한 위치에 있는지 보는 것. 조사구 상에 섬이 많으면 적절한 위치에 없는 것
○ 예시

Figure. 15. 라마찬드란 조사구 예시
⑸ 단백질 3차 구조(the tertiary structure)
① 폴리펩타이드의 전체 입체구조
② R기 간의 상호작용으로 인해 서로 다른 입체구조를 갖게 됨. 입체구조의 차이는 성질의 차이를 결정
③ 이온결합(ionic bond)
④ 공유결합(covalent bond)
⑤ 이황화결합(disulfide bridge) : 입체구조가 보다 단단하게 고정될 수 있음
○ 환원제 : 이황화결합을 자름. β-mercaptoethanol, DTT(dithiothreitol) 등
○ 진핵세포는 조면소포체에서. 원핵세포는 세포질에서 PDI(protein disulfide isomerase)가 형성
○ 안핀센 실험(Anfinsen's experiment)
○ NEM(N-ethylmaleimide) : 이황화결합에 참여하지 않는 시스테인의 -SH기에 공유결합
○ DTT(β-metcaptoethanol 포함) : -S-S- → -SH + HS-. 이황화결합을 끊는 환원제로 기능. 글루타티온(GSH)도 유사 기능
○ NEM* → DTT → NEM : 처음에 SH기로 존재했던 것 정량. 단 *는 방사성 동위원소
○ NEM → DTT → NEM* : 처음에 -S-S-로 존재했던 것 정량. 단 *는 방사성 동위원소
○ 결론 1. 단백질의 변성요인이 제거되면 단백질은 원래 구조를 찾아감
○ 결론 2. 이황화결합은 입체 구조 생성에 비가역적으로 기여하기 때문에 섬세하게 조절돼야 함
⑥ 소수성 상호작용(hydrophobic interaction) : 생체 환경이 물이기 때문에 발생한 힘
⑦ 극성 결합 및 R기 간 수소결합
⑧ 반데르발스 힘(van der Waals force)
⑨ 기타 상호작용
○ C=O 결합의 유사 수소결합 : n → π*, 단백질 잔기의 45% 이상
○ π-π stacking : aromatic ring stacking
○ 입체장애(steric hindrance)
○ C5 hydrogen bonds in β-sheet backbone
○ cation-π interaction
⑩ 특정 상호작용이 강해서 단백질이 잘못 접힐 수 있어 샤페로닌(chaperone) 등의 단백질 조립 단백질 필요
○ 예 1. heat shock protein : 온도에 의해 단백질이 변성되는 것을 막아줌
⑹ 단백질 4차 구조(the quaternary structure) : 3차 구조 폴리펩타이드 간 상호작용
① transthyretin(4 합체), 헤모글로빈(α2β2), 콜라겐(3 helix)
⑺ 단백질 구조 결정법
① 1차 구조의 결정
○ 방법 1. 에드만 시약(Edman degradation)
○ 약알칼리에서 폴리펩티드 N말단에 결합하여 아미노산을 하나하나씩 분해함
○ N-terminal에서 약 10개 정도의 아미노산만 알 수 있음
○ 굉장히 전통적인 방법으로 현재는 거의 쓰고 있는 사람이 없음
○ 방법 2. 펩티데이스
○ 엔도펩티데이스와 엑소펩티데이스를 적절히 조합하여 아미노산을 적절하게 분해하여 하나씩 결정
○ 엔도펩티데이스 : 펩신, 트립신, 키모트립신 등
○ 엑소펩티데이스 : 카르복시펩티데이스 등
○ 방법 3. Ab array
○ 방법 4. mass spectrometry
○ 1st. electrophoresis & DNA ladder : pure인지 mixture인지 알 수도 있음
○ 2nd. 트립신 처리
○ 3rd. 1차 mass spectroscopy : MS spectrum 구성
○ 4th. 2차 mass spectroscopy : MS/MS spectrum 구성. tandem MS, MS/MS, fragmentation이라고도 함
○ 5th. 스펙트럼을 통한 재구성 : informatics의 영역
○ 위 방법은 1세대 기술로서 post-translational modification을 고려하면 훨씬 절차가 복잡해짐
② 2차 구조의 결정
○ 방법 1. 원형편광이색성(circular dichroism, CD)
○ 방법 2. 적외선 분광법 : 유연한 펩타이드 및 단백질 구조를 조사할 때 유용
○ 방법 3. 분자동역학 시뮬레이션
③ 3차 및 4차 구조의 결정
○ 방법 1. X-ray crystallography : 약 90%가 이 방법으로 결정됨. 원자들의 3차원 좌표를 유추할 수 있음
○ 방법 2. NMR : 약 9%가 이 방법으로 결정됨
○ 방법 3. cryo-EM
○ 해상도가 낮지만 꾸준히 발전하고 있으며 캡시드, 아밀로이드와 같은 큰 단백질 복합체에 유용함
○ -200 ℃로 온도를 낮춰서 단백질을 정지시킨 뒤 단백질의 3D 구조를 관찰
⑻ 단백질 변성(denaturation)
① 변성(denaturation) : 염의 농도, pH, 고온 등으로 입체구조가 달라져서 기능을 상실
6. 생체고분자 3. 지질(lipid) [목차]
⑴ 특성
① 대부분이 탄소와 수소로 구성되어 있어 에너지 함량이 높음
② 소수성 (hydrophobic) : 물에는 녹지 않고, 아세톤, 알코올, 벤젠 등에는 용해됨
③ 단열효과(예 : 피하지방층), 절연효과, 방수효과
⑵ 지방(fat) : 3개의 탄화수소가 풍부한 지방산 꼬리가 에스테르 결합으로 연결된 글리세롤(triglyceride)
① 에너지 함량 : 9 kcal/g
② 소화효소인 라이페이스는 에스테르 결합을 끊음 (ref)
③ 지방산은 아세틸 coA를 재료로 생합성되기 때문에 짝수 개의 탄소로 구성
④ 포화 지방산 (saturated fatty acid) : 수소가 포화된 지방산으로 모두 단일 결합. 상온에서 고체, 동물성
⑤ 불포화 지방산 (unsaturated fatty acid) : 이중 결합(cis 결합)이 1개 이상. 상온에서 액체, 식물성 + 생선
⑥ 버터와 마가린
○ 버터(butter) : 우유에서 얻은 포화 지방
○ 마가린(margarine) : 식물에서 얻은 불포화 지방에 수소를 첨가하여 포화 지방으로 만든 것
⑦ 트랜스 지방 (trans fat) : 수소 첨가 반응 중에 수소가 들어갔다 나가면서 trans 이중결합이 생긴 것
○ 트랜스 지방은 쌓임성이 있어 끓는점이 높음
○ 트랜스 지방은 쌓임성이 있어 체내에 축적되므로 health risk 존재

Figure. 16. 지방산 꼬리에서의 cis 결합, trans 결합
⑶ 스테로이드 : 3개의 육각 고리와 1개의 오각 고리로 구성된 판형 구조의 소수성 물질
① monomer가 없이 (콜레스테롤로부터) 유도된 지질
② 합성 스테로이드(anabolic steriod)의 문제점
○ 기분의 두드러진 변화(violent mood swings)
○ 우울, 간 손상, 고콜레스테롤, 고혈압
③ 콜레스테롤 : 일부 동물 세포막에서 발견
○ -OH기가 있는 스테로이드를 지칭
○ 기능 1. 동물 세포막의 유동성 조절
○ 기능 2. 여러 물질의 전구체 : 담즙염, 스테로이드 호르몬(성호르몬, 부신피질호르몬 등), 비타민 D
○ 기능 3. 신경 보호막 구성
○ 체내에 산화하여 에너지를 내지 않음
○ 75 %의 콜레스테롤은 합성을 통해 얻어짐. 25 %의 콜레스테롤은 섭취를 통해 얻어짐
○ 콜레스테롤은 계란 노른자, 간, 오징어 등 동물성 식품에 많고 하루에 300 mg 이하를 섭취하는 게 좋음
○ 동맥경화나 심장병을 유발할 수 있음
④ 스테롤 : 일부 식물 세포막에서 발견
⑤ 성호르몬(estradiol, androgen)

Figure. 17. 성호르몬의 예시
⑷ 인지질 = 1 × 인산 머리군 + 1 × 글리세롤 등뼈 + 2 × 지방산 + 에스테르 결합, 인지질 이중층 구성, 양친매성
① 수용액 내 인지질 형태
○ 미셀(micelle) : 구형 형태. 단일층. 1개의 지방산, 소수성 물질을 혈관을 통해 운반시 미셀로 포장해서 운반
○ 리포솜(liposome) : 링 형태. 이중층. 2개의 지방산, 약물 전달(drug delivery)에 응용
② 인지질 다양성 및 막 비대칭성 : 인산기에 붙는 분자의 종류
○ 레시틴(lecithin) : 가장 대표적인 인지질. 글리세린 인산을 포함하며 피부에 윤기를 더해줌. 체내 오래 잔류

③ 인지질 이중층 : 세포의 소수성 경계 형성, 반투과성 막
④ 고세균은 극한 환경 적응을 위해 인지질 내 지방산 결합이 에스테르(-RCOO-)가 아닌 에테르(-ROR-) 결합
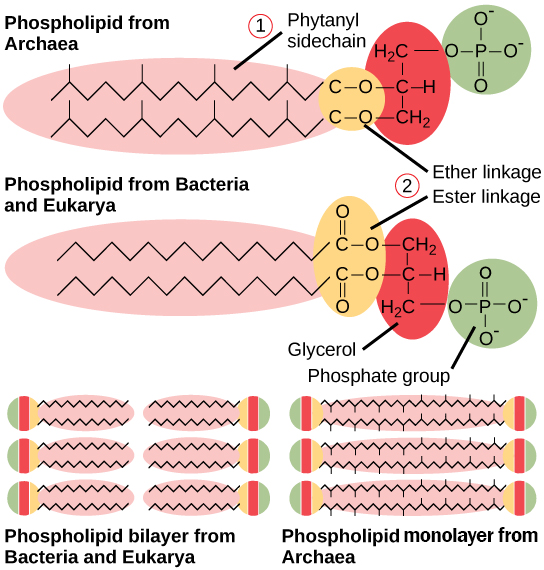
Figure. 19. 고세균의 인지질과 진정세균 및 진핵생물의 인지질의 차이
⑸ 왁스(wax)
① 지방산과 탄화수소의 길이가 긴 알콜 사이의 에스테르 결합
② CH2의 수가 40 ~ 60개
③ 수분의 출입 방지
④ 식물뿌리의 내피세포벽에 왁스로 침전된 카스파리안선(Casparian strip)은 물의 수송을 통제
⑹ 지용성 비타민 : A, D, E, K
⑺ 카로틴 류
① 광에너지를 포착하는 보조색소
② 주요 반응 : β-카로틴 + O2 → 2개의 비타민 A
7. 생체고분자 4. 핵산 : 뉴클레오티드 중합체 [목차]
⑴ 뉴클레오티드 = 인산 + 뉴클레오시드(예 : cytidine, uridine, thymidine) = 인산 + 당 + 질소 염기
① 당 : 5탄당(pentose)
○ 리보오스(ribose) : 2' 탄소가 -OH기, 반응성이 강함
○ 디옥시리보스(deoxyribose) : 2' 탄소가 -H, 반응성이 떨어짐
② 질소염기(base)
○ 탄소와 질소의 공유결합으로 된 염기성 고리구조, 질소의 비공유전자쌍이 H+ acceptor로 작용
○ 염기라는 것은 산·염기반응의 그 염기를 지칭하는 것임
○ 방향족성을 가지므로 260 nm 흡광도를 가짐
○ 단백질 내 페닐기는 280 nm 흡광도임을 주의
○ 핵산순도 := 260 nm 흡광도 / 280 nm 흡광도 = 핵산의 양 / 단백질 총량
○ N-glycosidic bond : 5탄당과 염기의 질소 원자 사이의 결합, 5탄당의 1번 탄소가 결합에 참여함
○ 질소염기는 소수성 방향족 고리를 포함하기 때문에 친수성 환경을 피해 이중나선 내부에 위치함
○ DNA에 비해 이중나선을 구성하지 못하는 RNA는 안정하지 못함
③ 3인산(3 phosphate)
○ 고에너지 인산결합을 2군데 포함한 구조로 에너지 공급
○ 3인산은 이중나선 바깥쪽에 위치함
○ 이유 1. DNA는 2인산 에스테르 결합으로 중합반응을 수행하므로 DNA 중합효소가 접근 가능해야 함
○ 이유 2. 3인산은 친수성 물질이기 때문에 이중나선 바깥쪽에 위치하려고 함
④ 뉴클레오티드의 종류
○ 피리미딘(pyrimidine) : 단일고리 염기, 3종류
○ 사이토신(C, cytosine)
○ 티민(T, thymine)
○ 우라실(uracil)
○ 퓨린(purine) : 이중고리 염기, 3종류
○ 구아닌(G, guanine)
○ 아데닌(A, adenine)
○ 이노신산(I, inosinic acid)
⑵ 폴리뉴클레오티드
① 인산 - 2 에스테르 결합(phosphodiester bond) : 뉴클레오티디드 첫 번째 당의 3'-OH와 두 번째 당의 5'-ⓟⓟⓟ 간 일어나는 탈수축합
② 5'-3'으로 중합이 이루어지며 흡열 반응이고 3인산 중 2 분자의 피로인산(pi)가 이탈되면서 에너지 공급
③ 5' 말단에는 γ phosphate라는 free phosphate가 노출돼 있음
⑶ DNA(deoxyribonucleic acid)
① 기능 : 유전정보 저장, RNA 전사
② pH 증가 : pH가 10 이상인 경우 수소결합을 형성하는 수소가 해리됨에 따라 이중가닥이 단일가닥으로 분리
③ 온도 증가 : 폴리뉴클레오타이드의 운동에너지가 가닥 간 수소결합을 깨어 단일가닥으로 분리
④ Tm : 이중가닥 DNA 50 %가 단일가닥 DNA로 바뀌는 온도
○ G≡C 비율이 클수록 결합력이 강하므로 Tm 상승
○ 첨가된 NaCl의 양이 클수록 인산기 간 척력을 상쇄하므로 Tm 상승
○ pH가 지나치게 낮은 경우 : H+가 수소결합을 방해하여 Tm 감소. 강산에서 DNA와 RNA 모두 분해
○ pH가 지나치게 높은 경우 : DNA의 이중가닥이 단일가닥으로 분리
⑤ 재생역학 : DNA 이중나선 변성 후 복원정도를 연구
○ 반복서열의 빈도수가 높을수록 제일 먼저 변성(ds DNA → ss DNA)되고 제일 먼저 재생됨
○ 고빈도 반복서열 예 : 동원체
○ 중빈도 반복서열 예 : 텔로미어
⑥ DNA 흡광도 실험
○ 260 ㎚에서 흡광도가 1일 때 dsDNA의 농도는 50 μg / ㎖
○ 260 ㎚에서 흡광도가 1일 때 ssRNA의 농도는 40 μg / ㎖
⑦ 호열균 : G≡C↑, 히스톤↑, 초나선 구조
⑷ RNA(ribonucleic acid)
① 기능 : 유전정보 전달, 폴리펩티드 생성
② pH 증가 : RNA 2'-OH기의 H+ 해리 → 수화 → 가수분해, RNA가 조각조각 남
③ 환형 RNA는 선형 RNA보다 안정성이 더 높음
⑸ DNA와 RNA 비교
| 항목 | DNA | RNA |
| 상보성 | O | X |
| 당 | 디옥시리보스 | 리보오스 |
| 염기 | A, T, G, C | A, U, G, C |
| 가닥 수 | 이중가닥 | 단일가닥 |
| 수소 결합 | A=T, G≡C | A=U, G≡C |
| 당-인산 등뼈 | 역평행사슬 |
Table. 2. DNA와 RNA의 비교
① 상보성 : 한 쪽의 정보가 손상되더라도 다른 쪽의 정보를 이용해 복원 가능한 성질
② 당 : 디옥시리보스는 2번 탄소에 -H기가 붙어 있음. 리보오스는 2번 탄소에 -OH(반응성↑)기가 붙어 있음
③ RNA의 불안정성
○ 리보오스 : 2'-OH기로 인해 반응성이 큼
○ 단일나선 : 교정 및 수선이 불가. 외부 물질에 영향을 받기 쉬움
○ 탈아미노 과정 : 아미노 염기인 A와 C가 탈아미노 과정을 거칠 수 있음
○ C 염기의 아미노기 상실 : U 염기가 됨. A 염기는 I가 됨
○ DNA는 교정 가능하나 RNA는 교정 불가

Figure. 20. 사이토신의 탈아미노화
○ pH 증가로 인해 RNA가 가수분해됨
⑹ 진핵생물의 염색질
① 유전 물질로서의 DNA
○ 1871년 Fredrich Miescher가 최초로 핵 내의 DNA를 보고
○ 증거 1. 샤가프의 법칙 : [A] = [T], [G] = [C]
○ 증거 2. X선 회절 분석 : 로잘린 프랭클린(Rosalind Elsie Franklin)의 회절 연구가 DNA 구조를 밝히는 데 중요한 역할을 하였음

Figure. 21. DNA의 3차원 회절 무늬
○ 왓슨과 크릭의 결론

Figure. 22. 프란시스 크릭이 스케치한 DNA의 구조

② DNA의 구조
○ 주홈(major groove) : 인산기가 노출돼 있지 않음. 전사인자나 효소가 접근하기 용이
○ 부홈(minor groove) : 인산기가 노출돼 있음. 히스톤 단백질이 접근
○ B형 DNA : 왓슨-크릭 모델(즉, 생체 내 DNA). 높은 상대습도(92 %)
○ A형 DNA : 탈수환경(75 %)
○ 예 : 이중나선 RNA, DNA-RNA 이중나선(hairpin, stem loop)
○ Z형 DNA : 지그재그형·홀쭉함.
○ 예 : 발현되지 않는 프로모터, G≡C 비율이 높은 지역 (e.g., 동원체)
○ DNA 형태별 비교 종합
| A형 | B형 | Z형 | |
| 나선모양 | 오른나선 | 오른나선 | 왼나선 |
| 직경 | 2.37 nm | 2.55 nm | 1.84 nm |
| 1회전 당 염기쌍 | 11 bp | 10 bp | 12 bp |
| 염기쌍 간격 | 0.26 nm | 0.34 nm | 0.37 nm |
| 나선축에 대한 염기 경사 | 20° | 6° | 7° |
Table. 3. DNA 형태별 비교

Figure. 24. A형 DNA (왼쪽), B형 DNA (가운데), Z형 DNA (오른쪽)
③ RNA의 구조 : 3차원 구조를 갖는 대부분의 RNA는 150 nt 미만의 길이를 가짐
④ 뉴클레오좀(nucleosome, beads-on-a-string, bead-on-string) : 10 ㎚ 섬유라고도 함
○ 구조
○ 146 bp DNA가 히스톤 8량체(즉, H2A, H2B, H3, H4가 한 쌍씩 존재)를 1.65 바퀴 회전
○ 링커 DNA : H1 ~ H1까지를 지칭. 200 뉴클레오티드
○ 엔도뉴클레아제를 처리하면 H1 ~ H1까지 잘림 → 전기영동으로 확인 가능
○ H1 : 뉴클레오좀 구조 조정. 한 개의 뉴클레오좀 당 한 개. 염색질 응축에 관여
○ 히스톤과 DNA 결합
○ 히스톤의 아미노산 중 20% 이상이 양전하를 띠는 염기성 아미노산 (예 : Lys, Arg)
○ 인산기가 있어 음전하를 띠는 DNA와 양전하의 히스톤 단백질 간 이온결합
○ 히스톤 꼬리 : 뉴클레오솜에 있는 히스톤 분자의 N 말단이 바깥으로 돌출된 것
○ 히스톤 수식
⑤ 30 ㎚ 섬유 : 10 ㎚ 섬유가 한 번 감기고 접힌 구조

Figure. 25. 30 ㎚ 섬유
⑥ 300 ㎚ 섬유 : 30 ㎚ 섬유가 단백질 비계를 중심으로 고리형태로 부착된 형태
⑦ 염색질
○ 염색질의 종류
○ 종류 1. 진정염색질 : 응축이 안 된 염색질
○ 종류 2. 이질염색질 : 응축된 염색질. 일반적으로 염색체의 동원체, 텔로미어가 이질염색체 형태로 존재
○ 염색질의 구조
○ TAD(topologically associating domain) : 염색질이 루프를 형성한 것
○ TAD의 실제 형태는 실타래처럼 복잡하게 얽히고 섥힌 형태임
○ CTCF(11-zinc finger protein, CCCTC-binding factor) : CTCF 유전자가 암호화하는 전사인자
○ CTCF와 PDS5A/B가 TAD의 경계와 loop anchor를 결정함
○ WAPL(코헤신을 염색체에서 방출하는 역할)과 PDS5A/B는 루프의 길이를 결정함
⑧ 염색체 : 염색분체 하나의 폭이 700 ㎚

Figure. 26. 뉴클레오좀에서 염색체까지
⑺ 다사염색체(거대염색체, polytene chromosome)
① 요건 1. 유사분열과 관련
② 요건 2. 핵분열, 세포질 분열 없이 (분열기 ×) DNA가 반복적으로 복제 후 (S기만 진행) 접힘상태를 유지하고 있는 거대 염색체
③ 내재복제(endoreduplication)
○ 정의 : 분열기 (M phase) 없이 반복적으로 DNA 합성을 거치는 과정. 자매염색분체를 형성하지 않음
○ 장소 : 초파리의 ovary nurse cell, follicle cell, abdominal histoblast, fat body cell, gut cell, prepupal salivary gland cell
○ 결과 : 배수체(polyploidy) 형성
④ 1,000개 이상의 동일한 DNA 분자로 구성
⑤ 염색시 어두운 밴드와 밝은 밴드가 교대로 나타남
○ 응축이 덜 된 밝은 밴드가 전사가 활발히 일어나는 부분
○ 반대로 어두운 부분은 전사가 억제되는 부분
⑥ 퍼프(puff) : 다사염색체의 밝은 밴드가 국소적으로 풀려서 팽창되어 있는 부분
○ 유전자 발현이 왕성한 영역에는 퍼프가 관찰됨
○ 발생단계에 따라, 내외부 신호에 따라 퍼프의 위치가 달라짐
⑦ 염색중앙립(chromocenter) : 염색체의 모든 DNA가 다사성인 것은 아님
○ 강력한 이질염색질의 형태로 존재하는 부분
○ 다사성을 가지지 않고 전사가 거의 일어나지 않음
○ 침샘 염색체들은 염색중앙립끼리 뭉쳐 있는 형태
○ 이런 영역에 속하는 DNA는 전체 게놈의 30% 정도이고 유전자의 밀도가 매우 낮음
○ 유전자 발현이 왕성한 영역에는 퍼프가 관찰됨
⑧ 예 : 파리목 곤충의 침샘염색체

Figure. 27. Calvin B. Bridge의 침샘염색체 스케치
○ 번데기가 되기 위해 필요한 풀(glue)을 생성하는 데 유리함
○ 침샘 염색체의 경우 1024의 다사성을 가짐
○ 침샘은 변태를 거치며 퇴화함
⑻ 솔염색체(램프브러쉬, lampbrush chromosome)
① 요건 1. 감수분열과 관련
② 요건 2. 제1감수분열에서 2가염색체가 분리되지 않아 생성
③ 특징 : 인접고리(lateral loop)

Figure. 28. 인접고리
⑼ 다핵체
① 요건 1. 유사분열과 관련
② 요건 2. 핵분열은 일어나고 세포질 분열은 안 일어남
⑽ 다배체
① 요건 1. 감수분열과 관련
② 요건 2. 콜히친을 처리하여 상동염색체 분리를 억제한 뒤 정상생식세포와 결합
③ 예 : 씨 없는 수박(3n)
⑾ 다사염색체, 솔염색체, 다핵체, 다배체의 비교
| 다사염색체 | 솔염색체 | 다핵체 | 다배체 | |
| 세포 당 DNA 양 | ⇑ | ⇑ | ⇑ | ⇑ |
| 세포 당 핵의 개수 | 정상 | 정상 | ⇑ | 정상 |
| 핵 당 염색체 수 | ⇑ | 정상 | 정상 | 정상 |
Table. 4. 다사염색체, 솔염색체, 다핵체, 다배체의 비교
입력: 2015.06.22 22:36
수정: 2024.11.27 13:11
'▶ 자연과학 > ▷ 일반생물학' 카테고리의 다른 글
| 【생물학】 3강. 세포와 물질대사 (2) | 2019.02.16 |
|---|---|
| 【생물학】 2강. 세포 이론 (0) | 2019.02.16 |
| 【생물학】 32-7강. 히드라의 재생 및 이식 (0) | 2019.01.27 |
| 【생물학】 GMO 찬반 논쟁과 안정성 평가원칙 (0) | 2019.01.25 |
| 【생물학】 28강. 해조류 (0) | 2019.01.24 |


최근댓글