25강. 생체고분자 : 단백질
추천글 : 【유기화학】 유기화학 목차
1. 특성 [본문]
2. 아미노산 [본문]
3. 단백질 1차 구조 [본문]
4. 단백질 2차 구조 [본문]
5. 단백질 3차 구조 [본문]
6. 단백질 4차 구조 [본문]
7. 단백질 구조 결정법 [본문]
8. 단백질 변성 [본문]
9. 단백질 대사 [본문]
a. 생명체의 구성
b. 생체고분자 라이브러리
1. 특성 [목차]
⑴ 구성원소 : C, H, O, N, S
⑵ 기능
① 대사작용의 효소
② 세포 내·외 구조 형성 : 생체 건량의 반을 차지
③ 근육 수축
④ 면역 기능
⑤ 호르몬이나 신호 단백질
⑥ 세포 내부로 신호전달
⑦ 막의 물질수송
⑧ 에너지 전환 및 저장 : 4 kcal/g. 주로 태아에 해당
⑨ DNA 복제, 수선 및 재조합
⑩ 전사, 번역
⑪ 단백질 운반 및 분비
⑶ 단백질 : 한 개 또는 두 개 이상의 폴리펩티드로 구성
⑷ 폴리펩티드 : 아미노산의 펩티드 결합으로 구성
⑸ 펩티드결합 : 아미노기(-NH2)와 카르복실기(-COOH)의 탈수축합반응

2. 아미노산 [목차]
⑴ 아미노산은 총 20개가 있음 : selenocysteine (Sec)까지 포함하여 21개로 보기도 함
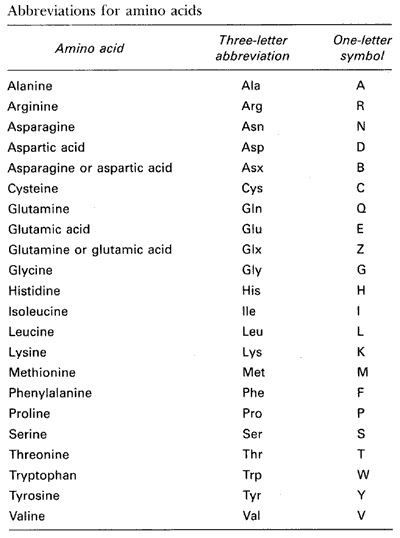
Table. 1. 아미노산의 기호
⑵ 구조 : 중심 탄소, 아미노기, 카르복실기, R기
⑶ 모든 아미노산은 동일한 등뼈를 가지고 있지만 촉쇄군(R로 표시)은 20가지 종류가 있음. 그 외는 단백질 합성 ×
① selenocysteine 등 minor한 아미노산을 합치면 그 개수가 20가지를 초과할 수 있음
⑷ 양쪽성 이온(Zwitter ion) : 산 또는 염기로 작용
⑸ 아미노산은 곁가지에 따라 성질이 달라짐
① 비극성 아미노산 : Ala, Ile, Leu, Met, Phe, Pro, Trp, Val, Gly
② 극성, 비전하 아미노산 : Asn, Cys, Gln, Ser, Thr, Tyr
③ 전하 아미노산 (+) : Arg, His, Lys
④ 전하 아미노산 (-) : Asp, Glu
⑤ -OH기 포함 아미노산 : Ser, Thr, Tyr
○ -OH기에 인산기가 첨가될 수 있어 신호전달에 이용
○ Ser, Thr : 신호전달에서 인산화 연쇄에 관여
○ Tyr : 신호전달에서 티로신 인산화효소 수용체에 존재
⑥ 황 포함 아미노산 : Cys, Met. Cys만 이황화결합 형성
⑦ 페닐기 포함 아미노산 : Phe, Trp, Tyr
⑧ 페닐기는 280 nm 흡광도를 보임. UV spectrometer 정량의 메커니즘이 됨
⑨ TCA cycle 미사용 아미노산 : Leu, Lys
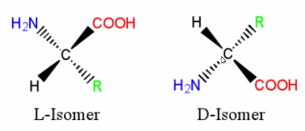
Figure. 2. 아미노산과 DL 명명법
① 중심탄소 주변에 있는 수소 치환기, 카르복실기, 아미노기, 작용기의 입체배열에 따라 위와 같이 DL 명명법이 결정됨
② 생명체에서 아미노산은 L형 이성질체로 존재함
| 아미노산 | 단축형 이름 | 분자량 | pKa1 (-COOH) |
pKa2 (-NH3+) |
pKaR | pI (등전점) |
소수성지표 | 단백질에서의 비율(%) |
| 비극성, 지방족 R기 | ||||||||
| 글라이신 | Gly, G | 75 | 2.34 | 9.60 | 5.97 | -0.4 | 7.2 | |
| 알라닌 | Ala, A | 89 | 2.34 | 9.69 | 6.01 | 1.8 | 7.8 | |
| 프롤린 | Pro, P | 115 | 1.99 | 10.96 | 6.48 | -1.6 | 5.2 | |
| 발린 | Val, A | 117 | 2.32 | 9.62 | 5.97 | 4.2 | 6.6 | |
| 류신 | Leu, L | 131 | 2.36 | 9.60 | 5.98 | 3.8 | 9.1 | |
| 아이소류신 | Ile, I | 131 | 2.36 | 9.68 | 6.02 | 4.5 | 5.3 | |
| 메싸이오닌 | Met, M | 149 | 2.28 | 9.21 | 5.74 | 1.9 | 2.3 | |
| 방향족 R기 | ||||||||
| 페닐알라닌 | Phe, F | 165 | 1.83 | 9.13 | 5.48 | 2.8 | 3.9 | |
| 타이로신 | Tyr, Y | 181 | 2.20 | 9.11 | 10.07 | 5.66 | -1.3 | 3.2 |
| 트립토판 | Trp, W | 204 | 2.38 | 9.39 | 5.89 | -0.9 | 1.4 | |
| 극성, 비전하 R기 | ||||||||
| 세린 | Ser, S | 105 | 2.21 | 9.15 | 5.68 | -0.8 | 6.8 | |
| 트레오린 | Thr, T | 119 | 2.11 | 9.62 | 5.87 | -0.7 | 5.9 | |
| 시스테인 | Cys, C | 121 | 1.96 | 10.28 | 8.18 | 5.07 | 2.5 | 1.9 |
| 아스파라진 | Asn, N | 132 | 2.02 | 8.80 | 5.41 | -3.5 | 4.3 | |
| 글루타민 | Gln, Q | 146 | 2.17 | 9.13 | 5.65 | -3.5 | 4.2 | |
| 양전하 R기 | ||||||||
| 라이신 | Lys, K | 146 | 2.18 | 8.95 | 10.53 | 9.74 | -3.9 | 5.9 |
| 히스티딘 | His, H | 155 | 1.82 | 9.17 | 6.00 | 7.59 | -3.2 | 2.3 |
| 아르지닌 | Arg, R | 174 | 2.17 | 9.04 | 12.48 | 10.76 | -4.5 | 5.1 |
| 음전하 R기 | ||||||||
| 아스파르트산 | Asp, D | 133 | 1.88 | 9.60 | 3.65 | 2.77 | -3.5 | 5.3 |
| 글루탐산 | Glu, E | 147 | 2.19 | 9.67 | 4.25 | 3.22 | -3.5 | 6.3 |
Table. 2. 각 아미노산 별 pKa1, pKa2, pKaR, pI, 소수성 지표, 단백질에서의 비율
3. 단백질 1차 구조(the primary structure) [목차]
⑴ 아미노산 서열
⑵ 펩티드 결합의 평면속성(planar nature)
① amide plane : 하나의 펩타이드 결합을 이룸. 2개의 알파 탄소와 그 사이의 C, O, N, H가 이루는 평면
② 한 평면 내 여러 결합의 명칭
○ Φ 결합 : N - Cα 결합
○ ψ 결합 : Cα - C 결합
○ ω 결합 : C - N 결합
○ χ 결합 : Cα - R(작용기) 결합
③ C=O 결합은 ω 결합과 공명하면서 C=O 결합과 C-N 결합은 1.5중결합이 되어 회전이 안 되고 고정됨
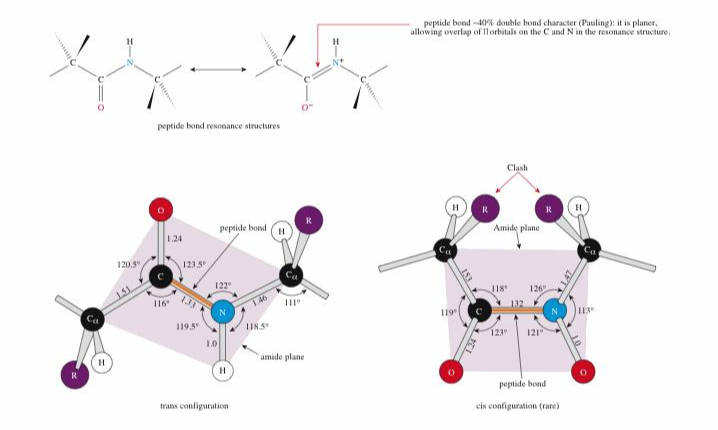
4. 단백질 2차 구조(the secondary structure) [목차]
⑴ 아미노산의 등뼈 간의 수소결합 (H와 O)에 의해 아미노산 서열이 입체적으로 휘는(coiling or folding) 구조
⑵ 알파나선(α helix)
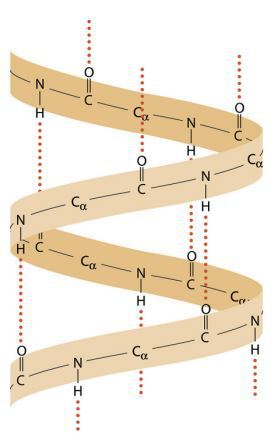
① N 번째 아미노산의 C=O 결합과 N+4번째 N-H 결합이 수소결합을 구성
② 탄력 우수, 오른나선
③ 특징 : 아미노산 골격 간 수소결합은 있지만, 아미노산 작용기 간 수소 결합은 없음
④ 친수성 아미노산은 인력 및 척력이 있어 알파나선 형성을 방해함
○ 결론 : 알파나선은 소수성 아미노산이 주로 형성
○ 막관통 단백질에서 자주 관찰
⑤ Gly : 작용기 R이 수소이기 때문에 크기가 작아 알파나선 구조를 생성하기 부적절
⑥ Pro : 이미노기를 형성하여 수소결합 제한 → 알파나선 구조 미형성
⑶ 베타병풍(β pleated sheet) : 지그재그(zig zag) conformation이라고도 함
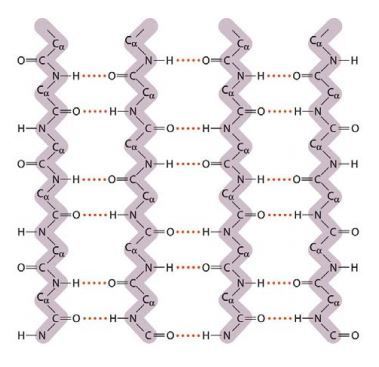
① 특징 : 아미노산 골격 간 수소결합뿐만 아니라 아미노산 사슬 간의 수소결합도 존재함
② 실크와 같은 섬유성 단백질에서 자주 나타나는 구조
③ 거미줄은 β 병풍 구조에 α 나선이 첨가된 구조
⑷ 라마찬드란 조사구(Ramachandran plot)
① Φ 결합을 가로축, ψ 결합을 세로축으로 도시한 2차원 입체구조 표시 방법
② 알파나선 구조는 (-60°, -60°)에 집중 분포. 베타병풍 구조는 (-120°, 120°)에 집중 분포
③ 용도 : 잔기가 적절한 위치에 있는지 보는 것. 조사구 상에 섬이 많으면 적절한 위치에 없는 것
④ 예시
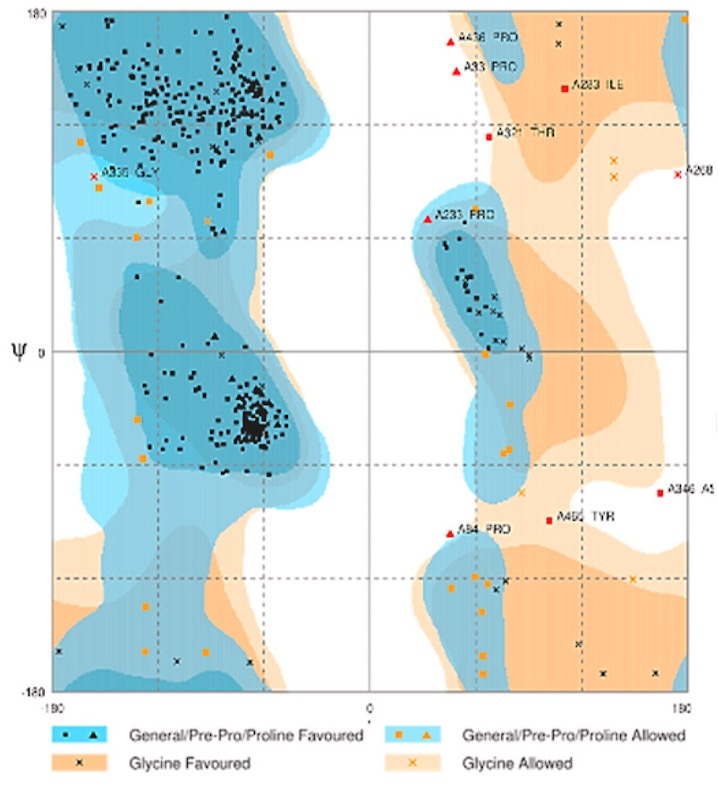
Figure. 6. 라마찬드란 조사구 예시
5. 단백질 3차 구조(the tertiary structure) [목차]
⑴ 폴리펩타이드의 전체 입체구조
⑵ R기 간의 상호작용으로 인해 서로 다른 입체구조를 갖게 됨. 입체구조의 차이는 성질의 차이를 결정
⑶ 이온결합(ionic bond)
⑷ 공유결합(covalent bond)
⑸ 이황화결합(disulfide bridge) : 입체구조가 보다 단단하게 고정될 수 있음
① 환원제 : 이황화결합을 자름.
○ 예 : β-mercaptoethanol, DTT(dithiothreitol) 등
② 진핵세포는 조면소포체에서, 원핵세포는 세포질에서 PDI(protein disulfide isomerase)가 형성
③ 안핀센 실험(Anfinsen's experiment)
○ NEM(N-ethylmaleimide) : 이황화결합에 참여하지 않는 시스테인의 -SH기에 공유결합
○ DTT(β-metcaptoethanol 포함) : -S-S- → -SH + HS-. 이황화결합을 끊는 환원제로 기능
○ NEM* → DTT → NEM : 처음에 SH기로 존재했던 것 정량. 단 *는 방사성 동위원소
○ NEM → DTT → NEM* : 처음에 -S-S-로 존재했던 것 정량. 단 *는 방사성 동위원소
○ 결론 1. 단백질의 변성요인이 제거되면 단백질은 원래 구조를 찾아감
○ 결론 2. 이황화결합은 입체 구조 생성에 비가역적으로 기여하기 때문에 섬세하게 조절돼야 함
⑹ 소수성 상호작용(hydrophobic interaction) : 생체 환경이 물이기 때문에 발생한 힘
⑺ 극성 결합 및 R기 간 수소결합
⑻ 반데르발스 힘(van der Waals force)
⑼ 특정 상호작용이 강해서 단백질이 잘못 접힐 수 있어 샤페로닌(chaperone) 등의 단백질 조립 단백질 필요
① 예 1. heat shock protein : 온도에 의해 단백질이 변성되는 것을 막아줌
6. 단백질 4차 구조(the quaternary structure) [목차]
⑴ 3차 구조 폴리펩타이드 간 상호작용
⑵ transthyretin(4 합체), 헤모글로빈(α2β2), 콜라겐(3 helix)
7. 단백질 구조 결정법 [목차]
⑴ 1차 구조의 결정
① 방법 1. 에드만 시약(Edman degradation)
○ 약알칼리에서 폴리펩티드 N말단에 결합하여 아미노산을 하나하나씩 분해함
○ N-terminal에서 약 10개 정도의 아미노산만 알 수 있음
○ 굉장히 전통적인 방법으로 현재는 거의 쓰고 있는 사람이 없음
② 방법 2. 펩티데이스
○ 엔도펩티데이스와 엑소펩티데이스를 적절히 조합하여 아미노산을 적절하게 분해하여 하나씩 결정
○ 엔도펩티데이스 : 펩신, 트립신, 키모트립신 등
○ 엑소펩티데이스 : 카르복시펩티데이스 등
③ 방법 3. Ab array
④ 방법 4. mass spectrometry
○ 1st. electrophoresis & DNA ladder : pure인지 mixture인지 알 수도 있음
○ 2nd. 트립신 처리
○ 3rd. 1차 mass spectroscopy : MS spectrum 구성
○ 4th. 2차 mass spectroscopy : MS/MS spectrum 구성. tandem MS, MS/MS, fragmentation이라고도 함
○ 5th. 스펙트럼을 통한 재구성 : informatics의 영역
○ 위 방법은 1세대 기술로서 post-translational modification을 고려하면 훨씬 절차가 복잡해짐
⑵ 2차 구조의 결정
① 방법 1. 원형편광이색성(circular dichroism, CD)
② 방법 2. 적외선 분광법 : 유연한 펩타이드 및 단백질 구조를 조사할 때 유용
③ 방법 3. 분자동역학 시뮬레이션
⑶ 3차 및 4차 구조의 결정
① 방법 1. X-ray crystallography : 약 90%가 이 방법으로 결정됨. 원자들의 3차원 좌표를 유추할 수 있음
② 방법 2. NMR : 약 9%가 이 방법으로 결정됨
③ 방법 3. cryo-EM
○ 해상도가 낮지만 꾸준히 발전하고 있으며 캡시드, 아밀로이드와 같은 큰 단백질 복합체에 유용함
○ -200 ℃로 온도를 낮춰서 단백질을 정지시킨 뒤 단백질의 3D 구조를 관찰
8. 단백질 변성(denaturation) [목차]
⑴ 변성(denaturation) : 염의 농도, pH, 고온 등으로 입체구조가 달라져서 기능을 상실
9. 단백질 대사 [목차]
⑴ 단백질 분해
⑵ 단백질 합성
입력: 2022.04.18 00:26
'▶ 자연과학 > ▷ 유기화학' 카테고리의 다른 글
| 【유기화학】 28-1강. 분광학 예제 (0) | 2023.07.06 |
|---|---|
| 【유기화학】 23강. 대사경로의 유기화학 (0) | 2023.07.02 |
| 【유기화학】 21강. 재배열반응과 고리반응 (2) | 2021.10.15 |
| 【유기화학】 전하는 말 (0) | 2020.03.24 |
| 【유기화학】 분리 정제 및 반응 (0) | 2019.02.16 |



최근댓글