3강. 순수물질의 상태량
추천글 : 【열역학】 열역학 목차
1. 순수물질 [본문]
2. 순수물질의 상 [본문]
3. 순수물질의 상변화 과정 [본문]
4. 상 변화 과정에 대한 상태량 선도 [본문]
5. 상태량 표 [본문]
6. 이상기체 상태방정식 [본문]
7. 압축성 인자 [본문]
8. 반데르발스 상태방정식 [본문]
1. 순수물질 [목차]
⑴ 순수물질 : 내부 어디서나 화학적 조성이 변하지 않는 물질
① 예 : 물, 질소, 헬륨, 이산화탄소
⑵ 순수물질은 한 가지 화학적 원소나 화합물이어야 하는 것은 아님
① 공기는 몇 가지 기체의 혼합물이지만, 화학적 조성이 균일해 순수물질로 고려됨
② 물과 기름의 혼합물은 상이한 두 개의 영역을 형성하기 때문에 순수물질이 아님
③ 순수물질의 상이 2개 이상 공존하는 혼합물은 모든 상의 화학적 조성이 같으면 순수물질임
2. 순수물질의 상 [목차]
⑴ 고체
① 고체는 분자들과 분자들을 연결하는 스프링들로 간주할 수 있음. 일정 위치가 유지됨
② 분자들 사이의 거리가 짧기 때문에 분자 간의 인력이 커서 일정한 위치에 분자를 고정시킴
③ 분자 간의 인력은 분자 사이의 거리가 너무 가까워지면 척력으로 바뀌며, 분자들이 겹치는 것을 방지
④ 고체 내부의 분자들은 상대적으로 움직일 수는 없지만, 평형 위치에서 끊임없이 진동
⑤ 분자의 진동 속도는 온도에 따라 달라짐; 충분히 높은 온도에서는 분자의 속도가 분자 간의 힘을 이기고 분자 집단이 와해되는 지점에 이를 수 있음 (융해의 시작)
⑵ 액체
① 분자들이 서로 상대적인 위치에 고정되지 않고 자유롭게 회전하거나 이동할 수 있음
② 액체에서 분자 간 힘은 고체에 비해서는 약하지만, 기체에 비해서는 상당히 강함
③ 일반적으로 고체가 액체로 변하면서 분자들 사이의 거리는 약간 증가 (예외 : 물)
⑶ 기체
① 분자들은 서로 멀리 떨어져 있고 분자들 사이의 질서는 없음
② 분자들은 서로 간에 충돌하고 담겨 있는 용기의 벽과 충돌을 계속하면서 불규칙하게 운동
③ 특히 밀도가 낮은 경우 분자 간 힘이 매우 작기 때문에 충돌은 분자들 사이의 유일한 상호작용
④ 기체 분자들은 액체나 고체 상태일 때보다 훨씬 높은 에너지 상태에 있음
⑤ 기체가 응축 또는 응결하려면 많은 양의 에너지를 방출해야 함
3. 순수물질의 상변화 과정 [목차]
⑴ 압축액, 포화액
① 압축액 : 열을 가해도 쉽게 기체 상태로 증발하지 않는 액체
② 포화액 : 열을 가하면 쉽게 기체 상태로 증발하는 액체
③ 온도 증가에 따라 액체의 물은 약간씩 팽창하여 물의 비체적은 증가
⑵ 과열증기, 포화증기
① 과열증기 : 온도를 많이 낮춰도 쉽게 응축하지 않는 공기
② 포화증기 : 온도를 조금만 낮춰도 쉽게 응축되는 증기
③ 포화액-증기 혼합물 : 상 변화가 일어나는 상태인, 액체와 증기상이 공존하는 화합물
⑶ 포화 온도, 포화 압력
① 포화 온도 : 주어진 압력에서 순수물질이 상변화하는 온도
② 포화 압력 : 주어진 온도에서 상변화하는 압력
③ 101.325 kPa의 압력에서 물의 Tsat는 99.97 ℃이고, 99.97 ℃에서 물의 Psat는 101.325 kPa임
④ 잠열 : 상변화 과정동안에 흡수되거나 방출되는 에너지
○ 융해잠열 (용융잠열) : 어는(녹는) 동안 방출되는 에너지
○ 증발잠열 (기화잠열) : 기화(응축) 동안 방출되는 에너지
○ 잠열의 크기는 상변화가 일어나는 온도나 압력에 따라 달라짐
⑤ 액체-증기 포화곡선 : Psat와 Tsat가 1 : 1 대응이므로 이를 함수 그래프로 나타낼 수 있음
⑥ Tsat와 Psat의 종속 관계
○ 대기압이 높을수록 끓는점이 높아짐 : 이탈 분자가 압력을 이기려면 더 큰 에너지가 필요하므로
○ 온도가 높은 상태여야 음식물 분자가 더 빨리 익혀지므로 끓는점이 높으면 요리시간이 단축됨
○ Psat를 일정하게 유지하려면 대기와 공기를 통하게 해 대기압으로 맞춰주면 됨
○ 진공 냉각 : 밀봉된 냉각실의 압력을 원하는 저온에서의 포화압력까지 낮추어 냉각시키고자 하는 채소로부터 일부의 수분을 증발시키는(→ 기화열 흡수) 방법
⑦ 포화압력이 높을수록 증발열이 감소함
○ (주석) 포화압력이 증가하면 포화증기도 약간 액체 느낌이라 에너지 수준이 낮음
○ (주석) 증발열의 경향성은 포화증기의 에너지 수준과 일치하므로 증발열도 감소함
4. 상 변화 과정에 대한 상태량 선도 [목차]
⑴ T-ν 선도
Figure. 1. T-ν 선도
① 특징
○ 기체상에서 압력이 클수록 기울기가 급함
○ 압력이 클수록 비등온도가 높음 (∵ 필요한 이탈 에너지가 더 커지므로)
○ 압력이 클수록 포화액의 비체적은 크고 포화증기의 비체적은 작아짐; 즉, 수평선 길이가 짧아짐
○ 임계점(critical point) : 포화액 상태와 포화증기 상태가 일치하는 점
② 수식적 분석
○ 기체 : 이상기체 상태방정식 유추해석
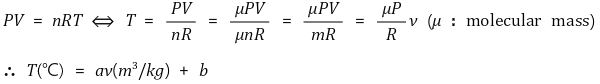
○ 액체 : 기체와 T-ν 관계가 유사함
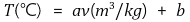
○ 상평형 구간에서 온도변화 없이 부피만 증가하므로 수평그래프가 있음
③ (참고) 임계점에서 다음 수식이 성립함 (추후 업데이트)
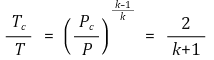
⑵ 용어
① 임계 상태 물질의 경우 임계 온도 이상에 있으면 과열증기, 임계 온도 이하에 있으면 압축액체라 함
② 포화액선, 포화증기선
Figure. 2. 포화액선, 포화증기선
○ 포화액선 : T-ν 선도에서 포화액만을 표시한 곡선
○ 포화증기선 : T-ν 선도에서 포화증기만을 표시한 곡선
○ 왼쪽 영역을 압축액 영역, 오른쪽 영역을 과열증기 영역이라고 함
○ 포화액-증기 혼합물 영역을 습 영역이라고 함
⑶ P-ν 선도
① 특징
○ 온도가 클수록 그래프가 위에 있음 (∵ a(t) < a(t + ε)이고 상평형 과정은 Tsat = f(Psat) 때문)
○ 기체상에서 온도가 클수록 기울기가 작음
○ 온도가 클수록 포화액의 비체적은 크고 포화증기의 비체적은 작아짐; 그래서 수평선의 길이가 짧아짐
② 수식적 분석
○ 이상기체 상태방정식 유추해석 : 등온과정을 전제로 함
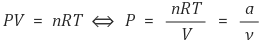
○ Tsat = f(Psat)이므로 상평형 구간에서 수평 그래프가 그려짐
⑷ 고체상태를 포함하기 위한 선도의 연장
① 응고할 때 수축하는 물질의 P-ν 선도
Figure. 3. 응고할 때 수축하는 물질의 P-ν 선도
○ P-T 선도에서는 삼중선이 점으로 나타나므로 삼중점이라고 함
○ 고체상으로부터 직접 증기상으로 변하는 것을 승화라고 함
② 응고할 때 물과 같이 팽창하는 물질의 P-ν 선도
Figure. 4. 응고할 때 팽창하는 물질의 P-ν 선도
○ 고체와 관련된 그래프를 오른쪽ㅇ으로 이동시킨 모양 (특정 압력에 더 부피가 큰 꼴)
⑸ P-T 선도
Figure. 5. P-T 선도
① 응고할 때 수축하는 물질
② 응고할 때 팽창하는 물질
③ P, T는 모두 독립변수 (⑷-① ~ ⑷-④에서 다른 ν는 종속 변수) → 이를 통해 P-ν-T 3차원 맵을 만들 수 있음
⑹ 모든 2차원 선도는 P-ν-T 표면을 P-ν면, T-ν면, 혹은 P-T면에 투영한 것
5. 상태량 표 [목차]
⑴ 엔탈피-조합 상태량
① 정의 : H ≡ U + PV (kJ) (유동에너지 고려)
② 증발엔탈피 hfg (또는 증발잠열) : 주어진 온도나 압력 하에 단위 질량의 포화액을 기화시키는 데 필요한 에너지의 양
○ 임계점에서는 증발엔탈피가 0이 됨
③ 건도 : x ≡ mvapor / mtotal, mtotal = mliquid + mvapor
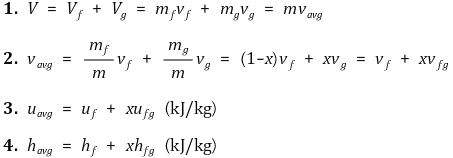
⑵ 과열증기
① 더 낮은 압력 : 주어진 T에서 P < Psat
② 더 높은 온도 : 주어진 P에서 T > Tsat
③ 더 큰 비체적 : 주어진 P 또는 T에서 ν > νg
④ 더 큰 내부에너지 : 주어진 P 또는 T에서 u > ug
⑤ 더 큰 엔탈피 : 주어진 P 또는 T에서 h > hg
⑶ 압축액
① 보다 높은 압력 : 주어진 T에서 P > Psat
② 보다 낮은 온도 : 주어진 P에서 T < Tsat
③ 보다 작은 비체적 : 주어진 P 또는 T에서 ν < νf
④ 보다 작은 내부에너지 : 주어진 P 또는 T에서 u < uf
⑤ 보다 작은 엔탈피 : 주어진 P 또는 T에서 h < hf
⑷ 기존상태와 기준값 : u, h는 절대값을 측정할 수 없음
6. 이상기체 상태방정식 [목차]
⑴ 수식화
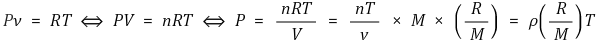
① 이때 R과 R / M을 혼용하기 위해 원래 R을 Ru, R/M을 R로 씀
⑵ 이상기체 : Pν = RT에 따라 거동하는 가상의 물질
① 공기, 질소, 산소, 수소, 헬륨, 아르곤, 네온, 크립톤, CO2 등은 이상기체로 취급할 수 있으며 오차는 1 % 이하
⑶ 수증기 : 압력이 크면 이상기체로 취급할 수 없음
⑴ 정의
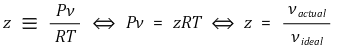
⑵ 이상기체 거동으로부터 이탈 기준
⑶ 대응상태의 원리(principle of corresponding states)
① 환산량
PR ≡ P / Pcr, TR ≡ T / Tcr (단, Pcr, Tcr은 임계량)
② 동일한 환산압력, 환산온도에서 압축성인자는 근사적으로 같음
③ 일반화된 압축성 도표
Figure. 6. 일반화된 압축성 도표
○ 매우 낮은 압력 (PR ≪ 1)에서 기체는 온도에 관계없이 이상기체로 거동
○ 높은 온도 (TR > 2)에서 기체는 PR ≫ 1을 제외하고는 압력에 관계없이 이상기체로 간주 가능
○ 이상기체로부터 벗어난 정도는 임계점 부근에서 가장 큼
④ 가환선 비체적
○ 수식화
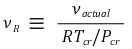
○ 반복계산에 의존하지 않고 온도나 압력을 결정할 수 있음
8. 반데르발스 상태방정식 [목차]
⑴ 수식화
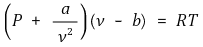
① Pideal = Pactual + a / ν2 : 분자 간 인력 고려
② νideal = νactual - b : 분자들이 차지하는 체적 고려
⑵ 임계점을 지니는 등온선이 임계점에서 변곡점을 가진다는 점에서 a, b를 수식적으로 유도 가능
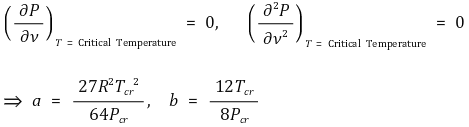
⑶ 상태량과 각 계수의 관계식
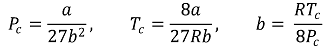
입력 : 2019.04.22 18:14
'▶ 자연과학 > ▷ 열역학' 카테고리의 다른 글
| 【열역학】 5강. 검사체적의 질량 및 에너지 해석 (0) | 2019.04.18 |
|---|---|
| 【열역학】 4강. 밀폐계의 에너지 해석 (0) | 2019.04.18 |
| 【열역학】 2강. 에너지, 에너지 전달 및 에너지 분석 (0) | 2019.04.18 |
| 【열역학】 1강. 기본 개념 (0) | 2019.04.18 |
| 【열역학】 냉장고 예제 (0) | 2016.11.05 |









최근댓글