2014 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
1. 다음은 O, Na, S 원자의 바닥 상태 전자 배치이고, 그림은 각 원자의 전자 친화도와 최외각 전자에 대한 유효 핵전하를 나타낸 것이다. ㈎ ~ ㈐는 세 원자 중 하나에 해당한다. 세 원자를 ㈎, ㈏, ㈐와 옳게 짝지은 것은?
⑴ 문제

⑵ 풀이 : ③
○ 전자 친화도 : 대체로 주기율표에서 오른쪽 위로 갈수록 큼. 2주기 원소 중 B ~ F 까지의 전자 친화도는 예외적으로 같은 족 3주기 원소보다 작음. 전자 친화도는 S가 가장 크므로 ㈏는 S
○ 유효 핵전하 : 최외각 전자의 유효 핵전하는 같은 주기에서 원자번호가 증가함에 따라 원자반지름이 작아지므로 유효핵전하 증가. 같은 족에서 전자 껍질수가 증가할수록 유효핵전하가 조금씩 증가. 유효 핵전하는 S가 가장 크므로 ㈏는 S
○ ㈎, ㈐를 결정하는 문제를 추가로 물어보는 경우 직관적으로 알칼리 금속인 Na가 O, S보다 상대적으로 낮을 것이라는 직관적인 추정을 이용할 수도 있고, O, S가 유효핵전하가 비슷할 것이라는 사실을 이용할 수도 있음 (∵ 전자 껍질수가 증가하면 유효핵전하는 조금 증가하므로)
2. 다음 세 화학종의 가장 타당한 루이스 구조를 근거로, 원자가 껍질 전자쌍 반발 이론과 원자가 결합 이론을 적용하여 설명한 것으로 옳지 않은 것은?
⑴ 문제

⑵ 풀이 : ②
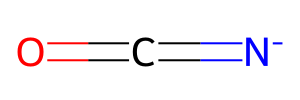
○ NCO-의 구조 : 직선형 구조. 산소의 형식 전하는 0
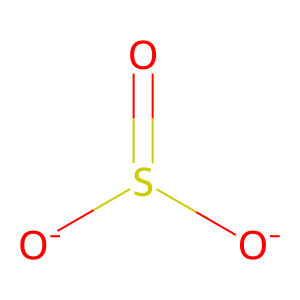
○ SO32-의 구조 : S에 비공유 전자쌍이 한 쌍 있고 S=O 결합은 S+-O-가 되므로 삼각 피라미드 형태를 지님
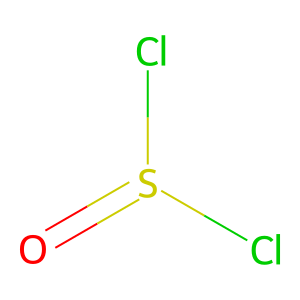
○ SOCl2의 구조 : S의 혼성은 sp3 (삼각 피라미드). SOCl2는 사실상 S+O-Cl2로 존재하므로 산소의 형식 전하는 -1이 됨
3. 그림은 H의 1s와 F의 2p 원자 궤도함수의 에너지 준위를 나타내며, 점선 안의 영역 ㈎는 이 원자 궤도함수로부터 형성되는 모든 분자 궤도함수만을 포함한다. HF의 두 원자는 z축 상에 놓여 있다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ④
○ ㄱ : H 원자가 F 원자보다 전기음성도가 낮으므로 에너지 수준이 높음. 따라서 1차 이온화 에너지 = E∞ - E는 F 원자가 더 큼
○ ㄴ : ㈎에는 F의 2p 오비탈과 동일한 에너지의 비결합 오비탈(non-bonding orbital) 2개, F의 2p 오비탈보다 에너지가 낮은 결합 오비탈(bonding orbital) 1개, F의 2p 오비탈보다 에너지가 높은 반결합 오비탈(anti-bonding orbital) 1개 등 총 4개의 오비탈이 있음
○ ㄷ : HF의 두 원자가 z축 상에 놓여 있으므로 맞는 설명
4. 그림은 철(Fe)의 상평형도이고, 1개의 액체상과 4개의 고체상을 나타내며, a는 상전이의 방향을 나타낸다. 제시된 온도와 압력 범위에서 나타나는 철의 물리적 성질에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제
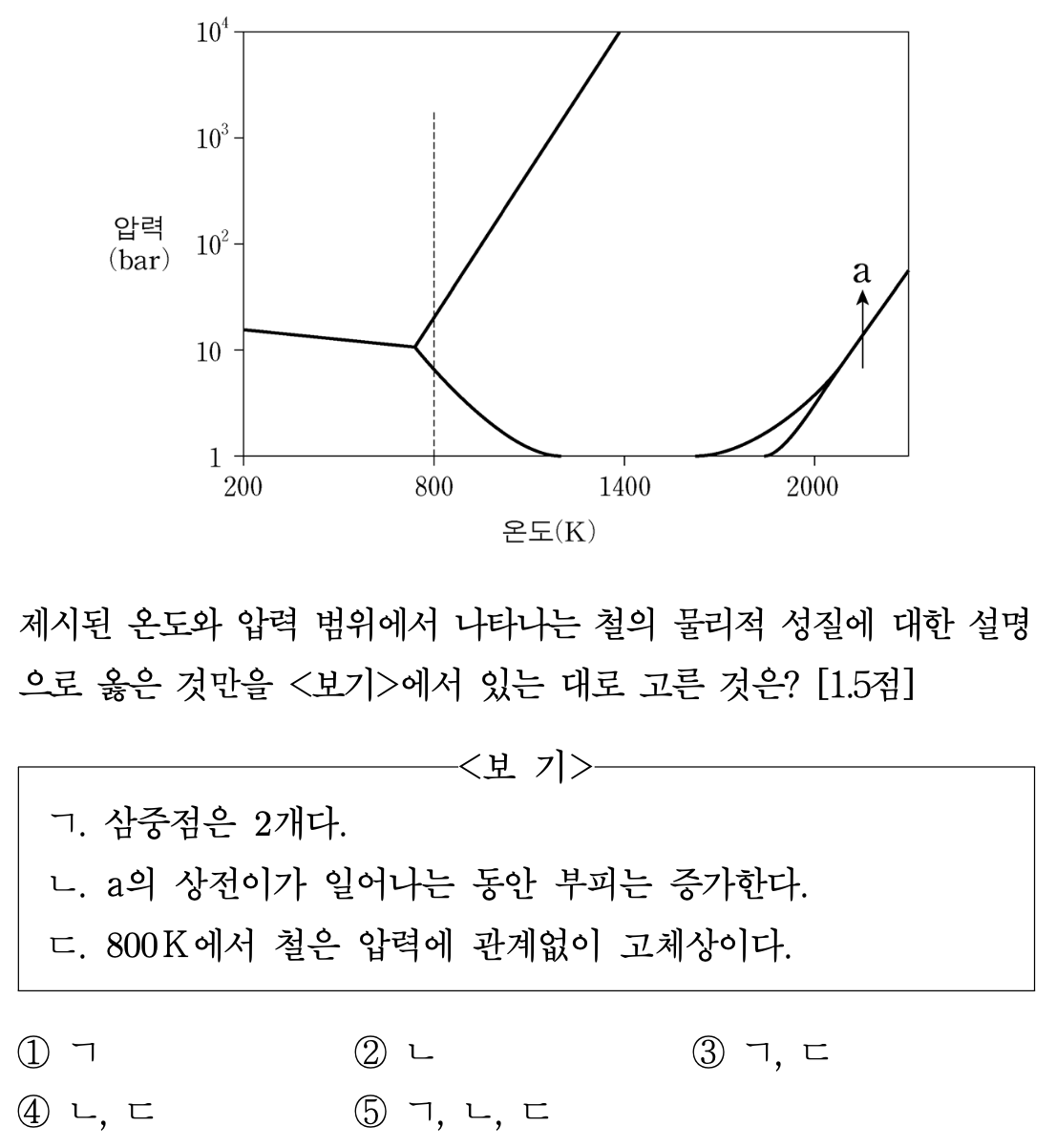
⑵ 풀이 : ③
○ ㄱ : 삼중점은 세 개의 상이 만나는 지점으로 (~800 K, 10 bar), (2000 K, 10 bar) 등 2개가 존재함
○ ㄴ : 상도표 상에서 상평형 곡선의 기울기가 양수이므로 a의 상전이가 일어나는 동안 부피는 감소함. 대부분의 물질은 액체에서 고체가 될 때 부피가 감소하며, 거의 유일한 예외는 물이라고 할 수 있음 (물의 경우 상평형 곡선의 기울기는 음수).
○ 참고로, Maxwell 열역학 일반식에 따르면 (∂P/∂T)V = (∂S/∂V)T이고, 고체 → 액체일 때 ∂S > 0임은 타당하므로 상전이에서 부피 변화의 부호는 상도표에서 ∂P/∂T의 부호를 따라감
○ ㄷ : a의 상전이에서 반응 전 상태(고온 저압 상태)가 액체이고, 나머지 상은 모두 고체상
5. 그림은 강철 실린더의 내부를 고정된 경계막으로 분리한 후, 실린더 안에 기체를 채운 상태를 나타낸 것이다. 고정 장치를 제거하고 등온 조건에서 경계막의 이동을 허용하여 평형에 도달하게 하였을 때, 이 평형 상태에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은? (단, 기체는 이상 기체로 거동하며, 실린더 벽과 경계막을 통과하지 못한다.)
⑴ 문제

⑵ 풀이 : ④
○ 식 1. VN2 + VO2 + VNe = 12
○ 식 2. P = 3.6 / VN2 = 2.4 / VO2 = 12 / VNe
○ 변수가 3개이고 식이 3개이므로 이 식의 해는 유일하게 결정됨 : VN2 = 2.4 L, VO2 = 1.6 L, VNe = 8 L
○ ㄱ : N2의 압력은 P = 3.6 / VN2 = 3.6 / 2.4 = 1.5 atm
○ ㄴ : 맞는 설명
○ ㄷ : ρ = nμ / V (단, μ는 분자량) = Pμ / RT ∝ Pμ ∝ μ이므로 ρN2 : ρO2 : ρNe = 28 : 32 : 20
6. 다음은 이온성 고체 MX의 수용액 형성에 대한 열역학 함수 중, 격자 엔탈피(ΔH격자), 수화 엔탈피(ΔH수화), 용해 엔탈피(ΔH용해), 용해 자유 에너지(ΔG용해)에 해당하는 반응식이다. 표는 25 ℃에서 암염(rock salt) 구조를 갖는 고체에 대한 |ΔH격자|, |ΔH수화|, ΔH용해, ΔG용해를 나타낸 것이다. 이에 대한 설명으로 옳은 것은?
⑴ 문제
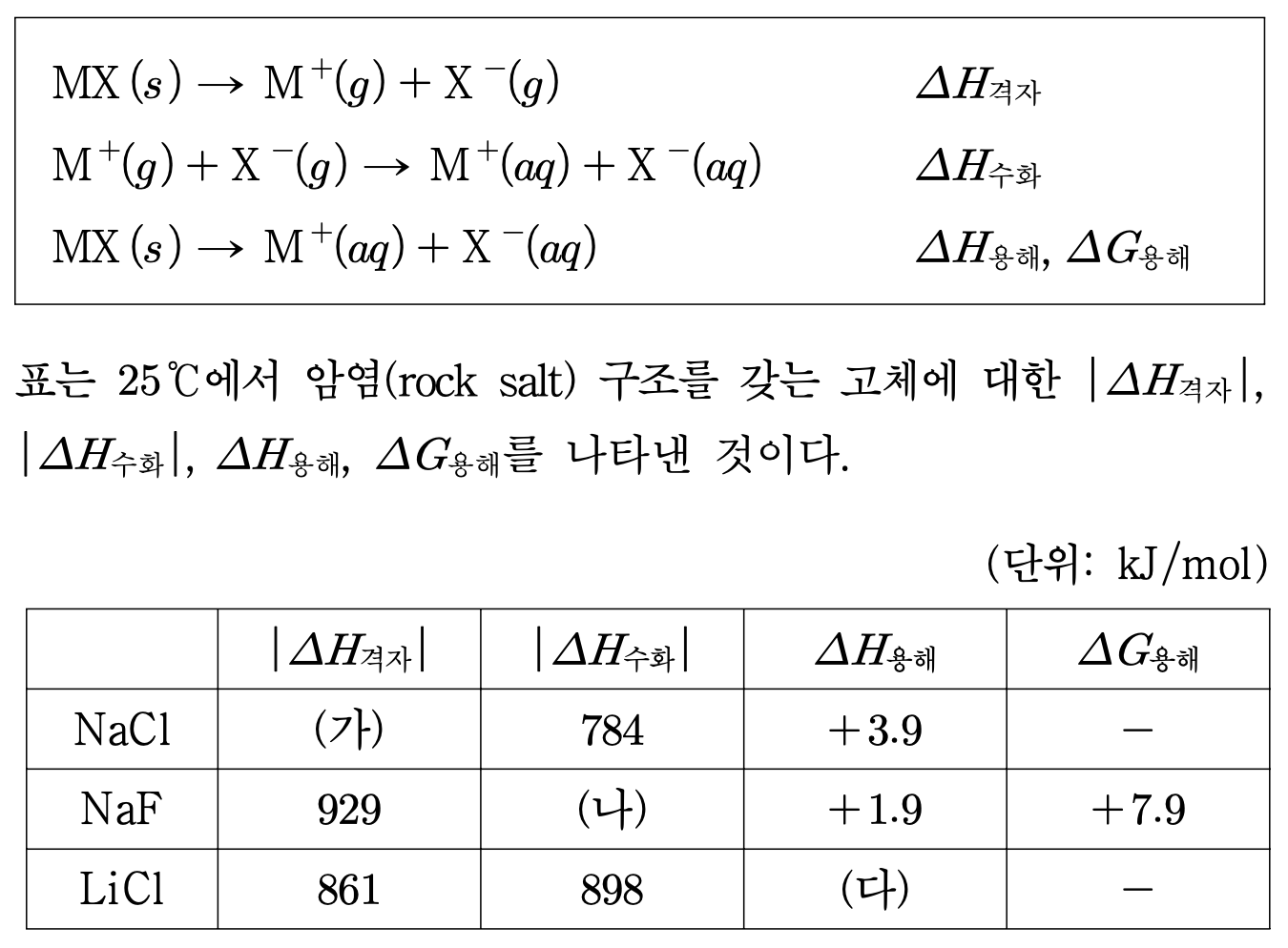

⑵ 풀이 : ⑤
① Na+는 Li+와 전하량은 같으면서 크기는 더 크므로 쿨롱 인력과 관련된 |ΔH격자|는 NaCl이 LiCl보다 작음
② F-는 Cl-와 달리 수소결합을 할 수 있어 수용액 상태에서 훨씬 안정해짐. 그러므로 |ΔH수화|는 NaF가 NaCl보다 큼
③ ΔH용해 = ΔH격자 + ΔH수화 = 861 - 898 = -37 kJ/mol
④ NaCl의 용해엔탈피는 0보다 큰 값이므로 NaCl이 물에 용해될 때 열이 흡수됨
⑤ ΔG용해 = 7.9 kJ/mol = ΔH용해 - TΔS용해 = 1.9 kJ/mol - TΔS용해로부터 ΔS용해 < 0을 얻을 수 있음
7. 다음은 Cl2와 NO가 반응하여 NOCl을 생성하는 반응식이다.
Cl2 (g) + 2NO (g) ⇄ 2NOCl (g)
부피가 같은 용기 ㈎ ~ ㈒에 각각 표에 주어진 조성의 혼합물을 넣은 후 450 K에서 평형에 도달하게 하였다. 평형 상태에서 ㈎ ~ ㈒ 중 한 용기 안의 혼합물 조성이 나머지 4개에서와 다르게 나타났다. 나머지 4개와 평형 조성이 다른 것은?
⑴ 문제
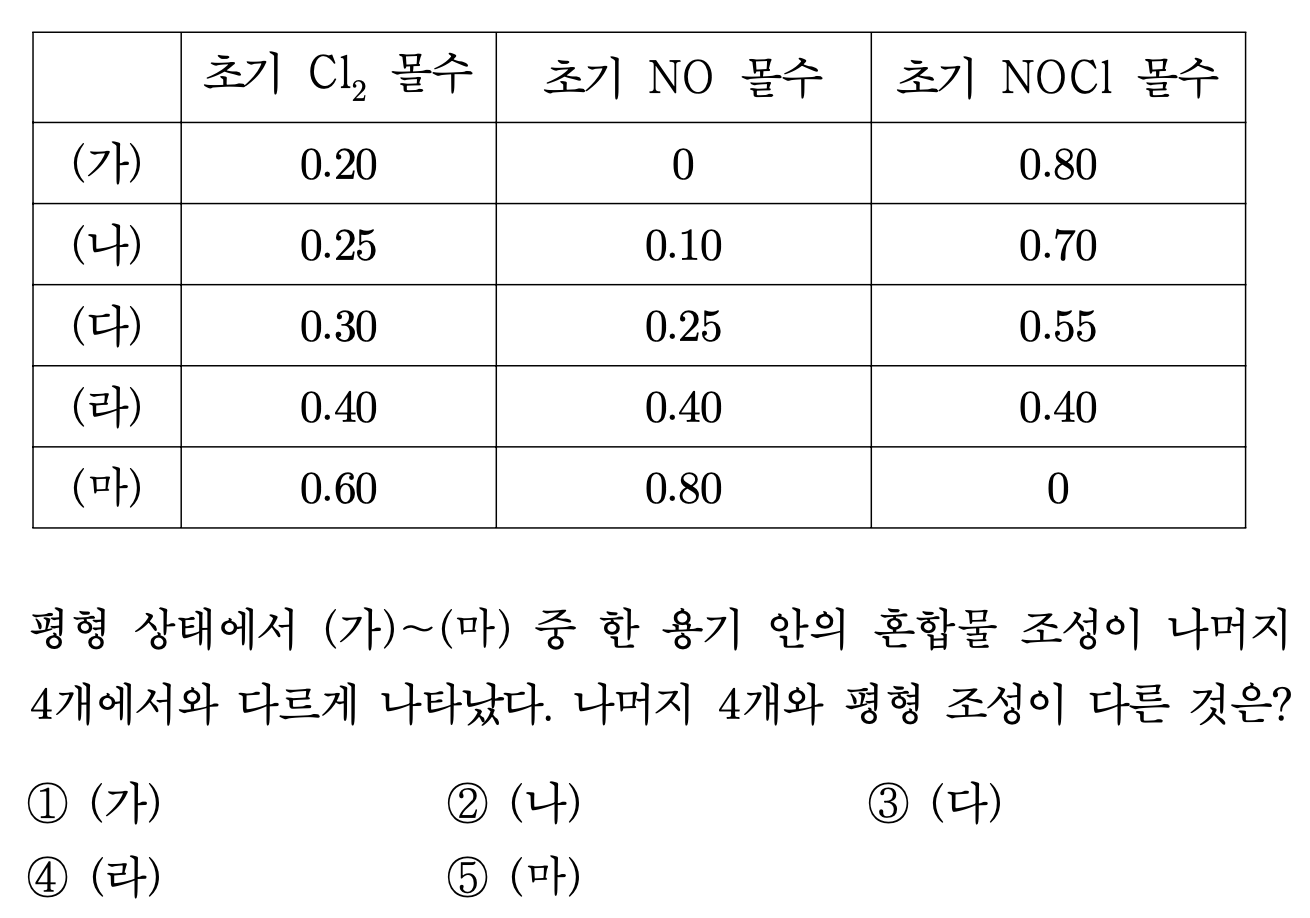
⑵ 풀이 : ③
○ 실제로 특정 평형 상태가 존재하지만, 100% 반응이 진행된다고 가정하고 몰수가 다른 용기를 찾아도 결론은 동일함 (∵ 평형 상태는 경로에 관계 없이 동일하게 결정되므로 일단 100% 반응을 진행시키고 거꾸로 돌아가게 해도 결론은 동일함. 그러므로 100% 반응을 진행시켰을 때 달랐다면 최종 평형 상태에서도 달라짐)
○ ㈎ : 최종 Cl2 몰수 = 0.20, 최종 NO 몰수 = 0, 최종 NOCl 몰수 = 0.80
○ ㈏ : 최종 Cl2 몰수 = 0.20, 최종 NO 몰수 = 0, 최종 NOCl 몰수 = 0.80
○ ㈐ : 최종 Cl2 몰수 = 0.175, 최종 NO 몰수 = 0, 최종 NOCl 몰수 = 675
○ ㈑ : 최종 Cl2 몰수 = 0.20, 최종 NO 몰수 = 0, 최종 NOCl 몰수 = 0.80
○ ㈒ : 최종 Cl2 몰수 = 0.20, 최종 NO 몰수 = 0, 최종 NOCl 몰수 = 0.80
8. 그림은 25 ℃에서 난용성염 AgBr과 PbBr2 각각의 포화 수용액에서의 양이온 농도 [Mn+]와 음이온 농도 [Br-]의 상관관계를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ⑤
○ ㄱ : [Ag+][Br-] = Ksp,AgBr로부터 log [Ag+] + log [Br-] = log Ksp,AgBr을 얻고, [Pb2+][Br-]2 = Ksp,PbBr2로부터 log [Pb2+] + 2log [Br-] = log Ksp,PbBr2를 얻을 수 있음. 그러므로 PbBr2 곡선은 위에 있는 곡선이므로 log Ksp,PbBr2 = -5.
○ ㄴ : 양이온 및 음이온이 과량 존재하므로 침전이 존재함
○ ㄷ : log [Pb2+] + log [CO32-] = log Ksp,PbCO3이므로 직선의 기울기는 AgBr의 직선 기울기와 같은 -1.
9. 반응 A → P에서 반응물의 초기 농도 [A]0 = 0.40 M일 때 연속적인 반감기(t1/2)를 측정하여 다음과 같은 결과를 얻었다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제

⑵ 풀이 : ③
○ ㄱ : 10 + 20 + 40 + 80 = 150분이므로 150분이 경과한 후의 반응물의 농도는 0.40 / 24 = 0.025 M
○ ㄴ : 1 / [A]t = 1 / [A]0 + kt이므로 1 / 0.20 = 1 / 0.40 + 10k ⇔ k = 0.25 M-1·min-1. 그러므로 t1/2 = 1 / k[A]0, t3/4 = 1 / 3k[A]0, t1/2 / t3/4 = 3.
○ ㄷ : t1/2 = (1 / 0.50) / 0.25 = 8분
10. 그림은 미지의 약염기 B1과 B2 각각의 수용액 50.0 mL를 1.00 M HCl로 적정할 때의 적정 곡선을 나타낸 것이다. B1과 B2의 적정에서 당량점까지 가해진 HCl의 부피는 각각 10.0 mL, 20.0 mL이다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제
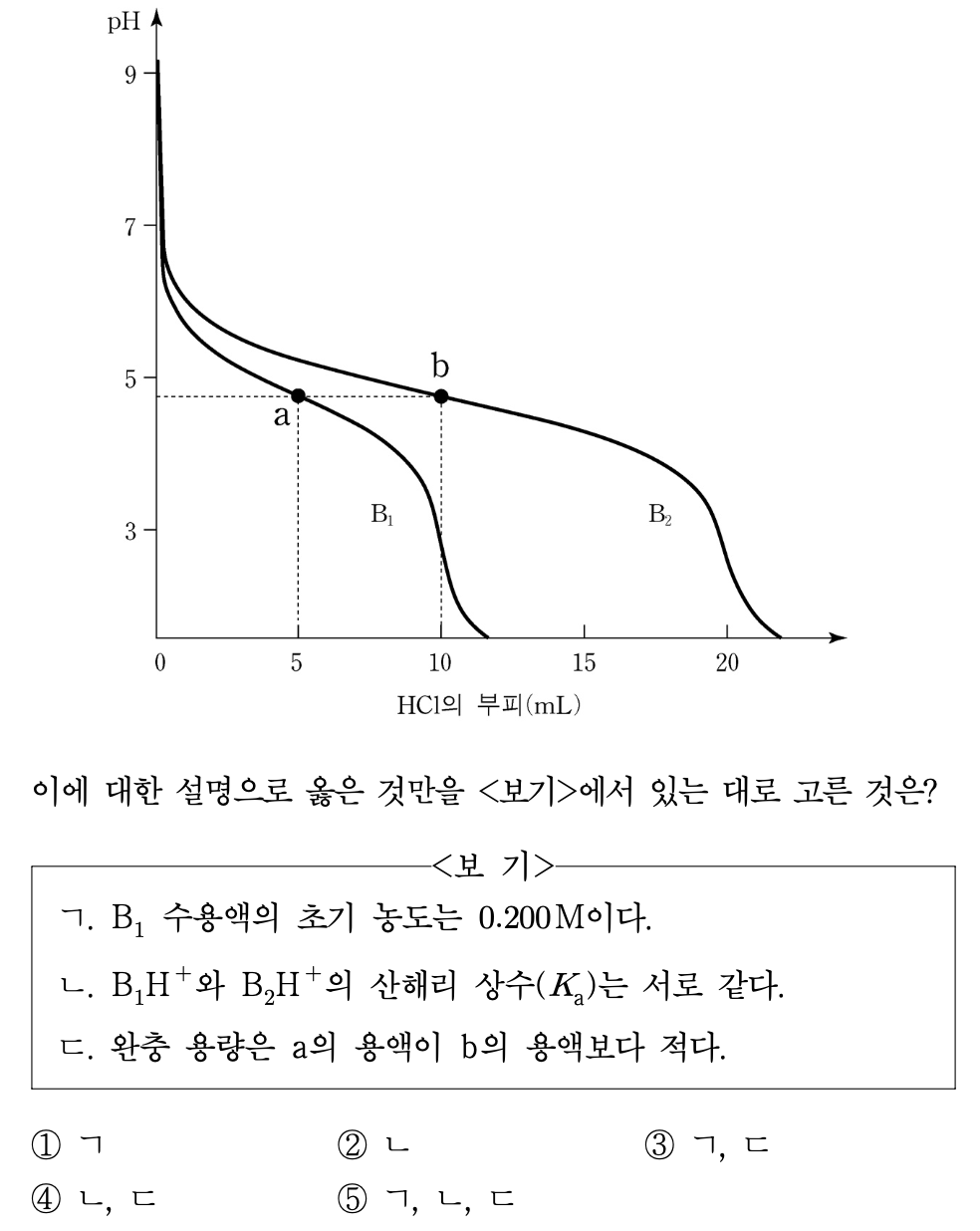
⑵ 풀이 : ⑤
○ ㄱ : 1 M HCl × 10 mL = 10 mmol = x M B1 × 50 mL ⇔ x = 0.2 M
○ ㄴ : 반당량점에서의 pH가 pKa이므로 맞는 설명
○ ㄷ : HA 및 A-의 총량이 많을수록 완충용량이 크므로 당량점까지의 부피가 큰 b의 용액이 a의 용액보다 완충 용량이 큼
11. 표는 수용액에서 몇 가지 화학종의 산해리 상수(Ka)를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제
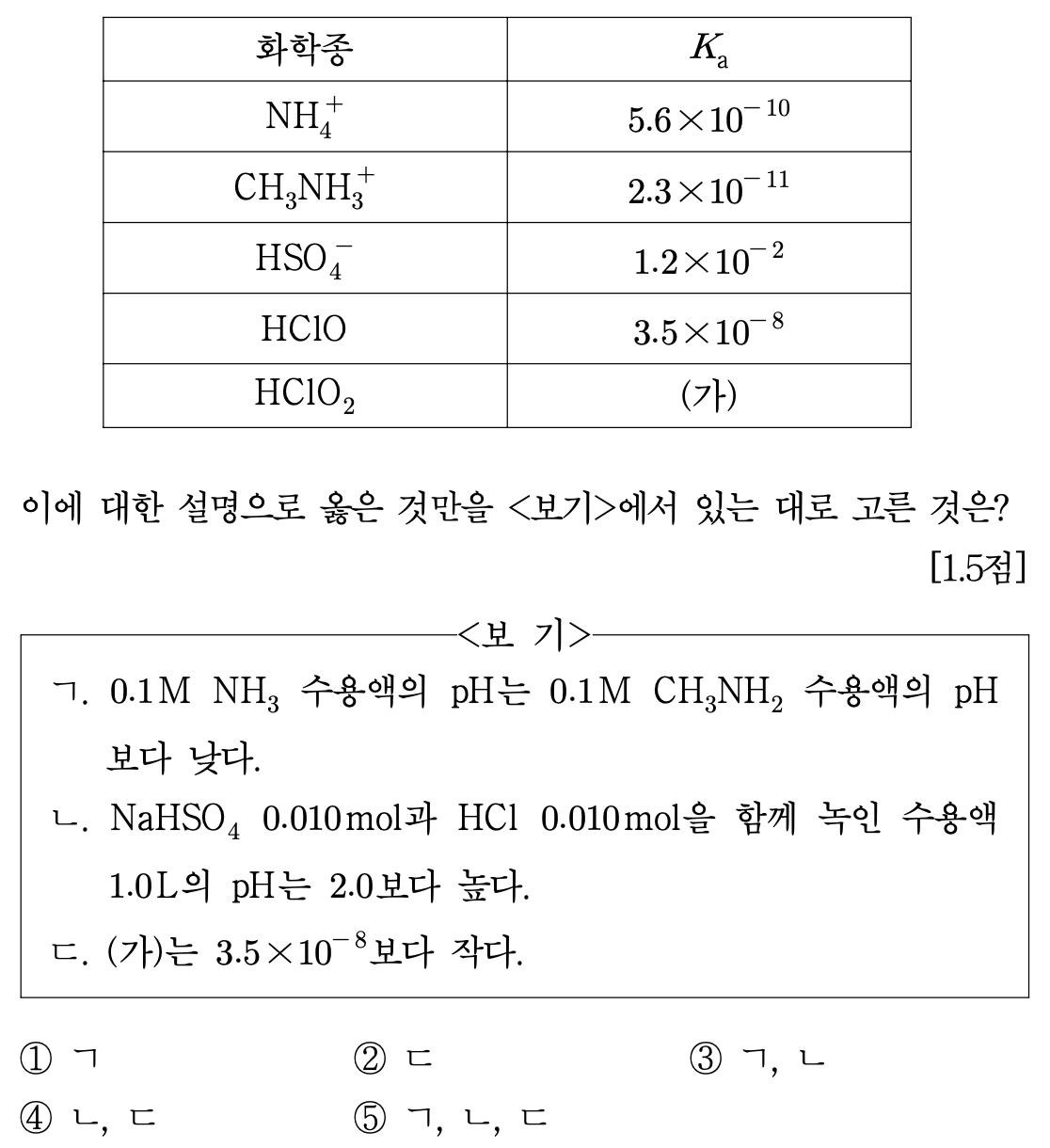
⑵ 풀이 : ①
○ ㄱ : NH4+가 CH3NH3+보다 강한 산이므로 동일한 농도의 NH3 수용액이 CH3NH2 수용액보다 더 약한 염기 (즉, pH가 더 낮음)
○ ㄴ : HCl이 0.01 mol인 상황에서 이미 pH가 2.0이므로 여기에 산성 물질을 추가로 첨가하면 pH는 2.0보다 낮아짐
○ ㄷ : 산소가 전기음성도가 크므로 Cl에 산소가 많이 치환돼 있을수록 HClOx의 산도가 증가함. 그러므로 ㈎는 3.5 × 10-8보다 큼
12. 다음은 용융된 산화알루미늄(Al2O3)을 탄소 전극을 이용해 전기분해하여 금속 알루미늄(Al)을 얻는 반응식과 장치이다. 이 장치를 이용해 9.00 kg의 알루미늄을 얻었다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은? (단, 패러데이 상수 F = 9.65 × 104 C/mol, Al의 몰질량은 27.0 g/mol, C의 몰질량은 12.0 g/mol이다.)
⑴ 문제
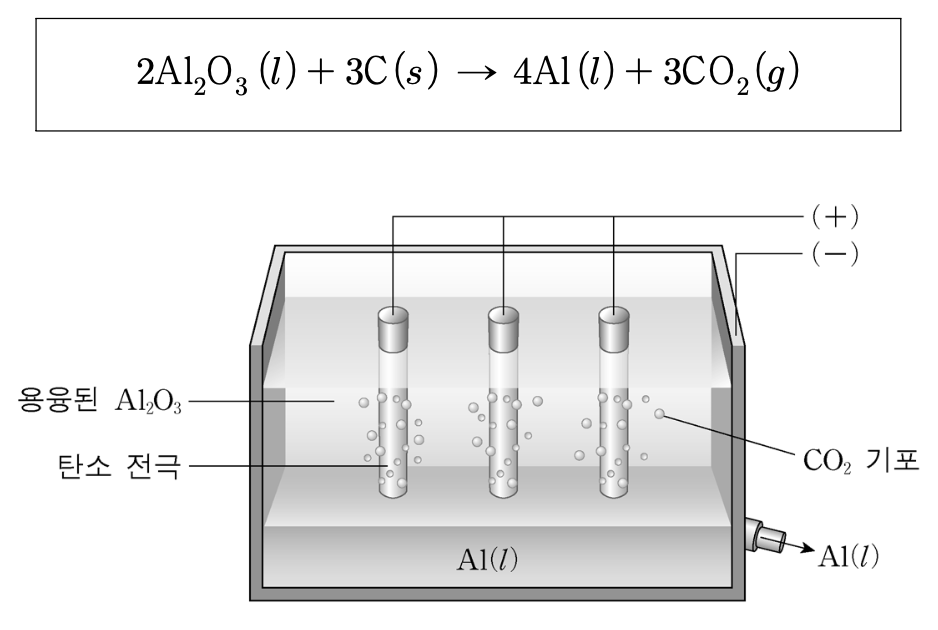

⑵ 풀이 : ①
○ ㄱ : 맞는 설명. 단, Al2O3를 2Al3+ + 3O2-로 나타냈음을 유의
○ ㄴ : 환원 반쪽 반응식은 Al3+ + 3e- → Al. 9 kg Al / (27 g Al / mol Al) × 3 mol e- / mol Al × 1 mol C / 4 mol e- × 12 g C / mol C = 3 kg
○ ㄷ : 흘려 준 전체 전하량은 9 kg Al / (27 g Al / mol Al) × 3 mol e- / mol Al × 9.65 × 104 C / e- = 9.65 × 107 C
13. 다음은 25 ℃에서 전해질 농도 변화에 따른 전압 변화를 알아보기 위한 갈바니 전지와 표준 환원 전위(E°)를 나타낸 것이다.
Ni (s) | NiSO4 (aq) || CuSO4 (1.00 M) | Cu (s)
Ni2+ (aq) + 2e- ⇄ Ni (s), E° = -0.25 V
Cu2+ (aq) + 2e- ⇄ Cu (s), E° = +0.35 V
표는 전지 I과 전지 II에서 전해질 용액의 구성과 측정된 전지 전압(E)을 나타낸 것이다. 전지 II는 전지 I의 Ni 반쪽전지 용액에 NaOH 용액을 가한 것으로, Ni(OH)2의 침전이 생성되었다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은? (단, Q가 반응 지수일 때 적용되는 네른스트 식은 E = E° - (0.060 / n) log Q이다.)
⑴ 문제

⑵ 풀이 : ②
○ ㄱ : ㈎ = (0.35 - (-0.25)) - (0.060 / 2) × log Q, Q = [Ni2+] / [Cu2+] =0.20
○ ㄴ : Ni 전극의 전위는, E° = -0.25 - (0.060 / 2) log (1 / [Ni2+])인데 [Ni2+]가 감소할수록 E°는 감소하므로 여전히 환원 반응은 Cu 전극에서 일어남
○ ㄷ : 0.99 = 0.60 - (0.060 / 2) × log [Ni2+] ⇔ [Ni2+] = 10-13 ⇔ Ksp = [Ni2+][OH-]2 = 10-13 × [(0.60 - 0.20 × 2) / 2]2 = 10-15.
14. 다음은 코발트 착물에 대한 환원 전위(E°), 형성 상수(K), 정팔면체장에서의 결정장 갈라짐(Δo)을 나타낸 것이다. K1과 K2는 각각 [Co(NH3)6]3+와 [Co(NH3)6]2+ 착물의 형성 상수이다. 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제
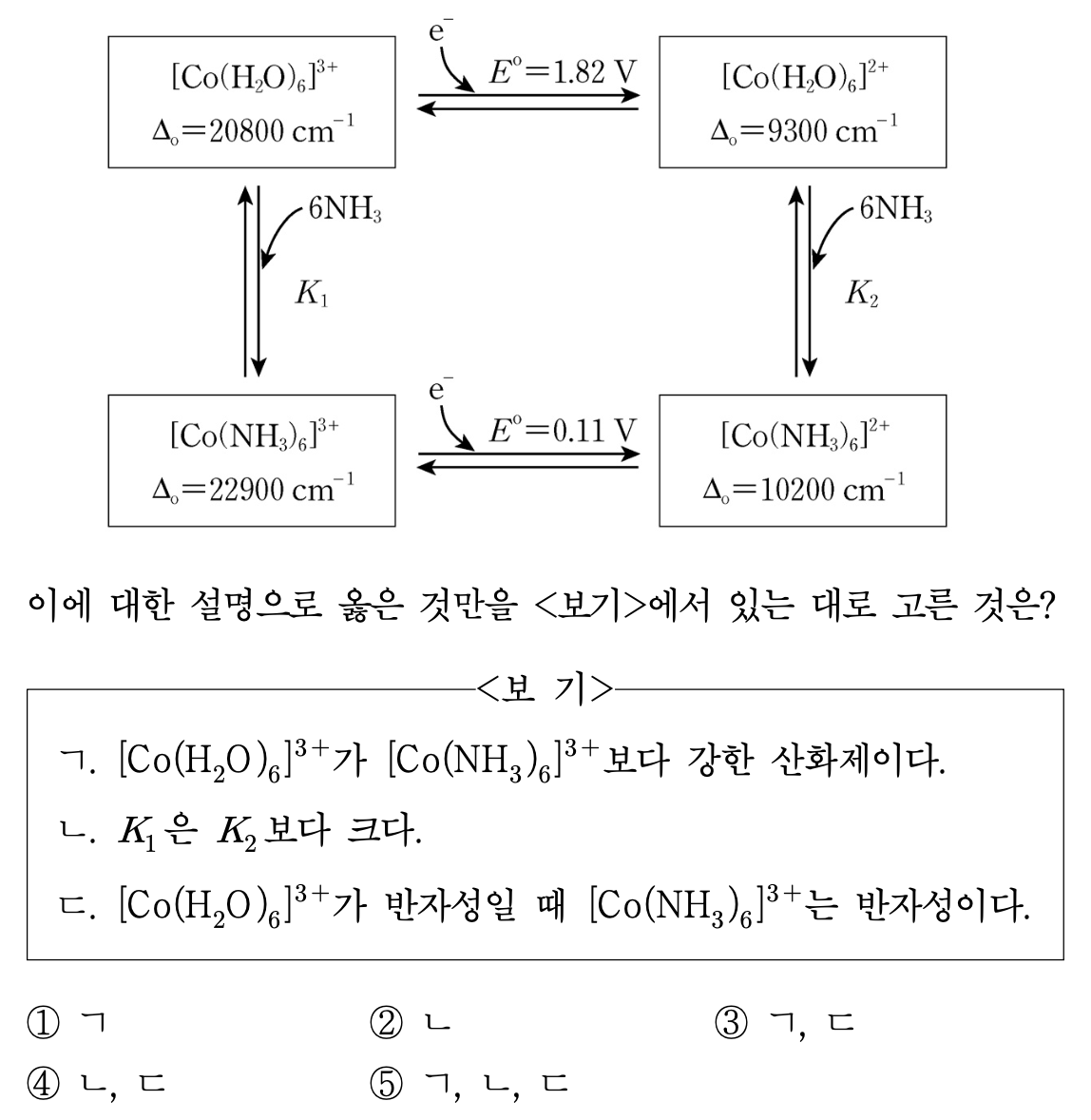
⑵ 풀이 : ⑤
○ 착물화학
○ ㄱ : 중심금속이 리간드와 강하게 결합할수록 리간드의 전자가 중심금속으로 모여 결정장 갈라짐의 크기가 증가함. 그러므로 NH3가 Co와 강하게 결합하므로 Co3+를 더 안정화시켜, Co3+가 환원될 경향이 더 작아지고 산화제 강도가 약해짐
○ ㄴ : 중심금속의 전하가 클수록 리간드와 더 강하게 결합하여 형성상수가 커짐
○ ㄷ : 약한 장 리간드인 H2O 하에서도 [Co(H2O)6]3+이 반자성(즉, low spin)이므로 eg와 t2g 간의 에너지 준위 차이가 충분히 크다고 할 수 있음. 그러므로 더 강한 장 리간드인 NH3 하에서도 반자성
15. 전이 금속 이온 M3+는 두 자리 리간드인 en, gly와 각각 6배위 팔면체 착물 A, B를 형성한다. (en: NH2CH2CH2NH2, gly: NH2CH2COO-) 이에 대한 설명으로 옳은 것만을 ⟨보기⟩에서 있는 대로 고른 것은?
⑴ 문제
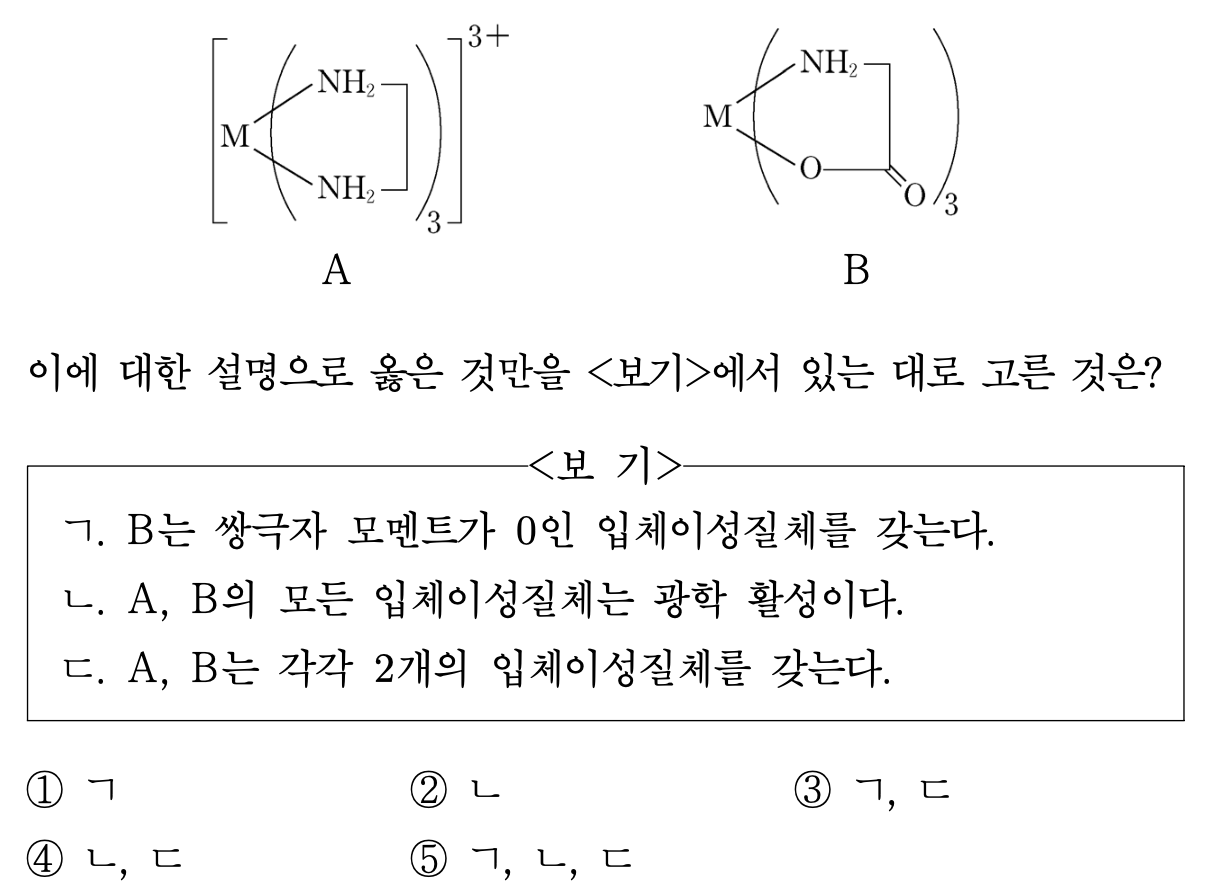
⑵ 풀이 : ②
○ ㄱ : 홀수 개(즉, 3개)의 비대칭 리간드가 치환된 경우 쌍극자 모멘트가 0일 수 없음
○ ㄴ : A의 경우 한 쌍의 광학 이성질체가 있으며, 이를 Λ-형 (좌회전성, (-)), Δ-형 (우회전성, (+))라고 함
○ ㄷ : 입체이성질체는 거울상이성질체와 부분입체이성질체로 구분됨. A의 경우 2개의 입체이성질체, 그 중에서도 거울상이성질체를 가지는 게 맞음. 그러나 B의 경우 -COO-가 모두 수직인 경우 (거울상이성질체 존재) 및 한 쌍의 -COO-기가 마주보는 경우 (거울상이성질체 존재) 등 4개의 경우가 존재함
16. 다음은 아이오딘산칼륨(KIO3)을 이용하여 싸이오황산나트륨(Na2S2O3) 용액의 정확한 농도를 결정하는 실험이다. 위의 실험에 대한 설명으로 옳지 않은 것은?
⑴ 문제


⑵ 풀이 : ⑤
① 2.50 × 10-3 mol / 0.25 L = 0.01 M
② KI는 K+ + I-와 다름 없고, NaI는 Na+ + I-와 다름 없어서 사실상 KI와 NaI은 동일함
③ 과량의 산을 가한 것과 조금 덜 과량으로 넣은 것은 사실상 동일함
④ 녹말 지시약 : I-는 염색하지 않지만 요오드 덩어리(예 : I3-)는 염색시킴
⑤ 2.50 × 10-3 mol / 250 mL × 50 mL × 3 (∵ IO3- : I3- = 1 : 3) × 2 (∵ I3- : S2O32- = 1 : 2) = 0.003 = 12.5 mL × x M ⇔ x = 0.24 M. 참고로, KI 2 g = KI 0.012 mol이므로 삼각 플라스크에 들어있던 2.50 × 10-3 / 5 = 0.5 × 10-3 mol보다는 훨씬 많다고 할 수 있음 (즉, 24배)
입력: 2024.11.17 10:14
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【화학】 2012 MEET/DEET 화학 (1) | 2024.12.27 |
|---|---|
| 【화학】 2013 MEET/DEET 화학 (0) | 2024.12.20 |
| 【유기화학】 2011 PEET 유기화학 (2) | 2024.11.09 |
| 【유기화학】 2012 PEET 유기화학 (5) | 2024.11.08 |
| 【유기화학】 2013 PEET 유기화학 (0) | 2024.10.11 |




최근댓글