2024년 제61회 변리사 2차 국가자격시험
추천글 : 【유기화학】 변리사 2차 유기화학 풀이
문제 1. 다음 물음에 답하시오.
⑴ 문제 1-1. 산 촉매(acid catalyst) 하에서 가수분해 반응을 하는 화합물 A의 스펙트럼 자료는 다음과 같다. 화합물 A의 구조를 그리고 IUPAC 체계에 의해서 명명하시오. 또한 화합물 A의 구조를 추론하는 과정을 설명하시오.
질량스펙트럼 (MS): m/z = 178 (M+)
IR: 1725 cm-1
1H NMR: δ 0.92 (6H, doublet), 1.97 (1H, multiplet), 4.03 (2H, doublet), 7.50 ~ 8.10 (5H)
13C NMR: δ 19.4, 27.6, 70.8, 128.6, 129.9, 130.1, 133.0, 165.9
○ 서설 : 다음은 위 정보로부터 알아낼 수 있는 순서로 기술함
○ 수소 자리가 14개로 주어져 있고, 탄소 자리는 대칭성이 있을 수 있으므로 아직 판단하기 이름
○ 1H NMR 결과에서 6.5 -8 ppm에 피크가 있어 방향족 고리가 존재함을 알 수 있음
○ 비슷하게, 13C NMR 결과에서 110-170 ppm에 피크가 있어 방향족 고리가 존재함
○ 헤테로 방향족 고리를 포함하면 벤젠 수소의 chemical shift가 보통 7 내외로 비교적 작게 나옴
○ 벤젠 수소가 5개이므로 주어진 화합물은 monosubstituted benzene임을 알 수 있음
○ 따라서 적어도 13C NMR에서 적분비가 2인 탄소 자리가 2개 이상 있음 : 즉, 단일 치환 벤젠에 좌우대칭성이 존재함
○ 따라서 주어진 화합물은 C≥10H14NxOy···인데, C10H14의 분자량은 134이므로 남은 44를 설명하기 위해 CO2가 필요함
○ 즉, 주어진 화합물은 C11H14O2이고, 불포화도는 5
○ 1780-1650에서 IR 흡수 파수가 관찰되므로 C=O 결합이 존재함을 알 수 있음
○ 13C NMR에서 128.6 ~ 133.0까지 4개 자리에 6개의 벤젠 탄소가 할당되고, 165.9 ppm 13C은 R-COO-R'의 존재를 암시
○ R-COO-R', R-CO-H, R-CO-R'은 각각 165-175, 190-200, 205-220 ppm인 것은 필수 암기사항
○ 또한, R-COOH는 1H NMR에서 10-12 ppm이므로 주어진 화합물에 카르복실기는 존재하지 않음
○ 불포화도 5는 벤젠 고리에서 4, R-COO-R' (단, R, R' ≠ H)에서 1로 모두 설명됨
○ 적분비가 6인 0.92 ppm 수소는 두 개의 대칭적인 메틸기 자리가 있음을 암시하므로 주어진 화합물은 CR1R2(CH3)2 형태
○ 이 화합물은 -OH기를 가지지 않으므로, R1의 말단은 -H이고 R2의 말단은 벤젠 고리임
○ 1H NMR에서 적분비가 1인 수소가 multiplet이므로 이 수소는 두 메틸기와 인접해 있어 R1 = H임
○ 적분비가 2인 수소가 doublet이므로 이 2개의 수소는 위 multiplet인 적분비 1의 수소와 인접함
○ 따라서 이 화합물의 말단은 -CH2-CH(CH3)2
○ 벤젠 고리와 위 말단 사이에 -COO-가 연결되는데 방향이 2개가 가능함 : 비교적 높은 4 ppm은 -OCH2-의 존재를 암시함. 참고로 -CO-CH3의 chemical shift는 2.1 ppm
○ 그러므로 이 화합물은 Ph-CO-O-CH2-CH(CH3)2라고 할 수 있음
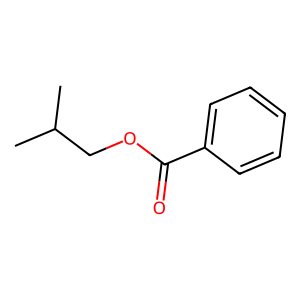
○ 임의의 구조식으로부터 IUPAC 코드를 알아내는 방법 (▶ 추가 설명)
○ 에스터 명명법 : -COOH에서 H가 치환되고 남은 R 자리가 에스터의 치환기
○ IUPAC 명명법 : 2-methylpropyl benzoate
○ 검토 : 에스터는 산 촉매 가수분해 반응을 수행하므로 타당함
○ 검토 : 탄소가 11개인데 탄소 자리가 8개인 게 설명이 됨
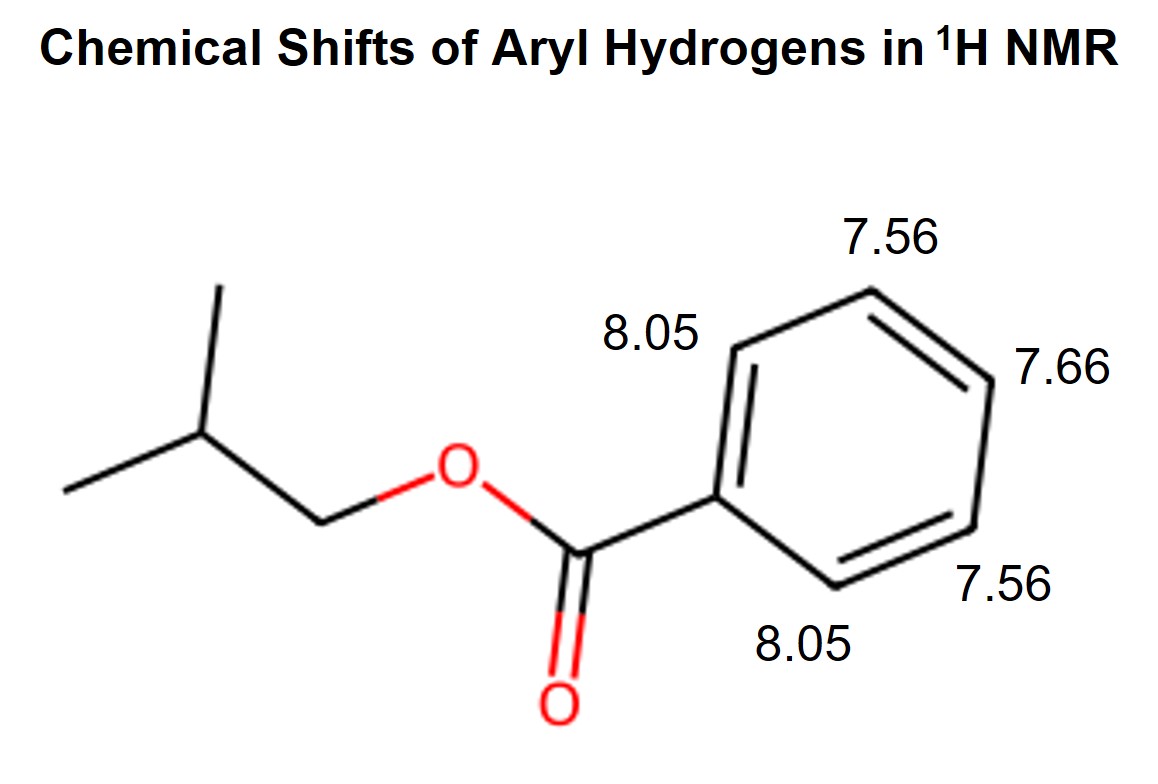
⑵ 문제 1-2. 위 물음의 화합물 A의 스펙트럼에서 1H NMR δ 7.50 ~ 8.10 (5H)에 해당하는 peak는 δ 7.56, 7.66, 8.05 세 위치에서 나타난다. 이 세 곳의 NMR peak 위치에 해당되는 수소를 화합물 A의 화학구조에 각각 표시하고, 이와 같이 서로 다른 chemical shift를 보이는 이유를 설명하시오.
○ 벤젠 수소의 1H NMR 해석
○ 원리 1. 전자 결핍 환경에 있는 1H는 알짜 자기장이 크므로 공명주파수 및 δ 값이 큼
○ 원리 2. aryl proton은 circulating electron이 외부 자기장과 같은 방향의 자기장을 형성하여 공명 주파수 및 δ 값 증가. 즉, 벤젠에 있는 p orbital 전자가 외부 자기장을 상쇄하는 방향으로 팽이처럼 회전하여 벤젠 수소의 ppm 값이 커짐
○ 이 상황에서는 원리 2보다 원리 1을 고려하여야 함
○ 원리 1-1. 전자 당김 유발 효과 : EWG인 치환기와 가까울수록, 즉 ortho 배향 > meta 배향 > para 배향 순으로 chemical shift가 증가
○ 원리 1-2. 공명 효과 : 카르보닐 치환기와 벤젠의 공명 효과로 ortho, para 배향에 carbocation이 생겨서 ortho 배향, para 배향 > meta 배향 순으로 chemical shift가 증가함
○ 따라서 치환기와 ortho 배향에 있는 벤젠 수소가 벤젠 수소 중에서 chemical shift가 가장 큼
○ 필자의 경험에 따르면 유발 효과가 공명 효과보다 meta, para 배향을 잘 구분시키지 못하므로, meta 배향 및 para 배향의 chemical shift 대소 관계는 원리 1-2로 비교해야 함
○ 따라서 chemical shift는 ortho 배향 > para 배향 > meta 배향으로 나타남
○ 검토 1. 원리 1-1과 원리 1-2가 서로 다른 대소관계를 보이는 para 및 meta 배향은 ppm 값이 유사하게 나타남이 타당함
○ 검토 2. UCLA WebSpectra Beginning Problems #8 : EWG가 치환기이므로 이 문제와 동일한 상황. checmial shift는 ortho 배향 > para 배향 > meta 배향으로 나타남. 참고로, 입체특이성을 갖는 벤질 자리 알켄 수소에 대한 상대적인 위치에 따라 ortho 배향 수소 자리가 구별 가능하여 1H NMR 상에서 갈라짐이 관찰됨을 알 수 있음
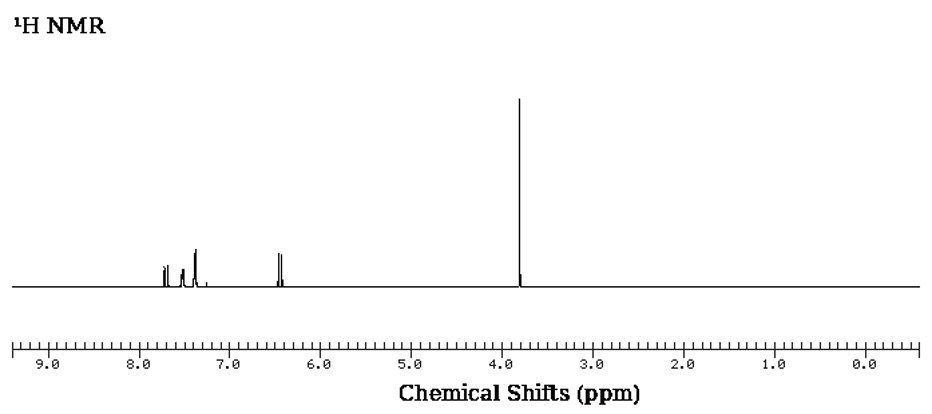
○ 검토 3. UCLA WebSpectra Beginning Problems #19 : EDG가 치환기이므로 이 문제와 반대 상황. checmial shift는 meta 배향 > para 배향 > ortho 배향으로 나타남
⑶ 문제 1-3. 다음 두 화합물 B, C에 열을 가해 전자 고리화 열림(electrocyclic ring opening) 반응이 일어난다고 할 때, 두 화합물 중 어느 화합물에 대한 반응의 활성화 에너지가 더 작은지 쓰고, 그 이유를 설명하시오.
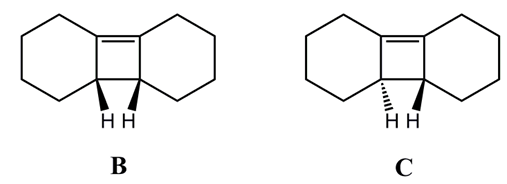
○ 전자 고리화 열림 반응 메커니즘
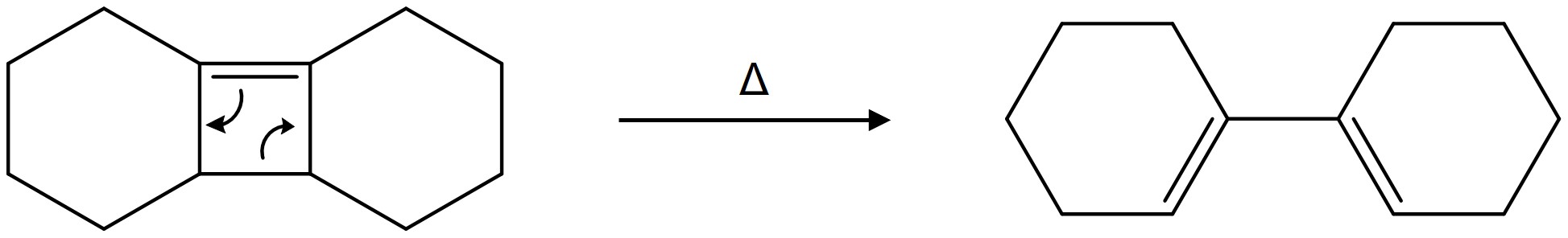
○ 최종 생성물이 conjugated alkene이기 때문에 전이상태의 형태 또한 conjugated alkene과 유사할 것
○ 따라서 회전장애 이성질체(atropisomer) 관계에 불과한 B와 C는 유사한 전이상태를 가지게 될 것
○ 활성화 에너지 = 전이상태 에너지 - 반응물 에너지이므로 입체장애가 더 큰 B가 더 활성화 에너지가 작음
○ 검토 : 직관적으로 더 불안정한 화합물이 더 쉽게 반응이 일어남
⑶ 문제 1-4. 서로 이성질체인 두 화합물 D, E의 화학구조를 비교했을 때 어느 화합물이 더 큰 쌍극자모멘트(dipole moment)를 가지는지 쓰고, 그 이유를 설명하시오.
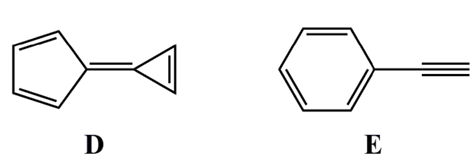
○ 쌍극자 모멘트 = 전하량 × 거리
○ 화합물 D가 방향족성을 만족하기 위해 쌍극자인 상태로 안정하게 유지되고 (즉, 전하량 ↑), 거리도 작지 않음
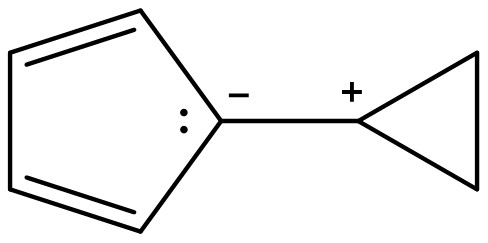
○ 그러므로 화합물 D가 더 쌍극자 모멘트가 큼
문제 2. 다음은 다단계 반응의 단계별 주생성물 A, B, C, D, E, F, G, H, I의 구조를 그리시오. (단, 각 단계 반응에서 적절한 조건으로 work-up 및 분리정제 과정이 수행되었다.)
⑴ 문제 2-1.
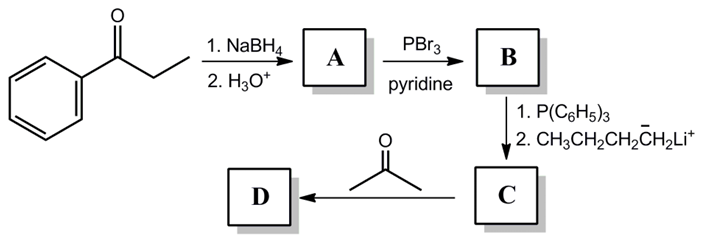
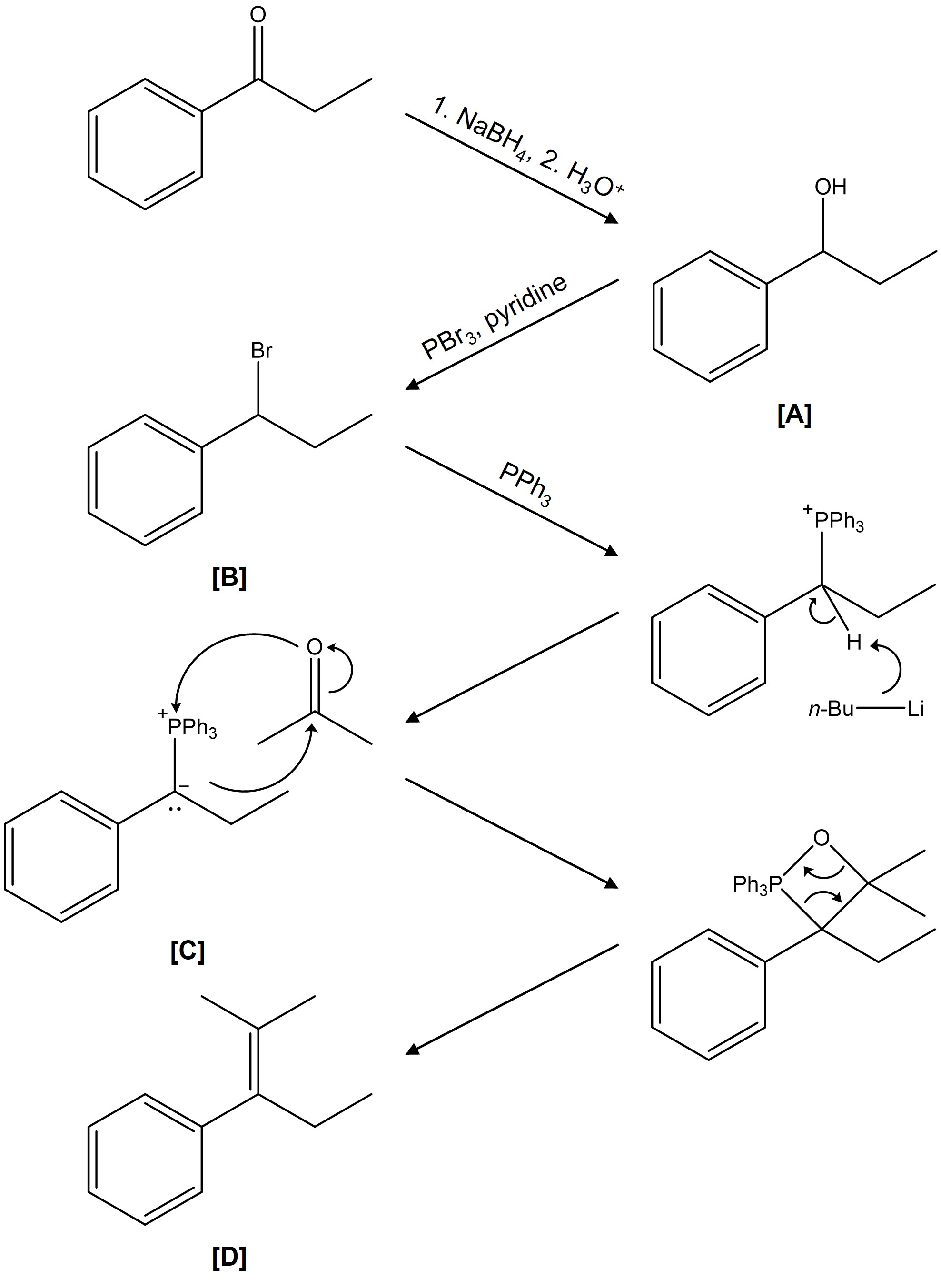
⑵ 답 2-1. NaBH4에 의한 케톤 환원 반응 → PBr3에 의한 알코올 SN2 반응 → 일라이드 시약 제법 → Wittig reaction
⑶ 문제 2-2.
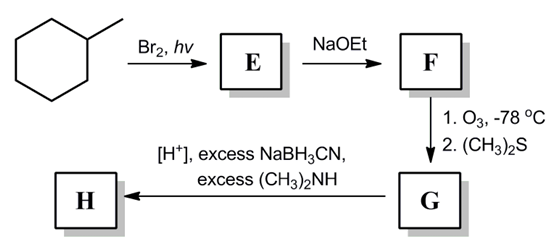
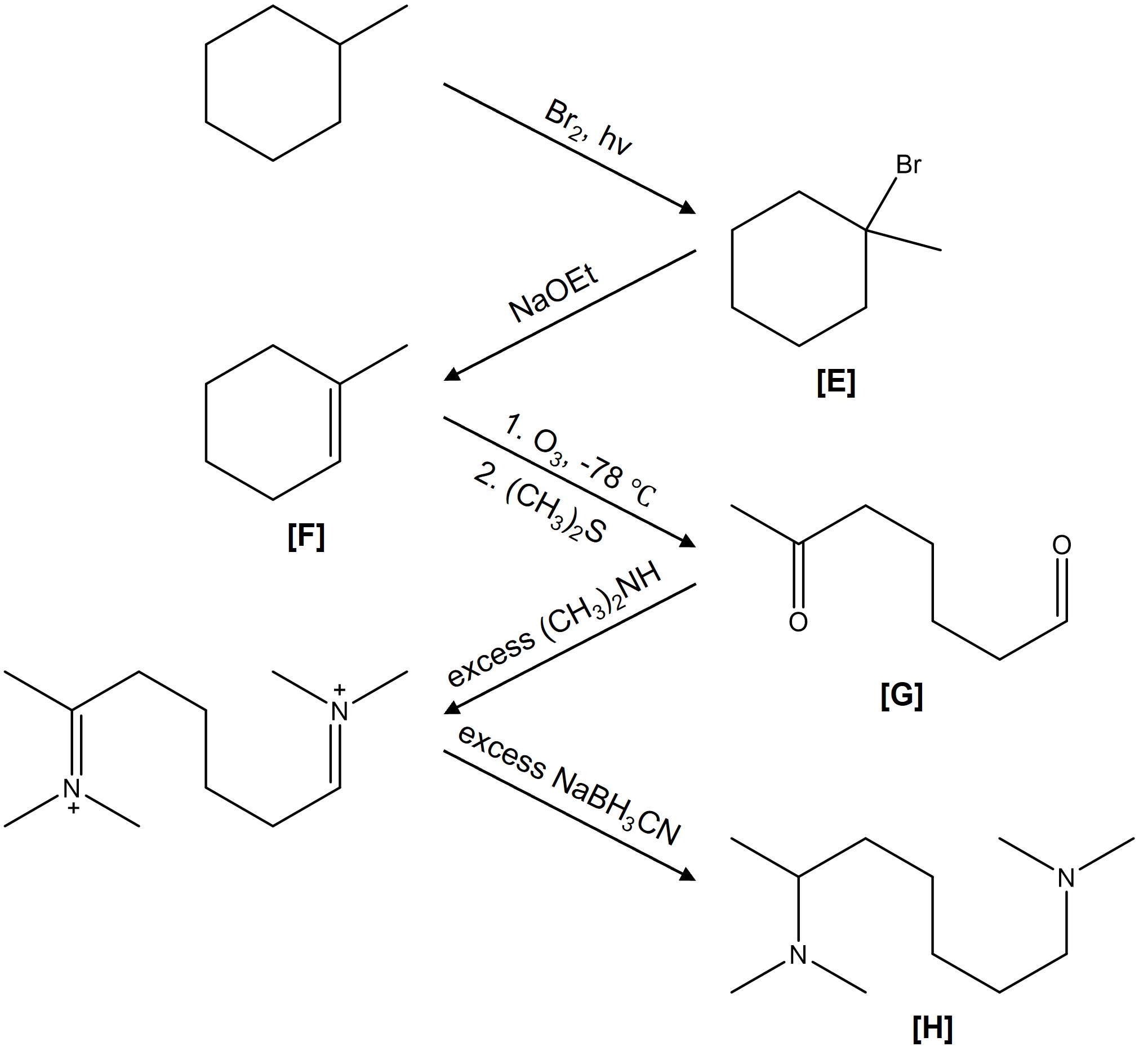
⑷ 답 2-2. 라디칼 치환 반응 (라디칼 중간체로서 가장 안정한 3차 라디칼이 생성됨) → E2 제거 반응 (Zaitsev's rule) → 알켄 가오존분해반응(ozonolysis) → 케톤의 아민 첨가 반응 → NaBH3CN에 의한 이민 환원 반응
⑸ 문제 2-3.
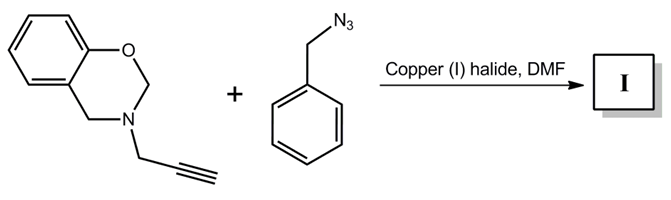
⑹ 답 2-3. CuAAC (Copper catalyzed azide-alkyne cycloaddition)
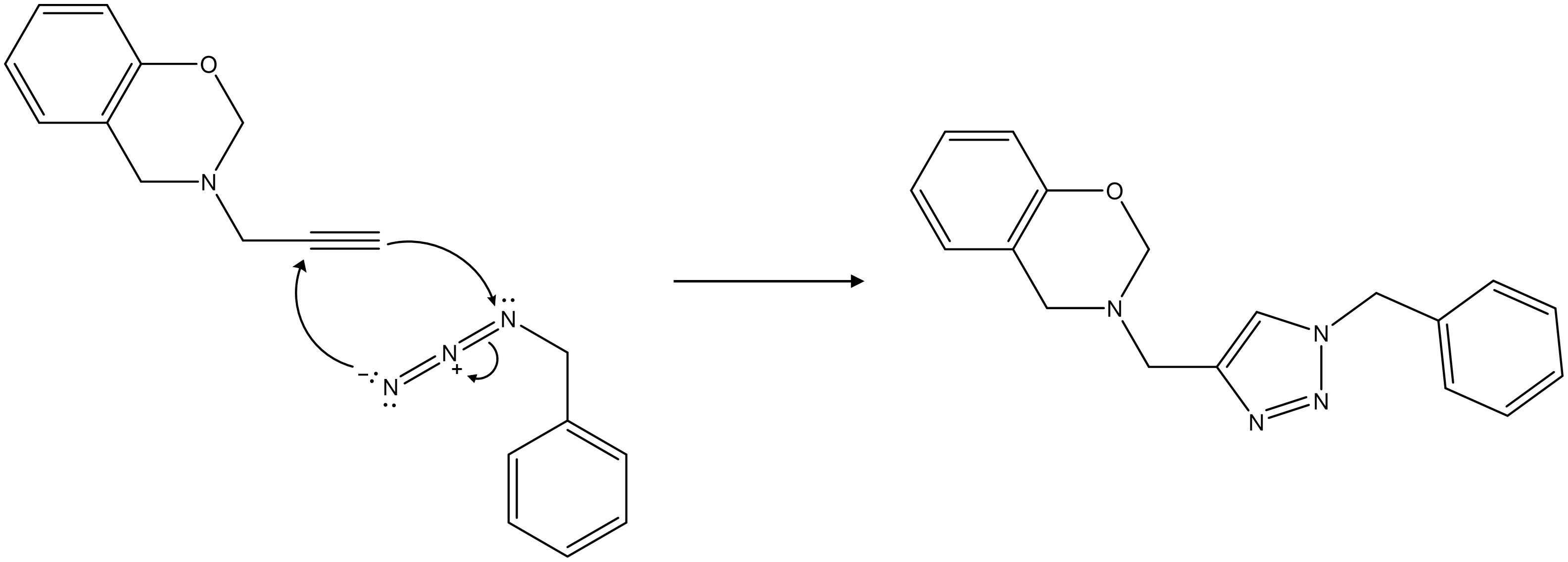
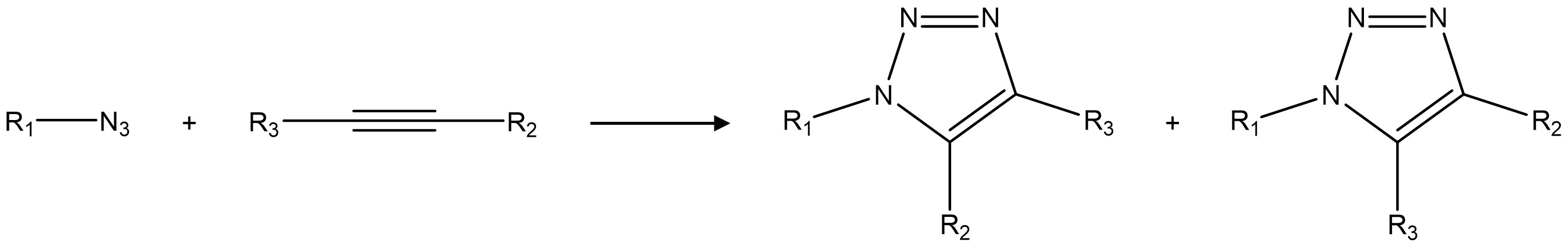
○ 두 치환기 위치에 따라 두 가지 생성물이 존재하는데, 두 치환기의 입체장애가 크므로 위와 같이 위치특이적으로 반응
문제 3. cis-1-tert-Butyl-4-chlorocyclohexane (A)과 trans-1-tert-Butyl-4-chlorocyclohexane (B)이 1:1의 몰비로 혼합된 메탄올 용액에 sodium methoxide를 넣고 메탄올의 끓는 온도로 반응을 12시간 진행하였다. 반응 종료 후, 분리과정을 통해 얻어진 물질을 분석하였더니 화합물 C가 45%의 수율로 얻어졌다고 가정할 때, 다음 물음에 답하시오.
⑴ 문제 3-1. 위의 반응 중 화합물 A와 B가 안정적으로 존재 가능한 의자형태의 분자구조를 Newman 투영식으로 그리시오. (단, 1번 탄소가 맨 앞에 나오도록 하시오.)
⑵ 답 3-1. tert-Bu기가 horizontal 배향으로 있어야 두 화합물이 안정적으로 존재할 수 있음
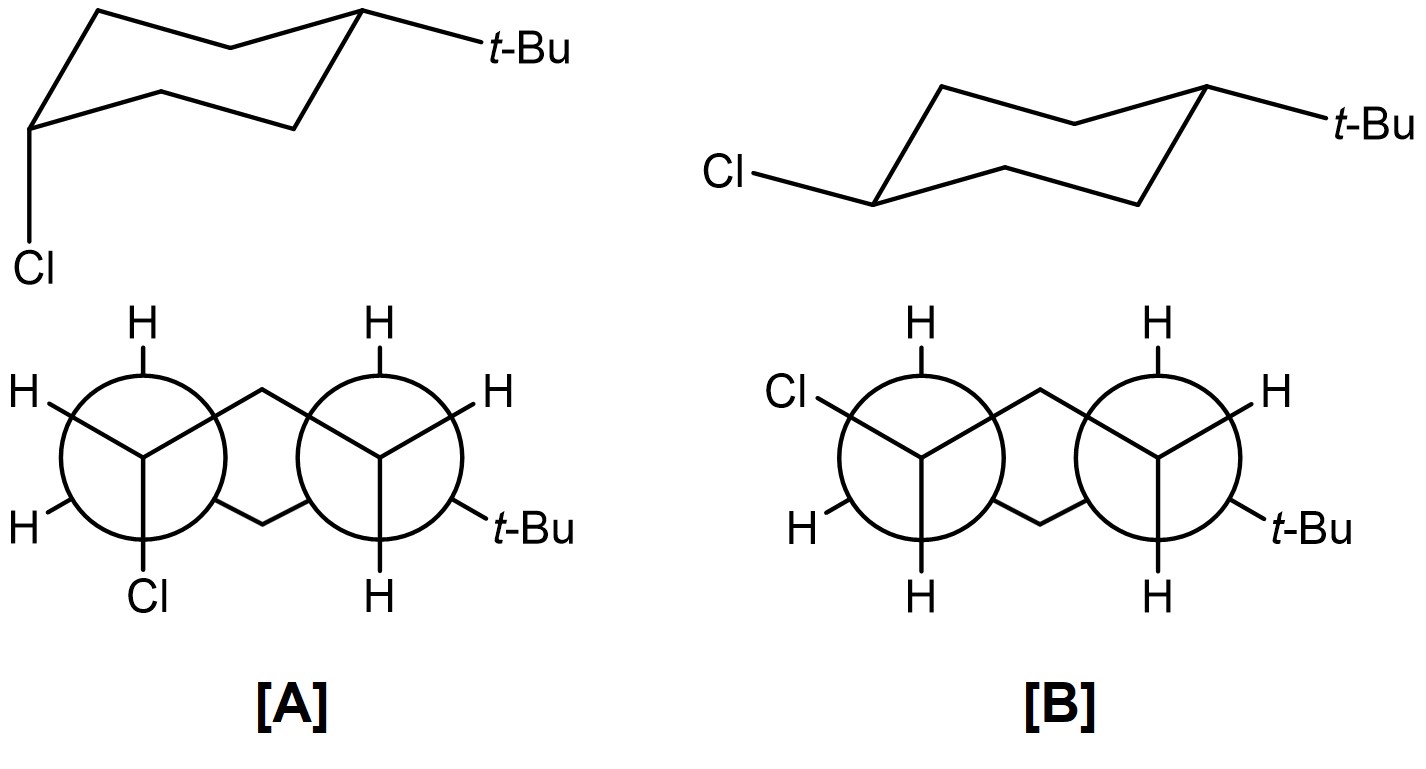
⑶ 문제 3-2. 생성물 C의 의자형태 분자 구조를 그리고, 반응 종료 후 work-up을 통해 얻어진 미 반응된 화합물 A와 B로부터 생성물 C를 분명하게 구별할 수 있는 분광분석방법을 제안하고 이유를 설명하시오.
⑷ 답 3-2.
○ 생성물 C의 의자 형태 분자 구조 : 2차 할로젠화 알킬 + 강염기 조건이므로 E2 제거반응. 이때 anti-periplanar로 접근할 수 있는 A에서 C가 생성
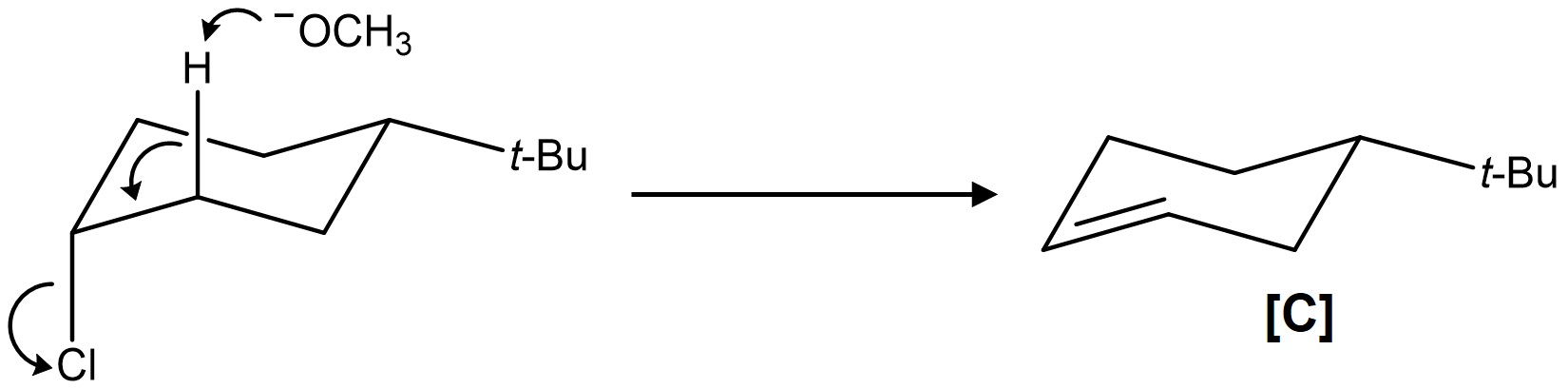
○ C를 분명하게 구별할 수 있는 분광분석방법
○ 예 1. 1H NMR : 알켄 수소는 갈라짐이 상당히 심하게 관찰됨. 알켄에서 일어나는 공명이 외부 자기장을 교란하여 proton signal에 노이즈를 더하게 됨
○ 예 2. 1H NMR : 알켄 수소는 4-5 ppm 정도로 비교적 큰 chemical shift 값을 보임. alkene proton은 electron motion이 외부 자기장과 같은 방향의 자기장을 형성하여 공명 주파수 및 δ 값이 커짐 (cf. 벤젠 수소도 비슷한 원리를 따름)
○ 예 3. 13C NMR : 알켄 탄소는 알케인 탄소보다 chemical shift가 더 크게 관찰됨. alkene proton은 electron motion이 외부 자기장과 같은 방향의 자기장을 형성하여 공명 주파수 및 δ 값이 커짐 (cf. 벤젠 탄소도 비슷한 원리를 따름)
○ (참고) 분광학은 NMR 위주로 문제를 푸는 게 권장됨 : 수학문제 풀듯이 풀 수 있고 상당히 많은 정보가 제공됨
⑸ 문제 3-3. 위의 반응물 A와 B의 혼합물 중에서 생성물 C를 어떻게 얻을 수 있었는지 반응 메커니즘을 제안하고 설명하시오.
⑹ 답 3-3. 답 3-2 참고
⑺ 문제 3-4. 위의 반응물 A와 B는 그대로 유지하면서, 메탄올과 극성은 유사하지만 끓는점이 2배 이상 높은 용매로 바꾸어 반응을 진행하였더니, 생성물 C의 수율이 60 %로 증가되는 것이 관찰되었다면, 생성물 C의 수율이 증가한 이유를 반응 메커니즘을 활용하여 설명하시오.
⑻ 답 3-4. E2 제거 반응 결과 생성된 메탄올이 증발하는데 용매가 더이상 메탄올이 아니므로 화학반응에서 생성물이 계속 사라지는 상황에 해당함. 따라서 화학 평형을 만족하기 위해 정반응이 우세하게 진행됨
문제 4. 다음 물음에 답하시오.
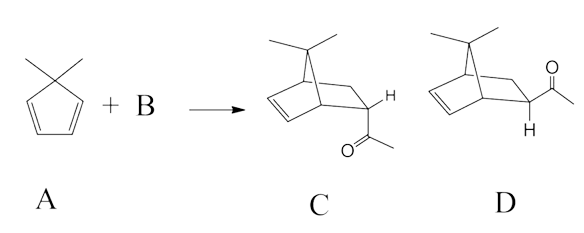
⑴ 문제 4-1. 위에서 주어진 반응물 A를 이용하여 한 번의 반응으로 생성물 C와 D를 합성하는데 필요한 화합물 B의 화학구조를 제안하시오.
⑵ 답 4-1. Diels-Alder reaction. 즉, B는 But-3-en-2-one
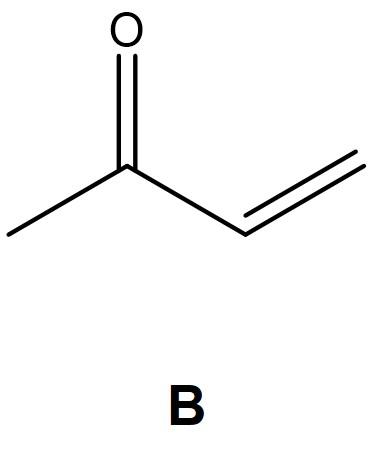
⑶ 문제 4-2. 위 반응의 생성물 C와 D 중 어느 화합물이 주로 형성되는지 반응 메커니즘을 활용하여 설명하시오.
⑷ 답 4-2. endo 생성물인 생성물 C가 더 선호됨
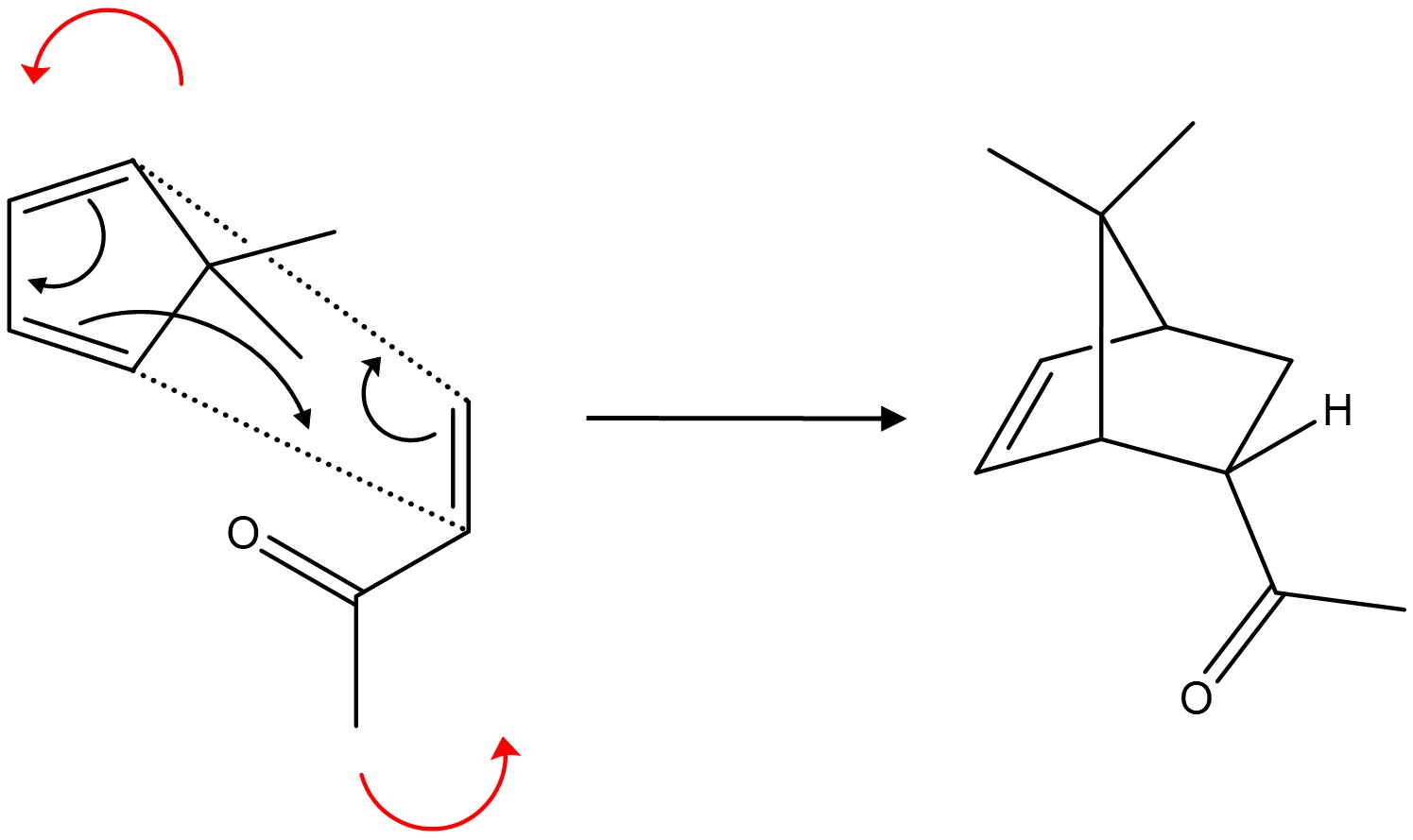
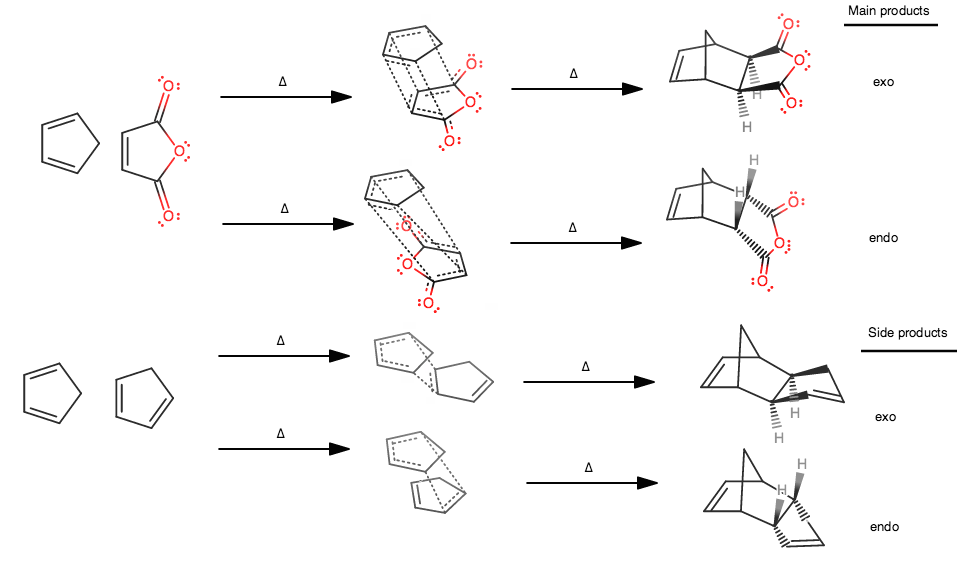
⑸ 보충. Diels-Alder reaction의 입체선택적 반응 : endo와 exo의 비교
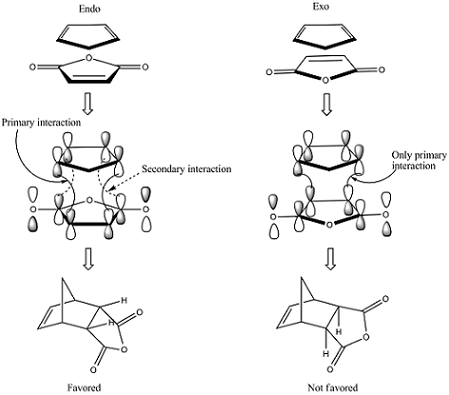
Figure. 1. Diels-Alder 반응의 입체선택적 반응
① endo 생성물과 exo 생성물은 부분입체이성질체 관계
○ endo 배열 : 다리목 탄소를 기준으로 큰 고리 방향으로 치환기가 위치하는 배향
○ exo 배열 : 다리목 탄소를 기준으로 작은 고리 방향으로 치환기가 위치하는 배향
○ 위 그림에서 endo 배열은 5각형 고리와 가깝고, exo 배열은 6각형 고리와 가까움
○ 암기 팁 : 다이엔을 위로 친다이엔체를 아래로 두고, 이 두 개가 최대한 많이 겹치는 중간체를 갖는 경로가 endo 생성물이고, 최대한 안 겹치는 중간체를 갖는 경로가 exon 생성물
○ endo 배열로 Diels-Alder 반응이 일어나는 경우, 위에 있는 다이엔에서 제일 강한 EDG를 flip up
○ endo 배열로 Diels-Alder 반응이 일어나는 경우, 아래에 있는 친다이엔체에서 제일 강한 EWG를 flip down
② 반응속도론적으로 endo 생성물이 우세 : 전이상태의 안정성 차이 때문
Figure. 2. Diels-Alder 반응에서 exo, endo에서 오비탈 상호작용의 수 차이
○ 저온조건(25 ℃)에서 endo 생성물이 주생성물이 됨
○ exo 반응의 전이상태 : 오직 일차 상호작용(primary interaction)만 존재
○ endo 반응의 전이상태 : 일차 상호작용과 이차 상호작용(secondary interaction)이 존재
○ 이중고리 화합물이 아닌 경우에도 endo 생성물이 우세
③ (참고) 열역학적으로 exo 생성물이 우세
○ 이유 : 작은 고리 방향으로 치환기가 위치하는 게 입체장애가 적음
○ 고온조건(90 ℃)에서 exo 생성물이 주생성물이 됨
○ 이유 : 반응속도론적 생성물은 다시 역반응을 해서 반응물이 될 수 있기 때문
④ 예외
○ 친다이엔체가 알카인인 경우 생성물의 치환기 배향은 endo, exo가 아니라 일반적인 알켄의 결합위치를 만족
⑹ 문제 4-3. 화합물 C를 이용하여 선택적으로 화합물 E를 합성하는 방법을 제안하고 제안한 반응의 메커니즘을 설명하시오.
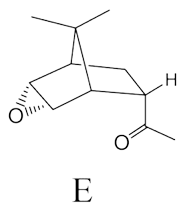
⑺ 답 4-3.
○ 단계 1. NaBH4 또는 LiAlH4에 의한 케톤 환원 반응 : 2차 알코올 생성
○ 단계 2. Henbest epoxidation : 수소결합으로 인해 OH기, 아민기 등과 같은 배향으로 에폭사이드 형성
○ 단계 3. PCC 등을 이용한 2차 알코올 산화반응 : 케톤 생성
입력: 2024.07.29 22:29
'▶ 자연과학 > ▷ 변리사 풀이' 카테고리의 다른 글
| 【분자생물학】 2024년 제61회 변리사 2차 국가자격시험 (0) | 2024.07.29 |
|---|---|
| 【분자생물학】 2023년 제60회 변리사 2차 국가자격시험 (2) | 2023.11.09 |
| 【유기화학】 2023년 제60회 변리사 2차 국가자격시험 (1) | 2023.10.21 |
| 【분자생물학】 2018년 제55회 변리사 2차 국가자격시험 (7) | 2023.04.21 |
| 【분자생물학】 2021년 제58회 변리사 2차 국가자격시험 (0) | 2022.12.06 |




최근댓글