5강. 세포분열과 암
추천글 : 【생물학】 생물학 목차
a. 유전자의 수평적 전달
b. 암의 통계
1. DNA와 염색체 [목차]
⑴ DNA는 단백질과 결합하여 염색사(= 염색질, chromatin)를 이루며 많은 유전자 포함
① 히스티딘 등의 양이온 아미노산이 음전하를 띠는 DNA를 응축하게 함
② 이질염색질 : 염색질이 응축된 상태
③ 진정염색질 : 염색질이 풀린 상태
⑵ 염색체(chromosome) : 염색질이 응축되어 광학현미경으로 관찰 가능한 형태
① 염색체의 수 = 하나로 행동하는 덩어리의 수 = 같이 염색되는 덩어리의 수
② 염색체의 수는 4가 염색체를 제외하곤 동원체의 수와 같음
③ 한 염색체에서 짧은 쪽 (단완), 긴 쪽 (장완)을 각각 P arm, Q arm이라고 함
⑶ 핵형(karyotype) : 염색체의 모양, 크기, 수 등을 지칭, 종 특이적

Figure. 1. 남성의 핵형분석(Giemsa banding) 사진
① 관찰을 위해 세포분열 중기에 멈추도록 화학물질을 사용
⑷ 자매염색분체(sister chromatids) : 복제되지 않은 염색체가 복제된 후 동원체(centromere)에서 서로 결합된 염색분체
① 자매염색분체의 수는 곧 DNA의 개수
② 동원체 : 디네인 운동단백질 결합부위와 동원판 소유
③ 2가 염색체(4분 염색체) : 하나의 염색체에 4개 자매염색분체가 있는 경우
○ 동원체에 결합된 자매염색분체가 4개
○ 상동염색체끼리는 동원체를 공유하지 않음 : 염색체의 수 = 동원체의 수가 항상 성립하지 않는 이유
○ 2가 염색체 1개 = 4분 염색체 1개 = 염색체 2개 = 자매염색분체 4개
④ 1가 염색체(2분 염색체) : 하나의 염색체에 2개 자매염색분체가 있는 경우
○ 동원체에 결합된 자매염색분체가 2개
○ 1가 염색체 1개 = 2분 염색체 1개 = 염색체 1개 = 자매염색분체 2개
⑤ 0가 염색체(1분 염색체) : 하나의 염색체에 1개 자매염색분체가 있는 경우
○ DNA 이중나선 한 개
○ 생식세포의 염색체 형태
○ 0가 염색체 1개 = 염색체 0개 = 자매염색분체 1개
⑸ 상동염색체, 성염색체
① 상동염색체(homologous chromosome, autosome) : 같은 크기, 모양, 동원체 위치, 유전자 상대 위치(좌위, locus)
② 성염색체(sex chromosome) : 서로 다른 위치, 유전적 구성, 부분상동
③ 예 : 사람은 22쌍의 상(동)염색체와 1쌍의 성염색체를 가짐
④ 예 : 사람의 생식세포는 22개의 상(동)염색체와 1개의 성염색체를 가짐
⑹ 세포분열 관여 단백질
① 콘덴신(condensin) : 염색사를 염색체로 응축
② 코헤신(cohesion) : 각각의 염색분체가 서로 결합하게 함, 분열기 중기에는 동원체 부근만 코헤신 존재
③ 슈고신 : 제1감수분열 시 상동염색체끼리 분해되지 않도록 함
④ 세큐린(securin) : 세파라제 억제, 세포분열 후기가 되기 전까지 자매염색분체의 분리 방지
○ 유사분열, 감수 1분열, 감수 2분열에 모두 작용
○ APC는 세큐린 억제
⑤ 세파라제(seperase) : 동원체 부군의 코헤신 분해, 세포분열 후기가 되면 자매염색분체 분리
○ 유사분열, 감수 1분열, 감수 2분열에 모두 작용
⑺ 방추사(mitotic spindle)
① 방추사는 미세소관으로 구성
② 방추사 부착점(kinetochore) : 동원체에 단백질이 결합한 구조, 방추사가 결합
③ 동원체 방추사(kinetochore mitotic spindle) : 염색체의 동원체에 결합한 방추사
○ 후기 염색체 이동에 관여
○ 동원체 방추사에서 미세소관과의 결합에 관여하는 단백질 : Ndc80
④ 극성 방추사(nonkinetochore mitotic spindle) : 반대쪽 방추사와 만나는 방추사, 말기 세포신장에 관여
○ 각 극성 방추사의 한 개의 키네신이 서로 맞붙어 서로를 밀어냄
○ interpolar mitotic spindle이라고도 함
○ kinesin5 : 한 쌍의 운동단백질. +쪽으로 이동
○ kinesin14 : 극성방추사를 연결. -쪽으로 이동
○ kinesin 4 : 염색체를 +쪽으로 이동
○ kinesin 10 : 염색체를 +쪽으로 이동
⑤ 성상체 방추사(astral mitotic spindle) : 세포막을 향함. 후기에 중심체를 양극으로 이동시킴
○ 디네인(dynein) : 성상체 방추사에서 minus end로 이동하는 운동 단백질
⑥ 염색체팔 방추사 : 염색체의 팔에 붙은 방추사, 후기에 염색체를 회전시켜 적절히 배향시킴
⑻ 시약
① Gimsa : 염색체 상에서 결합수가 적은 A-T rich 사이트에 염색이 더 잘 되어 얼룩이 나타남
② 아세트산 알코올 : 세포분열이 진행하지 않도록 고정
③ Hydroxy Urea : 모든 세포를 G1기로 통일
④ 아크리딘 오렌지 : DNA 이중나선이 깨짐
⑤ PHA(phytohemagglutinin) : 백혈구를 백혈구아세포로 변환시켜 다시 분열·분화를 유도, 핵형분석에 이용
2. 유전자의 수직적 전달 : 세포분열 [목차]
⑴ 세포분열의 종류
① 유사분열 : 체세포분열
○ 수정란에서 개체 발생, 상처회복, 조직 및 기관의 생성 및 생장
○ 딸세포는 모세포와 유전적으로 동일 : 돌연변이가 없다는 전제
○ 유사분열이 활발한 기관 : 골수, 혈액, 비장, 간, 피부
○ 유사분열이 활발하지 않은 기관 : 방광, 근육, 지방
○ 무성생식(asexual reproduction)의 증식 방법
② 감수분열 : 생식세포분열
○ 이배체 생물이 유성생식에 필요한 배우자를 만들기 위한 분열
○ 염색체의 수가 반으로 감수 → 딸세포는 반수체(n)
○ 유성생식(sexual reproduction)의 증식 방법
③ 염색체 및 자매염색분체의 개수 (감수분열 기준)
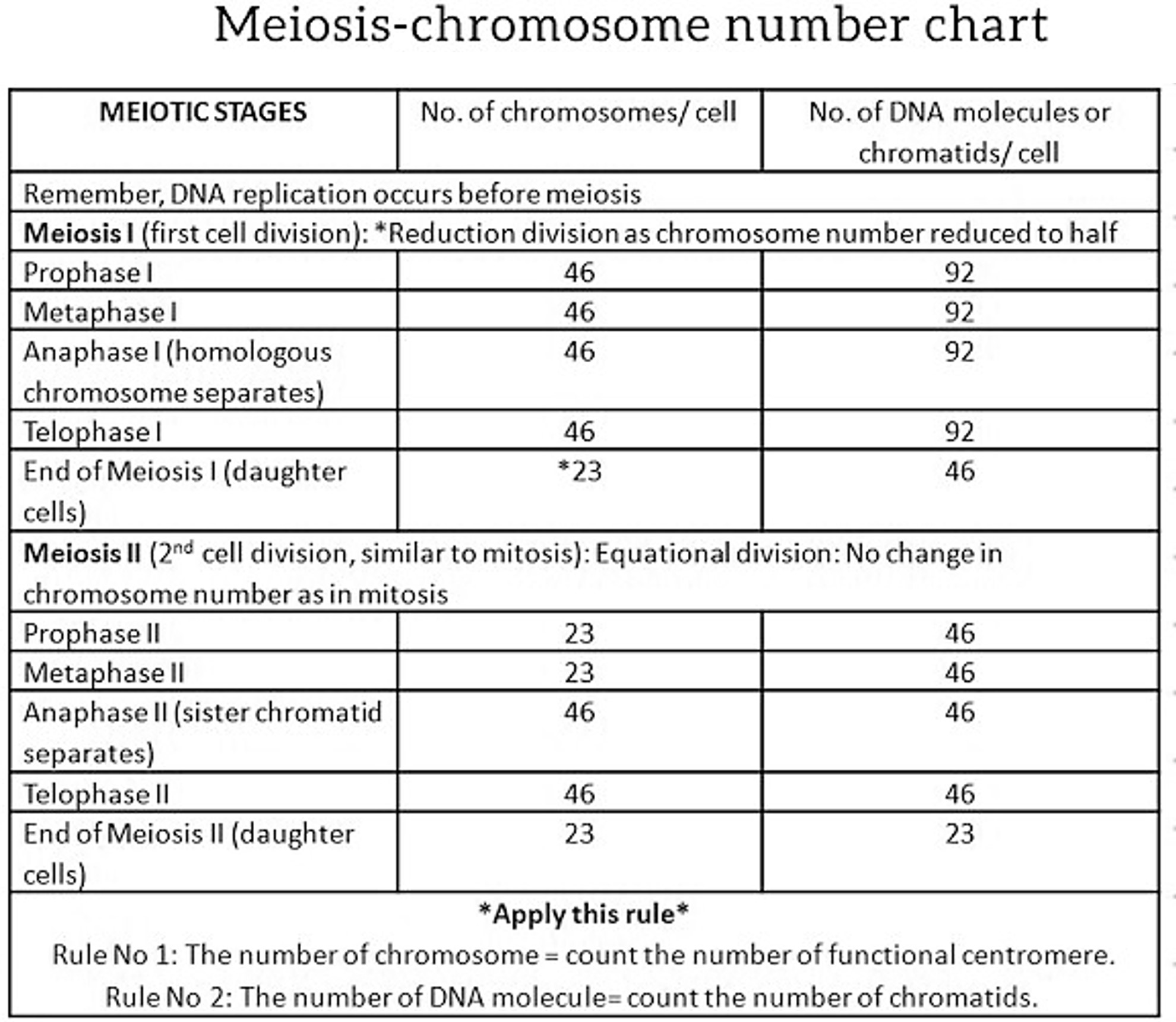
⑵ 분열기와 간기
① 간기(interphase) : 대부분의 세포주기
○ G는 gap 혹은 growth의 약자이고, S는 synthesis의 약자
○ G1기 : 세포 성장과 세포소기관 증식
○ S기 : DNA 복제, 중심립 복제, 히스톤 단백질 합성. 염색체 46개, 자매염색분체 92개 / cell
○ 동물세포의 경우, 중심립(centriole) 2개가 한 개의 중심체(centrosome)를 형성하므로, 최종 4개 중심립
○ 식물세포의 경우, 최종 2개 중심립
○ G2기 : 세포 분열에 필요한 단백질(예 : 튜불린) 합성
○ PCNA assay : G1기와 S기의 세포를 탐지함
② 분열기(M기, mitotic phase)
○ 핵 분열기 : 염색체들이 양극으로 이동
○ 세포질 분열기 : 세포질이 두 개로 분리되면서 2개의 딸 세포 생성
③ 세포융합 실험
| 융합 전 세포주기 상태 | 융합 후 핵의 상태 | ||
| 세포 A | 세포 B | 핵 A | 핵 B |
| S기 | G1기 | DNA 복제 정상 진행 | DNA 복제 즉시 개시 |
| S기 | G2기 | DNA 복제 정상 진행 | G2기에 머물러 있음 A의 DNA 복제가 끝난 후 분열 |
| M기 | G1기 | 분열 | 염색체가 조기 응축 |
| M기 | G2기 | 분열 | 염색체가 조기 응축 |
| G1기 | G2기 | S기로 정상 진행 | M기로 정상 진행 |
Table. 2. 세포융합 실험 결과
○ S기의 세포에는 G1기 핵을 S기로 전이하는 것을 촉진하는 물질 有
○ S기의 세포에는 G2기 핵을 M기로 전이하는 것을 억제하는 물질 有
○ G2기의 세포에는 G1기의 핵을 S기로 전이하는 것을 촉진하는 물질 無
○ M기의 세포에는 유사분열 유도인자 有
⑶ 유사분열(mitosis) = 핵분열(1회) + 세포질분열
① GFP(green fluorescent protein)
○ 세포내 유전자 발현의 위치나 정도를 알려주는 리포트 단백질
○ 살아 있는 세포의 상태로 관찰이 가능하여 많이 이용되는 해파리 유래 단백질


② 전기(prophase) : 염색체 46개, 자매염색분체 92개 / cell
○ 인 소실, 염색사 응축, 염색체 형성
○ 자매염색분체끼리 코헤신이 묶고 있다가, 동원체를 제외한 부위의 코헤신이 녹아버림
○ 중심체로부터 방추사(mitotic spindle) 생성
③ 전중기(prometaphase) : 염색체 46개, 자매염색분체 92개 / cell
○ 핵막 소실 : 전중기는 핵막소실 이후의 단계
○ 방추사의 미세소관이 염색체에 도달
○ 핵막이 소실돼야 방추사가 미세소관에 도달할 수 있음
○ 염색체 이동
○ 방추사가 미세소관에 도달해야 염색체를 이동시킬 수 있음
④ 중기(metaphase) : 염색체 46개, 자매염색분체 92개 / cell
○ 방추사가 완전히 완성
○ 모든 염색체가 세포의 적도판(equatorial plate)에 배열
○ 두 자매 염색분체의 동원체가 서로 반대방향의 극을 가리킴
⑤ 후기(anaphase) : 염색체 92개, 자매염색분체 92개 / cell
○ 세파라제에 의해 동원체 분리
○ 자매 염색분체들이 동원체 방추사 상의 디네인을 타고 서로 반대편 극 쪽으로 이동
○ 동원체 방추사 : 튜불린 특성상 (-)극은 미세소관 분해가 일어나고 (+)극에서 디네인의 빠른 분해가 일어남
○ 극성 방추사의 길이가 계속 길어짐에 따라 세포가 신장
⑥ 말기(telophase) : 염색체 92개, 자매염색분체 92개 / cell
○ 세포 신장은 계속됨
○ 각 극에서 염색체 주위에 핵막이 형성 → 핵 형성
○ 인 재형성, 방추사 소실
○ 염색체는 풀어져 염색사가 됨
⑦ 세포질 분열(cytokinesis) : 세포질 분열은 핵분열과 독립적으로 일어남

○ 세포질이 반으로 분리
○ 식물세포의 세포질분열 : 원심적 분열
○ 골지체에서 나온 골지소낭이 중기판 위치에 세포판 구성물질을 분비해서 세포판 형성
○ 세포판(cell plate) : 세포판은 비셀룰로오스성 탄수화물 섬유질인 펙틴으로 구성됨
○ phragmoplast를 따라 소낭이 이동 : phragmoplast는 미세소관, 미세섬유, 소포체 일부로 구성
○ 동물세포의 세포질분열 : 구심적 분열
○ 1st. 두 딸 세포 사이에 미세필라멘트 고리의 응축
○ 2nd. 원형질 만입(cleavage furrow) : 난할 홈이라고도 함
○ 3rd. 밖 → 안의 세포질 분리
○ 이러한 수축환(contractile ring)은 RhoA에 의해 조절됨
⑧ 세포분열 종료 : 염색체 46개, 자매염색분체 46개 / cell
⑨ 세포분열에 영향을 주는 물질
○ mitogen : DNA 합성과 세포분열을 일으키는 물질
○ 세포분열 억제제 : 아래 "유도 돌연변이" 참고
⑩ 각 단계별 마커 유전자
○ G1/S기 : CEP57, CDCA7L
○ S기 : ABHD10, CCDC14, CDKN2AIP, NT5DC1, SVIP, PTAR1
○ G2기 : ANKRD36C, YEATS4, DCTPP1
○ G2/M기 : SMC4, TMPO, LMNB1, HINT3
○ M기 : HMG20B, HMGB3, HPS4
○ G0기 : CDKN1A, CDKN1B, CDKN1C
⑷ 감수분열(meiosis) = 제1 감수분열(상동염색체 분리) + 제2 감수분열(반수체의 유사분열)


① 전기 Ⅰ (prophase Ⅰ) : 염색체 46개, 자매염색분체 92개 / cell
○ 1st. 염색체는 응축하고 더 조밀해짐. 핵막 소실
○ 2nd. 상동염색체간 교차에 의해 상동염색체끼리 약하게 결합
○ 3rd. 접합(synapsis) : SP(synaptonemal complex)에 의해 염색체끼리 강하게 결합
○ 4th. 상동염색체 쌍 사이에 교차로 인한 유전정보 교환 발생
② 중기 Ⅰ (metaphase Ⅰ) : 염색체 46개, 자매염색분체 92개 / cell
○ 4분 염색체가 적도판에 배열
③ 후기 Ⅰ (anaphase Ⅰ) : 염색체 46개, 자매염색분체 92개 / cell
○ 4분 염색체가 각 상동염색체의 쌍(2분 염색체)으로 분리되고, 서로 반대방향의 극으로 이동
○ (참고) 4분 염색체 : 염색체 2개, 2분 염색체 : 염색체 1개
④ 말기 Ⅰ (telophase Ⅰ) + 세포질 분열 : 염색체 46개, 자매염색분체 92개 / cell
○ 일부 생물에서 핵막이 재형성되지만, 사람은 그렇지 않음
○ 각각의 핵은 반수체(n)가 됨
⑤ 제Ⅰ 세포분열 종료 : 염색체 23개, 자매염색분체 46개 / cell
⑥ 전기 Ⅱ (prophase Ⅱ) : 염색체 23개, 자매염색분체 46개 / cell
○ 간기(염색체 복제 등) 없이 제2 감수분열이 시작
○ 염색체는 응축하고, 조밀해짐
○ 만약 핵막이 형성되었으면, 다시 사라짐
⑦ 중기 Ⅱ (metaphase Ⅱ) : 염색체 23개, 자매염색분체 46개 / cell
○ 2분 염색체가 적도판에 배열
⑧ 후기 Ⅱ (anaphase Ⅱ) : 염색체 46개, 자매염색분체 46개 / cell
○ 자매염색분체가 분리됨
○ 한 쌍의 상동염색체가 서로 반대 방향의 극으로 이동
⑨ 말기 Ⅱ (telophase Ⅱ) : 염색체 46개, 자매염색분체 46개 / cell
○ 염색체가 각각의 극으로 이동한 뒤, 염색체 주위로 핵막이 형성됨
⑩ 제 Ⅱ 세포분열 종료 : 염색체 23개, 자매염색분체 23개 / cell
⑪ 교차(crossing over)
○ 교차 : 상동염색체의 분체들 사이에 발생하는 부분적 유전자 교환으로 새로운 형태의 염색체가 형성되는 현상
○ 교차점(chaisma)
○ 교차율 : 고전유전학에서는 유전자 간 거리와 결과적으로 교차될 확률이 비례한다고 가정
○ 1회 감수분열에서 약 30번의 교차가 일어남
⑫ 무작위 정렬 : 제1 감수분열 동안 각 쌍의 상동염색체들의 정렬과 분리는 독립적이므로 다양한 생식세포 생성
⑬ 개인의 유전정보 다양성(인간)
○ 제1 감수분열 결과 생성된 생식세포의 염색체 다양성 : 223 +교차
○ 수정란의 염색체 다양성 : (223 + 교차) × (223 + 교차)
3. 유전자의 수평적 전달 [목차]
⑴ 바이러스
⑶ 이동성 DNA
⑷ 원형질 연락사
4. 세포주기의 조절 [목차]
⑴ 분열기를 조절하는 조절단백질
① 사이클린(cyclin) : 세포주기 중 양이 계속 변하며, 각 단계가 종결되면 관련 사이클린은 모두 분해됨
○ 프로테아좀에 의해 분해
② CDK(cyclin-dependent kinase) : 세포주기 중 양은 일정하며, 사이클린의 양에 따라 활성이 바뀜
○ CDK1 : M기 조절
○ CDK2 ~ 8 : G1, S기 조절
③ MPF(M-phase promoting factor)
○ CDK1과 cyclin B를 통칭, 분열기 포유류 세포의 세포질에 존재
○ 역할 : 염색체 응축, 방추사 신장, 핵막 붕괴
○ 동원체에 방추사가 결합 → APC 활성 → MPF 억제
④ CDC(cell division cycle) : 효모에서 MPF 역할을 하는 물질
○ CDC2 : M기 조절
○ CDC2 kinase : M기 조절
○ 기타 CDC kinase : G, S기 조절
○ CDI(CDK inhibitor) : CDK에 작용하여 CDK의 활성화를 저해함
⑤ 후기촉진인자(APC, anaphase promoting complex)
○ 세포분열 후기가 되면 APC(anaphase promoting complex) 활성 → 세큐린 억제 → 세파라제 촉진
○ 구체적인 메커니즘 : APC는 세큐린에 유비퀴틴을 결합시켜서 세큐린이 분해되도록 함
○ APC가 활성화되면 MPF가 억제
○ APC가 활성화하면 cdc20과 함께 M cyclin이 프로테아좀에 의해 분해되도록 함
○ 종양 억제에 중요
⑵ 검문점(checkpoint)
① 검문점을 통과해야 세포주기 진행
② 검문점 : 총 5개 존재
③ G1 검문점 : S 단계로 나아가기 위한 지점
○ 요인 : 세포분열의 필요성, 성장인자(growth factor), 세포의 크기, 충분한 영양소, 손상된 DNA
○ 메커니즘 : CDK4, 6 + 사이클린 D
○ 이 지점을 통과하지 못하는 이상 분열하지 않는 상태인 G0 상태에 머무름 (예 : 신경, 근육)
○ CDK4/6 inibitor : palbociclib, abemaciclib, ribociclib
④ G1-S 경계
○ 메커니즘 : CDK2 + 사이클린 E
⑤ S 검문점
○ 메커니즘 : CDK2,1 + 사이클린 A
⑥ G2 검문점
○ 요인 : DNA 복제의 정상여부, 세포의 크기
○ 메커니즘 : MPF(CDK1 + 사이클린 B) → DNA 복제 촉진
⑦ M 검문점 : 중기 검문점
○ 요인 : 모든 염색체의 미세소관 부착 여부
○ 잡종 생물이 번식하지 못하는 이유
⑶ G1 검문점 메커니즘 : S기 전이 촉진 (예 : 혈소판의 PDGF)
① 1st. 생장인자(growth factor) → Ras
② 2nd. 신호전달
○ 2nd - 1st. Ras : GDP → GTP
○ 2nd - 2nd. GTP → Raf
○ 2nd - 3rd. Raf → MEK
○ 2nd - 4th. MEK → MAP kinase
○ 2nd - 5th. MAP kinase가 핵 안으로 이동
③ 3rd. 사이클린 D, 사이클린 E 합성
○ 3rd - 1st. MAP kinase → myc
○ 3rd - 2nd. myc → 사이클린 D, 사이클린 E 유전자 전사
⑷ G1 검문점 메커니즘 : S기 전이 억제, p53이 주로 관여
① (참고) G1기는 모든 세포주기의 시작이기 때문에 억제 메커니즘이 다수 존재
② 1st. 자외선 → p53에서 mdm 단백질이 제거되어 p21이 됨
③ 2nd - 1st. p21은 CDK4-사이클린 D와 CDK2-사이클린 E를 억제하여 S기 전이 억제(예 : E2F 억제)
④ 2nd - 2nd. 세포 손상이 심하면 p21은 Bax 활성화 → 시토크롬 C을 세포질로 방출 → Caspase → 세포예정사
○ 시토크롬 C(cytochrome C) : 미토콘드리아 전자전달계에 관여하고 진화적으로 보존. 막간공간에 위치. 내막에 부착
⑸ S 검문점 메커니즘 : G1 cdk는 Rb를 불활성화시켜서 S기가 일어나게 함
① 1st. CDK4-사이클린 D와 CDK2-사이클린 E가 전사인자인 E2F 농도 증가
② 2nd. Rb와 E2F 결합 → 사이클린-CDK 복합체 불활성화
○ Rb 단백질 : E2F 억제
③ 3rd. 사이클린-CDK가 2ATP 사용 → Rb 인산화
④ 4th. Rb가 인산화되어 E2F와 탈결합
⑤ 5th. E2F가 핵으로 이동 → 사이클린 A 생성 촉진
⑥ 6th. CDK2-사이클린 A 결합 → 전사인자로 작용하여 S기 완성 및 사이클린 B 유전자 전사
⑹ G2 검문점 메커니즘(효모)
① 1st. CDK1과 사이클린 B(M 사이클린)와 결합하여 불활성 사이클린-CDK 복합체 형성
② 2nd. 사이클린-CDK 복합체는 WEE1에 의해 인산화되어 억제됨
○ WEE1 : kinase의 일종
③ 3rd. CAK(CDK activating kinase)에 의해 인산화되어 활성화되나 WEE1에 의해 활성이 나타나지 못함
④ 4th. CDC25는 사이클린-CDK 복합체의 인산기를 제거하여 CAK에 의한 사이클린-CDK복합체 활성화가 나타남
○ CDC25 : phosphatase의 일종
⑤ 5th. 활성화된 사이클린-CDK 복합체는 CDC25를 활성화하여 WEE1을 불활성화
⑺ 세포분열 억제제 (ref)
① M기 특이적 억제제
○ antimicrotubule agent : epothilones, halichondrin B analogue, taxanes, vinca alkaloid
○ topoisomerase Ⅱ inhibitor : anthracemedione, anthracycline, epipodophyllotoxin
② S기 특이적 억제제
○ DNA antimetabolite : folate antagonist, purine analogue, pyrimidine analogue, hydroxyurea
○ 항엽산제 : methotrexate
○ topoisomerase Ⅱ inhibitor : anthracemedione, anthracycline, epipodophyllotoxin
③ 여러 세포분열 단계에 영향을 주는 억제제
○ antitumor antibiotics : bleomycin, dactinomycin, mitomycin
④ 세포분열 단계 자체와는 무관한 억제제
○ alkylating agent : alkyl sulfonate, ethylenimine, nitrogen mustard, nitrosurea, platinum analogue, triazene
5. 돌연변이 [목차]
⑴ 원인 1. 자연발생 돌연변이
① 토토머화(tautomerization) : 이성질체 형성에 의해 다른 염기와 결합 형성
② 탈아미노 과정
○ 뉴클레오티드 종류에 따른 구조
○ 아미노 염기 : 아미노기(-NH2)만 있는 염기, A, C
○ 케토 염기 : 케톤기(C=O)가 있는 염기, T, G, U, I
○ 사이토신(C)의 탈아미노화 : C 염기의 탈아미노화, 우라실(U)로 변화, 티민(T)으로 변화 결과 최종적으로 G≡C가 A=T가 됨
○ 아데닌(A)의 탈아미노화 : A 염기의 탈아미노화. 하이포크산틴(hypoxanthine)으로 변화. 이노신산(I, inosinic acid)으로 변화 결과 최종적으로 A=T가 G≡C가 됨
③ 탈퓨린화 : 퓨린과 탄소 골격은 비교적 결합력이 약함
④ 반복서열 (예 : CAG 반복서열과 헌팅턴 병)
⑤ 복제과정에서의 실수 : 대장균과 진핵생물의 DNA 복제과정 중 돌연변이율은 1회 / 1010 nucleotides로 비슷
○ (참고) 두 개체군 A와 B를 비교시 돌연변이의 발생 빈도가 높다 또는 낮다는 진술은 거의 틀림
⑵ 원인 2. 유도 돌연변이
① DNA 변형물질
○ 아질산 : 탈아미노 반응 유도
○ 아플라톡신(aflatoxin) : 곰팡이 독소 → G 염기 변형 → 간암
② 알킬화제(알킬화 물질, alkylating agent) : CH3나 CH3CH2를 뉴클레오티드의 아미노 그룹이나 케토그룹에 공여하는 물질
○ EMS(ethyl methyl sulfonate) : 대표적인 알킬화물질
○ nitrogen mustard : bendamustine, cyclophosphamide, estramustine, ifosfamide, mechlorethamine, melphalan
○ platinum analog : carboplatin, cisplatin, oxaliplatin 등
○ triazene : dacarbazine, procarbazine, temozolomide 등
○ 해독제 : MGMT(O6-methylguanine-DNA methyltransferase) : EMS 등 알킬화물질에 대한 해독제
③ DNA 유사 물질
○ 2-AP(2-amino purine) : 티민 또는 사이토신과 염기쌍 형성
○ 5-BU(5-bromouracil) : 티민 유사체. 아데닌 또는 구아닌과 염기쌍 형성
○ BrdU(bromodeoxyuridine) : 티미딘 유사체. S기에 있는 세포를 레이블링 할 때 사용
○ hydroxylamine : 사이토신에 수산기 첨가. 수산기가 첨가된 사이토신은 아데닌과 결합
○ ENU(N-ethyl N-nitrosourea) : 무작위 점돌연변이 유발 물질
○ 5-FU(5-fluorouracil) : 우라실 유사체
○ 우라실의 5번 탄소에 H 대신 F가 치환돼 있음
○ DPD(dihydropyrimidine dehydrogenase)에 의해 5-FU는 DHFU(dihydrofluorouracil)로 전환됨
○ 약 80%의 administered 5-FU가 간에서 DPD에 의해 분해됨
○ 6-MP(6-mercaptopurine)
○ capecitabine (Xeloda®), cytarabine (Ara-C®), floxuridine, fludarabine
○ gemcitabine (Gemzar®)
○ first line drug of pancreatic cancer
○ pyrimidine antimetabolite
○ hydroxycarbamide
○ pemetrexed (Alimta®), phototrexate
④ 항엽산제
⑤ 삽입물질
○ 아크리딘 오렌지(acridine orange) : 편평한 고리분자. 염기쌍 사이로 삽입하여 틀이동 돌연변이를 일으킴
○ EtBr : 염기쌍 사이로 삽입하여 틀이동 돌연변이를 일으킴
○ benzopyrene : DNA 주홈의 염기쌍 사이에 삽입 → 폐암
○ MCA(methylcholanthrene) : 화학적 돌연변이원
⑥ 자외선 조사 : 피리미딘 이합체 형성 → 복제 시 결실 돌연변이 유발 → 피부암 발병
⑦ 방사선 : 방사선에 의해 생산된 자유라디칼이 염기나 당-인산 골격을 공격
⑶ 종류 1. 점 돌연변이(point mutation) : 유전자 돌연변이
① 염기치환 돌연변이
○ 정의 : 유전자의 염기 대체로 인한 돌연변이
○ 표현형에 따른 분류
○ 침묵 돌연변이 : 유전암호의 중복성으로 염기가 대체되어도 동일한 아미노산 암호로 표현형에 차이가 없음
○ 미스센스 돌연변이(과오 돌연변이) : 대체 염기로 인해서 다른 아미노산 암호로 변경
○ 넌센스 돌연변이(정지 돌연변이) : 암호가 종결코돈으로 변경되어 의미상실. 길이가 짧아짐
○ 중립 돌연변이 : 유사 성질의 아미노산으로 변화
○ 전사 종결될 부위가 종결되지 않는 경우
○ 종결코돈이 유의미한 아미노산으로 번역하여 길이가 길어질 수도 있음
○ DNA 비암호부위 점 돌연변이 : 인트론의 스플라이싱 효율을 떨어트림
○ 프로모터의 변이 : 전사가 안 됨
○ 염기치환 돌연변이의 구분
○ 염기전이(transition) 돌연변이 : 퓨린이 다른 퓨린, 피리미딘이 다른 피리미딘이 되는 돌연변이
○ 염기전환(transversion) 돌연변이 : 퓨린이 피리미딘, 피리미딘이 퓨린이 되는 돌연변이
○ 염기전이 돌연변이는 비교적 아미노산이 변할 확률이 작으며 동일 부위 돌연변이로 복귀 가능성이 높음

Figure. 5. 염기전이 돌연변이(㉠)와 염기전환 돌연변이(㉡)
○ 전체 게놈 : 염기전이 돌연변이 / 염기전환 돌연변이 ≃ 2
○ protein-coding gene : 염기전이 돌연변이 / 염기전환 돌연변이 > 3
② 틀이동 돌연변이
○ 유전자의 염기 결실 또는 삽입으로 번역틀이 이동되는 돌연변이
③ 복귀 돌연변이
○ 동일한 돌연변이원을 가하여 돌연변이 개체가 정상 자손을 생성하는 경우
○ 거의 대부분 치환 돌연변이만 가능
⑷ 종류 2. 염색체 돌연변이(chromosomal mutation)
① 결실(deletion)
○ 결실고리(deletion loop) : 유전자 지도 작성시 이용
○ 근거리 유전자가 동시 결실이 잘 나타남
② 중복(duplication)
○ 보상고리(compensation loop)
③ 역위(inversion)
○ 편동원체성 역위(무동원체성 역위, paracentric inversion) : 정상 역위 50 %, 무동원체성 25 %, 복동원체성 25 %
○ 협동원체성 역위(복동원체성 역위, pericentric inversion) : 정상 100 %
④ 전좌(translocation)
○ 상호전좌 : 두 염색체 간에 유전정보 교환. 십자형 전좌를 형성
○ 홀리데이 모델(Holliday model)
○ 예 : 8번 → 14번
○ 비상호전좌 : 한 염색체가 다른 염색체에 일방향적으로 유전정보 전달
○ 예 1. 로버트슨 전좌(Robertsonian translocation) : 가족성 다운증후군을 야기
○ 출생아의 1/1000에 해당함
○ 1st. 14번 장완과 21번 장완 연결 : (14, 14), (21, 21) → (14, 14-21), (21, ×)
○ (참고) 14-21에서 동원체는 14번에서 유래하므로 14번처럼 행동함
○ 2nd. 14번 단완과 21번 단완 결실
○ 3rd. 생식세포 : (14, 21) || (14, ×) || (14-21, 21) || (14-21, ×)
○ 4th. 정상 생식세포 (14, 21)과 생식 결과
○ (14, 14), (21, 21) : 정상, 25%
○ (14, 14), (21, ×) : 유산, 25%
○ (14, 14-21), (21, 21) : 가족성 다운증후군, 일반적인 다운증후군과 달리 생식 가능
○ (14, 14-21), (21, x) : 대물림, 25%

14번과 21번의 비상동염색체 사이에 전좌가 발생
○ 예 2. 만성골수 백혈병(CML, chronic myelogenous leukemia) : 상호전좌
○ abl 유전자 : 타이로신 인산화효소를 암호화
○ bcr 유전자 : 프로모터가 있어 활성이 큼
○ 필라델피아 염색체 : abl 유전자와 bcr 유전자가 같이 있는 재조합 염색체

⑸ 종류 3. 염색체 비분리
① 염색체 비분리(nondisjunction) : 상염색체 및 성염색체의 이수성을 야기

○ Ⅰ분열 비분리 : (n+1, n+1, n-1, n-1). 정상 생식세포가 없음. 생식세포 내 동일 유전자 중복 없음
○ Ⅱ분열 비분리 : (n+1, n-1, n, n). 정상 생식세포 50%. n+1 생식세포 내 동일 유전자 중복 있음
② 상염색체 이수성 : 한두 개의 염색체가 많거나 적음
○ 0염색체성 : 상동염색체 한 쌍 상실, 자궁 착상 전 치사
○ 1염색체성 : 염색체 1개 상실, 배아 치사
○ 3염색체성 : 배아 또는 태아 치사
○ Patau syndrome (13번 3염색체성)
○ Edward syndrome (18번 3염색체성)
○ 다운증후군(21번 3염색체성, Down syndrome) : 1/750 출생, 특징적인 안면구조, 정신장애, 짧은 신장, 심장결함, 짧은 수명, 호흡기 질병의 취약성, 산모의 연령이 높을수록 빈번
○ Haplo Ⅳ : 초파리의 4번 염색체 결실
③ 성염색체 이수성 : 한두 개의 염색체가 많거나 적음, 효과가 심각하지는 않으며 정상 수명
○ 이유 : Y 염색체는 정보량이 적고, X 염색체는 하나만 활성(나머지는 바소체 형성)이기 때문
○ XXX (3X 증후군) : 1/1000 출생, 정신장애 빈도가 높으며, 표현형은 정상, 준 정상
○ XYY (2Y 증후군) : 1/2000 출생, 키가 큰 경향, 표현형은 정상, 가벼운 정신 장애, 좀도둑
○ XXY, XXXY (클라인펠터 증후군) : 1/2000 출생, 남성, 장신, 성적 미성숙, 왜소 고환, 불임, 정신장애
○ XO (터너증후군) : 1/5000 출생, 99% 자연 유산, 왜소, 성적 불완전성숙
○ XYY, XYYY (야콥증후군)
④ 배수성 : 염색체의 수가 n의 배수로 증가하는 돌연변이
○ 동질배수성(autopolyploidy) : 2n (식물) 개체가 4n 개체가 된 뒤 2n 동일종과 번식하여 3n 개체를 생성
○ 콜히친 : 방추사 중합 저해제, 튜불린 이량체에 결합하며 세포분열을 중기에서 멈추게 함
○ 품종개량을 목적으로 콜히친을 사용하여 동질배수성을 만드는 경우가 많음
○ (참고) 택솔 : 방추사 탈중합 저해제, 항암제로 사용
○ 이질배수성(이질4배체, 복2배체, allopolyploidy) : 가까운 종들 사이의 번식에 의한 (식물) 개체
○ 진화의 메커니즘
○ 1st. AA 개체와 BB 개체 사이에서 AB 개체 생성
○ 2nd. AB 개체가 홀수 염색체라면 번식력이 없으므로 배수성을 통해 번식력 회복, 즉 AABB 생성
○ 3rd. AABB 개체와 AABB 개체 사이에서 번식이 가능한 AABB 개체 생성
○ 예 1. 씨 없는 수박(3n)
○ 예 2. 3배수체(3n)은 총 임신의 1 ~ 3% → 대부분 출산 불가, 생존 불가
⑹ 종류 4. 온도 민감성 돌연변이
① 허용온도
② 제한온도
6. 암 [목차]
⑴ 정의
① 종양(tumor) : 조절되지 않는 세포분열로 만들어진 기능이 없는 세포 덩어리
② 양성 종양(benign tumor) : 종양 중 주위의 조직에 영향을 주지 않을 때 (≠ 암)
③ 악성 종양(malignant tumor) : 종양 중 주위 조직을 침범하는 경우 (암)
④ 전이 : 암세포가 빠져 나와 다른 곳에 새로운 종양을 만들 경우 (암)
⑤ 정상세포 → 잠재적 종양세포(신호 없어도 분열) → 양성 종양 → 악성 종양 → 전이
⑥ 종양학(oncology) : 암에 관한 학문
⑵ 암세포의 특성
① 정상세포
○ 신호에 의해서 분열하며, 필요한 시기까지 생존
○ 특수한 분화 기능 수행
○ 세포 간, 세포외기질 간 결합으로 정위치, 타 영역 이동 및 침범 불가
② 암세포
○ 유전적 변이로 정상 조절기능 붕괴, 반사회적 행동(abnormal cell behavior)
○ 1단계. 무제한 분열 능력 → 양성종양(benign tumor)
○ 암세포는 정상세포에 비해 세포핵의 부피가 상당히 큼
○ 2단계. 타 세포 영역 침범(invasion) → 전이(metastasis)
○ 림프관이나 혈관을 통해 다른 부위로 전이
○ 암의 크기가 2 ~ 3 mm가 돼도 전이될 수 있음
○ 3단계. 2차 종양 형성 → 악성종양(malignant tumor)
○ 4단계. 전이 암세포는 순환계나 림프계를 통하여 몸 전체로 이동
③ 암세포의 분포
○ 암세포의 4 ~ 5%는 줄기세포
○ 정상 면역 기능은 종양세포 1,000만 개까지 파괴
○ 임상적으로 암이 발견될 때 최소한 10억 개의 종양세포를 포함
⑶ 암조직의 특성
① 암조직의 형성
○ 암조직이 5 mm로 자라는 데 5 ~ 10년이 소요
○ 발병 연령이 낮을수록 암 증식속도가 빠름
② 특징 1. 암조직의 크기가 2 ㎣ 이상이 되면 혈관생성(angiogenesis)이 시작됨
③ 특징 2. 암조직은 활발히 당 분해를 하기 때문에 정상세포의 pH 7.4보다 더 산성을 띔 (pH 7.2 이하)
④ 특징 3. 암조직은 정상 조직보다 온도가 약간 높음 : 혈관이 불완전하여 열 방출이 잘 되지 못하기 때문
⑤ 특징 4. Warburg effect (aerobic glycolysis) : 암에서 산소 농도와 무관하게 해당과정과 젖산 생성이 증가하는 현상
⑥ 특징 5. 전이 : 암세포는 E/P-Cadherin의 발현이 줄어들어 세포 간 결합능력을 잃고 결과적으로 전이가 증가함
⑦ 특징 6. 고칼슘 혈증 : 혈중 칼슘 농도를 높임. 나트륨 채널을 닫히게 하여 무기력증을 유발
⑷ 암의 발생
① 암 위험인자 : 암 발생을 증가시키는 요인들로 모든 암의 약 80 ~ 90%는 생활습관 및 환경요인에 의해 발생
○ 흡연 : 담배는 여러 발암물질 함유, 자유 라디칼 발생을 증가시켜 DNA 손상
○ 고지방, 저섬유 식습관
○ 운동 부족은 면역계가 건강하지 못하고, 비만으로 인한 암 발생 위험 증가
○ 음주 : 술과 담배는 곱셈의 법칙으로 위험을 증가
○ 노화 : 면역계가 악화, 돌연변이 누적
○ 빈번한 세포 분열
○ 난소 배란 후 손상 회복
○ 소화관 상피운동으로 생긴 마찰 손상 회복
○ 방사능 물질, 고압선 근처 : 백혈병 등의 발생 빈도 높임
② 유전자군 1. 원종양 유전자(원발암 유전자, proto-oncogene)
○ 세포주기를 조절하는 유전자로 성장인자, 수용체 단백질 유전자를 암호화하는 경우가 많음
○ 우성 발현 : 상동 염색체 하나에 돌연변이가 나타나면 돌연변이 증상이 나타남
○ 예 1. EGFR(epithermal growth factor receptor)
○ ErbB1 또는 HER-1이라고도 함
○ EGF와 수용체가 결합하면 구조의 변화를 일으켜 kinase domain이 활성화
○ SH2는 tyrosin의 sequence를 인식
○ 억제제
○ erlotinib
○ gefitinib (Iressa) : EGFR-TKI(EGFR-tyrosine kinase inhibitor)를 억제하는 항암제. FDA-approved
○ cetuximab (Erbitux) : FDA-approved
○ IgG1 isotype
○ binding site : Q384, Q408, H409, K443, K465, I467, S468, F352, D355, P387
○ immunogenic activity가 있음
○ panitumumab (Vectibix) : FDA-approved
○ IgG2 isotype
○ binding site : P349, P362, D355, F412, I438
○ immunogenic activity가 없음
○ lapatinib (Tyverb) : tyrosine-kinase domain을 억제하여 downstream signalling을 직접 억제
○ afatinib : tyrosine-kinase domain을 억제하여 downstream signalling을 직접 억제
○ sapitinib
○ 예 2. 난소암/유방암의 HER2(human epidermal growth factor receptor type2) : erbB-2라고도 함
○ 구조 : (세포 외) Ⅰ - Ⅱ - Ⅲ - Ⅳ - 세포막 통과 부분 - tyrosine-kinase domain (세포 내)
○ Ⅱ : dimerization domain
○ 기능
○ HER2가 과발현되면 자가인산화로 인해 세포 과다 증식, aggressiveness, tumorigenesis 등이 유도됨
○ ovarian cancer case의 15-40%에서 과발현됨
○ 메커니즘 : PI3-kinase signalling을 이용함
○ 억제제
○ pertuzumab : Ⅱ를 억제하여 수용체의 dimerization을 억제함. FDA 승인
○ trastuzumab, margetuximab : Ⅳ을 억제. ADCC와 관련. FDA 승인
○ trastuzumab emtansine (T-DM1), trastuzumab deruxtecan : trastuzumab에 항암제를 결합한 약제. FDA 승인
○ lapatinib (Tyverb) : tyrosine-kinase domain을 억제하여 downstream signalling을 직접 억제. FDA 승인
○ afatinib : tyrosine-kinase domain을 억제하여 downstream signalling을 직접 억제. FDA 승인
○ neratinib : tyrosine-kinase domain을 억제하여 downstream signalling을 직접 억제. FDA 승인
○ sapitinib
○ CI-1033
○ 예 3. HER3 : erbB-3라고도 함
○ 억제제 : sapitinib
○ 예 4. IGF-1R
○ 구조
○ extracellular ligand-binding domain : 두 개의 α 소단위체가 존재함
○ transmembrane domain
○ cytoplasmic domain : 두 개의 β 소단위체가 존재함
○ 총 3개의 이황화결합이 있음 : α-α, α-β, α-β
○ β 소단위체는 티로신 인산화효소로 기능함
○ IGF-1R은 IGF-1과 IGF-2를 리간드로 올 수 있음
○ IGF-1R이 활성화되면 다음 세 신호전달 경로가 작동함
○ STAT3
○ PI3K → AKT (PTE가 억제함) → mTOR → S6K
○ GRB2 → Ras / Raf → MEK → MAPK
○ IGF-1R은 악성 종양을 유발시킴
○ 억제제 : AXL1717, linsitinib (현재 3상 진행중)
○ 예 5. IR (insulin receptor)
○ 예 6. Ras (rat sarooma)
○ 타이로신 인산화효소에 의해 활성화되는 GPCR로 신호전달경로에 관여
○ MAPK를 활성화하는 데 중요한 역할
○ 정상 기능 : 세포 증식, 세포 분화, 세포 생존
○ Ras는 다시 H-Ras, K-Ras, N-Ras 등으로 구분
○ GTPase activating protein 기능이 결실되거나 분해 저항성 단백질이 축적되면 Ras 과다 활성
○ 이로 인해 성장인자 비의존성 분열을 하게 되어 암세포로 변이하게 됨
○ 암의 성장인자 비의존성 분열의 대부분은 Ras 때문
○ 예 7. myc
○ 종류 1. c-myc (MYC)
○ 바이러스에 있는 v-myc과 유사하기 때문에 가장 먼저 발견된 myc
○ 일반적으로 종양에서 c-myc 발현율이 높음
○ 8번 염색체에 있으며 모든 유전자의 15%의 발현을 조절하는 것으로 알려져 있음
○ c-myc 유전자가 항체 유전자를 암호화하는 14번 염색체에 재조합 → 발현율 ↑ → Burkitt's lymphoma 발생
○ 종류 2. l-myc (MYCL)
○ 종류 3. n-myc (MYCN)
○ 예 8. abl-bcr
○ 예 9. c-erbB, c-mx, c-kit, RARa, Eb, 사이클린, CDK 2, 4
○ 예 10. src
○ 예 11. β-catenin
○ 예 12. BRAF
○ 600번째 아미노산이 발린(V)에서 글루탐산(E)이 되면서 종양 유전자가 됨
○ 종양 유전자가 되면 지속적으로 kinase를 활성화시킴
○ 종양별 B-RAF 돌연변이의 빈도 : melanoma (60%), colon (15%), ovarian (30%), thyroid (30%)
○ 억제제 : dabrafenib, vemurafenib (Zelboraf), PLX4720
○ 예 13. MDM2, MITF, PPM1D, KAT7
○ 예 14. YAP (Yes associated protein)
○ 예 15. ALK
③ 유전자군 2. 종양 유전자(oncogene) : 원종양 유전자의 돌연변이로 DNA의 변화
○ 원종양 유전자가 돌연변이로 종양 유전자가 되면 성장인자가 없는데도 세포분열이 과다 촉진
○ 방식 1. DNA 염기 돌연변이로 암호화 단백질의 구조 또는 기능 변화에 의해 고활성
○ 방식 2. 유전자의 재배치에 의한 과발현 (예 : 프로모터 바로 앞에 유전자가 위치하게 된 경우)
○ 방식 3. 유전자의 반복수 증가에 의한 과발현
○ 예 1. 원발암유전자에 돌연변이가 발생한 경우
○ 예 2. 바이러스가 종양 유전자처럼 행동하는 경우
| 바이러스 타입 | 바이러스 계열 | 관련 암 질환 |
| HTLV-I (human T-cell leukemia/lymphoma virus) |
retrovirus (RNA virus) | T-cell leukemia/lymphoma |
| hepatitis B | hepadnavirus (hepatotropic DNA virus) | hepatocellular carcinoma |
| hepatitis C | hepadnavirus | hepatocellular carcinoma |
| Epstein-Barr | herpesvirus (DNA virus) | nasopharyngeal carcinoma Burkitt lymphoma immunoblastic lymphoma Hodgkin disease |
| HHV-8 (KSHV) (human herpesvirus-8) (Kaposi sarcoma herpesvirus) |
herpesvirus | Kaposi sarcoma body cavity lymphoma |
| HPV serotypes 16, 18, 33, 39 | papillomavirus (DNA virus) | cervical carcinoma anal carcinoma |
| HPV serotypes 5, 8, 17 | papillomavirus | skin cancer |
Table. 3. 바이러스가 종양 유전자처럼 행동하는 경우
④ 유전자군 3. 종양억제 유전자(tumor suppressor gene)
○ 세포주기 검문점에서 세포분열을 정지시키거나 손상된 DNA를 수선하는 단백질 유전자
○ 열성 발현 : 상동 염색체 모두에 돌연변이 되어야 돌연변이 증상이 나타남
○ 예 1. BRCA2 유전자
○ 13번 염색체상에 위치, DNA 손상 회복에 관련된 단백질을 암호
○ BRCA 1/2 돌연변이는 유방암이 걸릴 위험성이 높은지 낮은지 가늠할 수 있음 : 안젤리나 졸리와 관련
○ BRCA 1/2 돌연변이는 ionizing radiation이 잘 들을지 안 들을지 여부 판단에 활용 가능
○ BRCA 1/2 돌연변이는 PARP (poly(ADP-ribose) polymerase) 억제제가 잘 들을지 여부 판단에 활용 가능
○ PARP는 SSB(single strand break)를 수선하는 효소
○ BRCA는 homologous recombination을 통해 repair 하는 효소
○ PARP inhibitor + BRCA mutant인 경우에만 bypass가 불가능하여 cancer cell이 비로소 사멸될 수 있음
○ BRCA 1/2 돌연변이는 유방암 전이 예후 판단에 활용 가능
○ 예 2. p53 유전자 : 세포주기 전체에 작용
○ 기능 1. p21 전사 증가 : cell cycle arrest를 야기함
○ 기능 2. 세포분열을 억제하는 특정 miRNA 발현과 관련
○ 기능 3. DNA 복구에 직접적으로 관여하는 유전자 발현 활성화
○ 기능 4. DNA 손상시 사이클린-CDK 복합체 억제
○ 기능 5. 세포자살 유도 가능 : BH3-only protein을 암호화하는 유전자 발현 증가
○ 구조 : 393개의 아미노산으로 구성됨
○ (참고) p53의 어느 부위에 이상이 생길 때 암 억제 기능을 잃는지의 실마리를 제공함
○ p53 돌연변이의 약 86%가 120 ~290번째 아미노산 부위에서 발생
○ 종양세포의 약 50%에서 위와 같은 돌연변이가 발생
○ (참고) 1989년 4월 Science에서 발암유전자로 알려졌던 p53이 종양억제 유전자라는 것을 증명
○ (참고) 그 후 약 20년간 이와 관련된 5만 편 이상의 연구논문이 발표됨
○ 예 3. pRb1 : G1기에 작용, E2F 억제
○ 예 4. bcl2 : Bax 억제
○ bcl2, bcl-xl은 모두 세포예정사를 억제하며 고형암 및 혈액암에서 과발현
○ ABT263 : bcl2, bcl-xl 억제
○ navitoclax : bcl2, bcl-xl, bcl-w inhibitor
○ 예 5. APC
○ 예 6. Rb : Rb 단백질은 G1 검문점을 통해 세포주기가 진행하지 못하게 하는 물질
○ 예 7. DCC
○ 예 8. p16 유전자
○ 예 9. VHL(von Hippel-Lindau tumor suppressor) : 프로탁 기술에서 널리 이용됨
○ 예 10. ATM
⑤ 유전자군 4. 암세포의 불멸화 메커니즘
○ 암세포에는 텔로머레이스 존재
○ 염색체 끝부분에 있는 텔로미어 DNA를 보호해 일반 세포의 분열횟수(50회)를 넘게 계속 분열
⑥ 유전자군 5. 유전성 암 증후군 : 암 증후군과 연관된 돌연변이 유전자를 차례로 나타내면 다음과 같음
○ familial retinoblastoma : RB1
○ Li-Fraumeni : TP53 (p53 단백질)
○ familial adenomatous polyposis : APC
○ hereditary nonpolyposis colorectal cancer : MLH1, MSH2, MSH6, PMS1, PMS2
○ Wilms' tumor : WT1
○ breast and ovarian cancer : BRCA1, BRCA2
○ von Hippel-Lindau : VHL
○ Cowden : PTEN
○ diffuse gastric cancer & ILC : CDH1
○ Peutz-Jeghers syndrome : STK11
⑦ 유전자군 6. 기타 암에서 과발현되는 유전자
○ 트랜스페린
⑧ 다중 충돌 모델 : 암 발생은 여러 돌연변이를 필요로 함
○ 세포분열이 잦은 상피조직에서 빈발하는 이유
○ 원종양 유전자와 종양억제 유전자
○ 정상세포에 원종양 유전자가 돌연변이 시 양성종양 (≠ 암)
○ 양성종양에 종양억제 유전자가 모계, 부계 모두 돌연변이 시 악성종양 (= 암)
○ 양성 종양이 암으로 진행되기 위해 축적돼야 하는 돌연변이
○ 혈관신생 : 종양은 자신에게 혈액을 공급하게 함
○ 접촉저지 및 부착의존성(anchorage dependence) 상실 : 세포들이 층층 쌓이고 암세포가 다른 위치로 이동 가능
○ 밀도 의존성 생장 억제(density-dependent inhibition)의 상실
○ 불멸화 : 텔로머라아제 활성화로 세포분열 횟수를 제한받지 않음
○ 돌연변이는 유전되며, 대부분 돌연변이는 그 사람의 생애 기간 동안 생성
○ 한 세포에 최소 5~6회 독립적인 돌연변이가 필요
○ 일반적으로 약 10~20년 소요
○ whole genome sequencing 연구 결과 한 암에 몇 천 ~ 몇 만의 mutation이 있음
○ 그 mutation들 중 5개 정도만 driver mutation이고 나머지는 passenger mutation임
○ passenger mutation들은 개수가 훨씬 많고 driver mutation 하에서만 발현이 나타남
⑨ 예시 : 대장암·직장암은 가장 많은 암 중 하나
○ APC 종양 억제 유전자 결손 : 과도한 상피세포 증식(극성, 접촉저지 상실)으로 폴립 형성(용종)
○ 대장암은 가계성 선종 폴립성(APC)이라는 유전자 상의 돌연변이가 흔히 발견
○ APC 유전자 돌연변이는 열성으로 작용
○ Ras 종양 유전자 : 신호 없이 세포증식, 작은 양성 종양 생성(class Ⅱ 선종, adenoma)
○ 암의 성장인자 비의존성 분열은 대부분 Ras 때문
○ 종양 억제 유전자 DCC(deleted in colon cancer)
○ 종양 억제 유전자 p53 결실 : DNA 손상관련 G1/S 확인지점 실패 → 빠르게 돌연변이 누적 → 악성종양 생성
○ 35%의 암 환자에서 p53 돌연변이가 관찰
○ 항전이 유전자의 결실
○ 혈관신생, 침윤, 전이가 일어남
○ 혈관신생(angiogenesis) : 혈관, 림프관이 암 덩어리쪽으로 자람
○ 침윤 : 혈관이나 다른 장기로 암세포가 침투해 들어감
○ 전이 : 다른 장기로 암세포가 옮겨감
○ 순서는 중요하지 않으며 조건만 맞으면 암 생성
⑸ 암의 종류 : 발생하는 조직에 따른 구분
① 암종(carcinoma) : 상피조직. 발생 빈도가 높고 증식과 침윤이 빠르며 고령에 빈발
② 선암종(adenocarcinoma) : 샘상피조직, 분비샘 등
③ 편평세포암종(squamous cell carcinoma) : 표피세포 등. docetaxel을 처방
④ 대세포암종(large cell carcinoma) : pemetrexed를 처방
⑤ 육종(sarcoma) : 근육 및 결합조직. 발생 빈도는 낮지만 외부 인자에 크게 영향 받지 않으며, 어린 연령에 빈발
○ 골육종(osteogenic sarcoma) : 소아 골조직 파괴. 온몸 전이
○ 골수종(myeloma) : 골수의 조혈 작용 방해, 악성 종양
○ 연골육종(chondrosarcoma) : 연골 종양
○ 근육육종
○ 지방육종(liposarcoma)
⑥ 혈액암(hematological cancer)
○ 백혈병(leukemia) : 미성숙 백혈구가 자가면역질환 반응을 일으켜 정상조직을 파괴. 정상 혈구의 수는 극히 적어지게 되어 면역기능은 물론 산소 운반이나 영양 공급 같은 기본적인 혈액의 기능을 수행할 수 없음
○ 림프종(lymphoma) : Hodgkin's lymphoma, Brukitt's lymphoma가 대표적
⑦ 기타
○ 고형암(solid tumor)
○ 교모세포종(glioblastoma) : 뇌의 교세포에서 발생하는 종양 중 발생빈도가 높고 악성도가 가장 높은 종양
○ 테라토마(teratoma) : 내배엽, 중배엽, 외배엽 조직이 모두 관찰되는 암
⑹ 진단 방법
① CA125(cancer antigen 125) (암종 특이단백질)
○ 아미노산 서열은 22,000 aa이고, 뮤신 16 or MUC 16으로도 알려져 있음
○ 단항체, OC-125(난소암 항체)가 인식하는 종양항원(CA125)으로 상피성 암의 세포막 당단백질
○ 혈청의 CA 125의 정상치 : 35U/ml 미만
○ 난소암의 치료 효과, 재발 조기 발견에 유일한 종양 표식자
○ 예후 결정 및 난소암의 크기, 병기 및 생존율과 연관이 있음
○ CA125는 난소암, 자궁내막암, 췌장암, 폐암, 유방암, 대장암, 위장관암에도 증가할 수 있어 선별검사 가치는 낮음
② CA15-3
○ 혈중 MUC1의 함량을 재서 암 재발율을 예측 : FDA에 승인받은 방법
○ MUC1은 MUC1-N (N말단 방향), MUC1-C (C말단 방향)로 구성되며 MUC1-N은 혈중으로 release되는 form
○ 세포막 상에서 MUC1의 발현은 방향성이 있으나 암세포에서는 방향성이 사라짐
○ MUC1-N은 hyperglycosylation 돼 있으나 암세포에서 glycosylation이 약해진다고 함
③ PSA(prostate-specific antigen), PSMA(prostate-specific membrane antigen)
④ 조직 검사 : 세포나 조직을 수술적으로 채취
○ 주사생검 : 주사바늘로 채취
○ 복강경 : 조명장치, 카메라, 작은 칼 수술도구
⑤ X-선 진단
○ 일반 종양 : 108 세포
○ 촉진 종양(10 mm) : 109 세포
○ 사망 종양(10 cm) : 1012 세포
⑥ 종양변이정도(TMB, tumor mutation burden)
○ 예후 예측
○ 전이 예측
○ 면역 관문 억제제 효능의 바이오마커로 사용할 수 있음
⑦ ICB(immune checkpoint blockade) : PD-1, PD-L1, CTLA4 등
⑧ 림프구 마커 : 자연살상세포, B 세포, T 세포 등의 마커
⑨ 신생항원
○ 개념
○ 신생항원(neoantigen) : 종양 DNA에서 특정 돌연변이가 발생할 때 암세포에 형성되는 완전히 새로운 단백질
○ 종양 관련 항원(tumor-associated antigen, TAA) : 정상세포에도 일부 발현
○ 생식 세포 발현 종양 항원(cancer-germline antigen, CGA) : 정상세포에도 일부 발현
○ 신생항원은 종양 특이적 항원(tumor-specific antigen, TSA)라고도 함
○ 신생항원은 공유 신생항원(shared neoantigen)과 개인 특이적 신생항원(personalized neoantigen)으로 구분
○ 연혁
○ 최초의 신생항원은 1988년 De Plaen 연구팀의 마우스 종양모델 cDNA 라이브러리 스크리닝을 통해 밝혀짐
○ 신생항원백신을 이용한 인간대상 임상시험은 2015년 최초로 이루어짐
○ 특성
○ 정상 조직에서는 발현하지 않으므로 오프타겟 효과를 야기하지 않음
○ 주로 비동의 돌연변이(non-synonymous mutation)에 의해 발생
○ 1개의 아미노산 변화라도 T 세포에 의해 인식될 수 있음
○ 신생항원은 면역원성이 있음 : 단, 면역원성까지 있어야 신생항원으로 보는 경우가 많음
○ 예시
○ KRAS G12D
○ BRAF V600E
○ EGFRvIII
○ CD19
○ NY-ESO-1
○ MUC1
⑺ 치료 방법
① 개요
○ 치료가 쉬운 암 : 갑상선암, 유방암, 전립선암
○ 치료가 힘든 암 : 췌장암, 폐암, 간암, 뇌암
② 방법 1. 수술 : 국부적인 종양은 수술에 의해 제거될 수 있음
③ 방법 2. 화학치료 : 분열하는 세포를 죽이는 화학약품, 즉 항암제를 사용
○ 칵테일 요법 : 다양한 세포분열 저해 화학 약품들을 섞어서 사용
○ 저항성 세포 : 1/100만. 촉진 종양 시 1000개 정도 저항성 세포
○ 정상 분열하는 세포들(모든 세포, 골수, 위벽)을 죽이는 부작용 : 탈모, 구토, 설사 수반
○ TNBC(triple negative breast cancer cell)
○ 에스트로겐, 프로게스테론, 상피성장인자가 발현되지 않는 유방암 세포
○ 상피성장인자 중에서도 특히 ERBB2 (Her2/neu)
○ 미국에서 진단된 모든 유방암 사례의 10-20%를 차지
○ 3가지의 수용체가 발현되지 않아 호르몬 항암제(e.g., Tamoxifen), 수용체 치료법(e.g., Herceptin) 등의 효과 ↓
○ 예 1. 췌장암 표준 치료법 : nab-paclitaxel + gemcitabine
④ 방법 3. 방사선 치료 : 고 에너지 방사선을 사용
○ DNA를 손상시켜서 암세포 치사 (BRCA2, p53)
○ 보통 가까이에 있는 암에 사용
○ 전형적으로 종양을 수술로 제거한 후에 10-20회 방사선 치료
○ 정상 세포 → 정상 세포분열(by p53, DNA 회복) 또는 세포자살(apotosis)
○ 종양세포 → 돌연변이 증가에 의한 세포 사망 or 악성종양 심화
○ 예 1. 전립선암 표준 치료법 : PSMA-targeting radionuclide
⑤ 각 암종별 표준 치료법
○ 갑상선암 : 수술 또는 I-131이 주된 치료법
○ 피부암 : 보통 cryo-surgery를 통해 치료
○ 혈액암 : 혈액암 항원 중 가장 많이 타겟팅되는 것은 CD19
○ 고형암 : 현재까지 알려진 치료법이 없음. 고형암 항원 중 가장 많이 타겟팅되는 것은 TAA(tumor-associated antigen)
○ 교모세포종 : 정상조직과의 경계가 모호해 치료가 어려움. 현재까지 알려진 치료법이 없음
○ 림프종 : chemotherapy로 치료되는 편
⑻ 암의 통계 : 2015년 전 세계적으로 880만 명이 암으로 사망
입력: 2015.06.27 18:10
수정: 2022.04.26 20:58
'▶ 자연과학 > ▷ 일반생물학' 카테고리의 다른 글
| 【생물학】 헤모글로빈 (0) | 2022.05.23 |
|---|---|
| 【생물학】 16강. 소화계 (6) | 2022.05.19 |
| 【생물학】 4-5강. 단백질 합성 (0) | 2022.04.12 |
| 【생물학】 약물 스크리닝 기술 (0) | 2022.01.18 |
| 【생물학】 10-2강. 후성유전체 시퀀싱 (0) | 2022.01.09 |


최근댓글