2016 MEET/DEET 화학
추천글 : 【화학】 MEET/DEET 화학 풀이
1. 그림은 주양자수(n)가 각각 1, 2, 3인 수소 원자 오비탈 ㈎ ~ ㈐의 방사 방향 확률 분포 함수 f(r)를 나타낸 것이다. 오비탈 ㈎ ~ ㈐에 대한 설명으로 옳지 않은 것은?
⑴ 문제


⑵ 풀이 : ②
① ℓ = 0 → mℓ = -ℓ, ..., 0, ..., ℓ = 0
② 방사방향 마디의 수 = n - ℓ - 1 = 0 = 1 - ℓ ⇔ ℓ = 1. 따라서 아령 모양의 p 오비탈
③ 방사방향 마디의 수 = n - ℓ - 1 = 0 = 2 - ℓ ⇔ ℓ = 2
④ 전체 마디의 수 = n-1 = 2
⑤ 수소 원자 오비탈의 에너지 준위는 En = -Ry / n2. ㈎와 ㈏의 에너지 간격은 3Ry / 4이고, ㈏와 ㈐의 에너지 간격은 5Ry / 36.
2. 다음은 원자 H, C, N, O가 분자식에 나열된 순서대로 결합된 세 가지 분자이다. 이 분자들은 고리형이 아니다.
HOCN, HNCO, HCNO
가장 타당한 루이스 구조를 근거로, 원자가 껍질 전자쌍 반발 이론과 원자가 결합 이론을 적용하여 세 분자를 설명한 것으로 옳은 것은?
⑴ 문제

⑵ 풀이 : ③
○ 원자가 결합 이론 (옥텟 규칙)
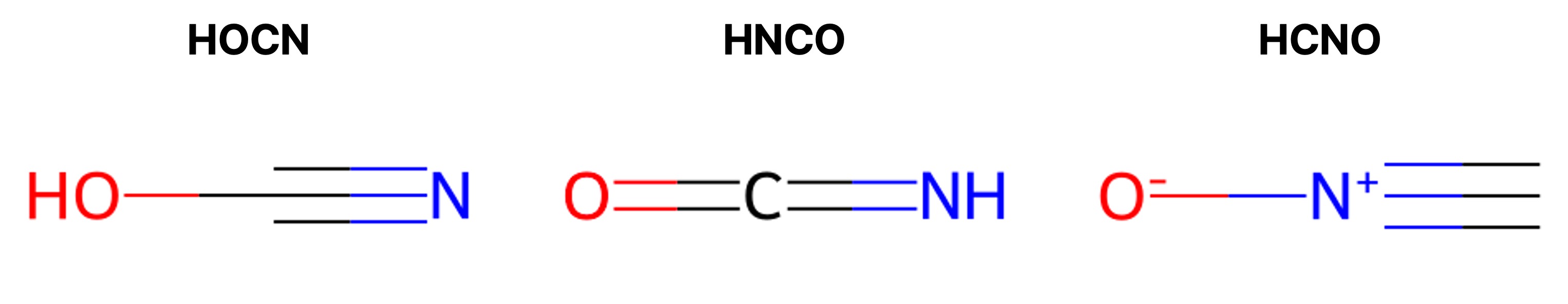
① -OH기가 -OC- 결합과 직선이 아님
② HNCO에서 C는 sp 혼성 오비탈을 가짐
③ HCNO에서 O는 3개의 비공유 전자쌍을 가져 형식전하가 6 - (결합의 수 + 2 × 비공유 전자쌍의 수) = -1이 됨
④ HNCO에서 C와 N 사이의 결합은 이중 결합
⑤ 다른 화합물과 달리 HCNO에서 N의 형식 전하는 +1
3. 그림은 탄소(C)의 원자 오비탈로부터 만들어진 C2의 분자 오비탈 에너지 준위의 일부를 나타낸 것이다. 이 그림을 이용하여 바닥 상태의 C, C2, C22-에 대해 설명한 것으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
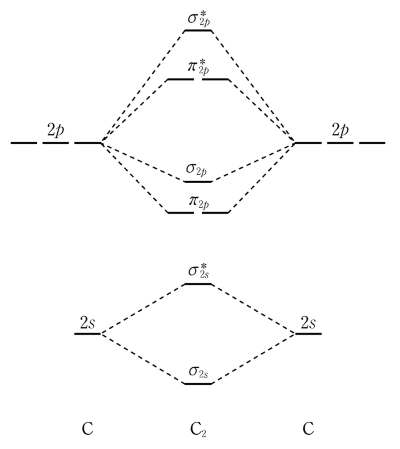

⑵ 풀이 : ③
○ C = 2s2sp3
○ C2 = σ2s2σ*2s2π2p4σ2p2
○ C22- = σ2s2σ*2s2π2p4σ2p2π*2p2
ㄱ. C2에는 홀전자가 없으므로 반자성
ㄴ. C보다 C2의 HOMO의 에너지 준위가 낮으므로 C2의 이온화에너지가 C보다 큼
ㄷ. 결합 차수 : C2의 결합 차수는 3, C22-의 결합 차수는 2
4. 이상 기체 A의 몰질량은 이상 기체 B의 2배이다. 일정 압력에서 동일 질량의 기체 A와 기체 B의 온도에 따른 성질을 옳게 나타낸 것은? (단, A와 B는 단원자 분자 기체이다.)
⑴ 문제
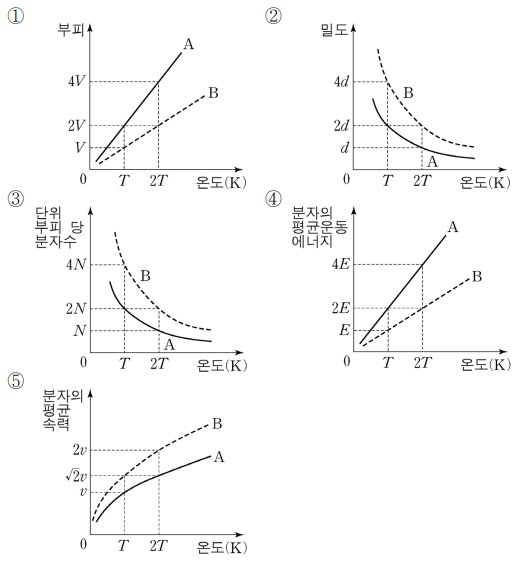
⑵ 풀이 : ⑤
③ n/V = P/RT에서 P와 R이 상수로 취급되므로, T만이 영향을 받게 되어 A와 B가 동일한 곡선을 가질 것
⑤ 제곱 평균 제곱근 속력 vrms = √ (3RT / μ)이므로, 2μB = μA → vrms,A = vrms,B / √2
5. 표는 벤젠과 사염화 탄소 각각의 성질과, 이 두 용매에 용질 A를 각각 녹인 용액 1과 용액 2의 조성과 어는점 내림을 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 온도에 따른 밀도의 변화는 없고 A는 용액에서 해리하거나 서로 결합하지 않으며 용액은 이상 용액이다.)
⑴ 문제
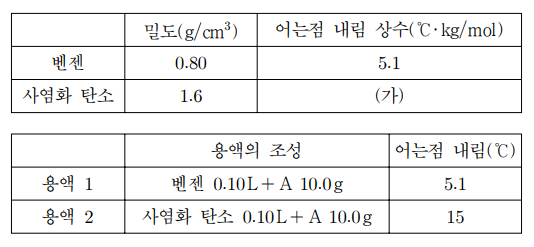

⑵ 풀이 : ④
ㄱ. 5.1 ℃ = m × 5.1 ℃·kg/mol ⇔ m = 1.0 (mol/kg)
ㄴ. 계산 과정
벤젠 0.10 L = 벤젠 100 mL = 벤젠 100 ㎤ = 벤젠 80 g
∴ A 10.0 g = 80g × 1 kg / 1000g × 1.0 mol/kg = 0.08 mol
∴ A의 분자량 = 10.0 g / 0.08 mol = 125 g/mol
ㄷ. 계산 과정
사염화 탄소의 질량 = 0.10 L × 1000 mL / L × 1 ㎤ / mL × 1.6 g/㎤ = 160 g = 0.16 kg
∴ 15 ℃ = Kf × 0.08 / 0.16
∴ Kf = 30 (℃·kg/mol)
6. 그림은 25 ℃에서 CO2 (g)와 관련된 반응 경로와 각 단계의 표준 반응 엔탈피(ΔHº)를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
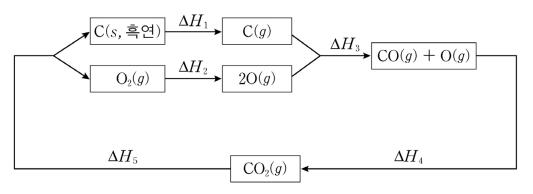

⑵ 풀이 : ①
ㄱ. 생성 엔탈피의 정의 : 동핵 이원자 기체나 탄소결정, 금속결정의 생성 엔탈피는 0
ㄴ. CO2(g)의 결합 에너지 = Hf[C(g)] + 2 × Hf[CO(g)] - Hf[CO2(g)] = -ΔH3 - ΔH4
ㄷ. CO(g)의 표준 연소 반응은 CO(g) + 1/2 O2 → CO2(g)이므로, CO(g)의 표준 연소 엔탈피 = Hf[CO2(g)] - Hf[CO(g)] = Hf[CO2] - (Hf[CO(g)] + Hf[O(g)]) + Hf[O(g)] = ΔH4 + 1/2 ΔH2
7. 그림은 HOCl (pKa = 7.55)과 NaOCl의 혼합 수용액에서 pH에 따른 [HOCl]의 분율([HOCl] / ([HOCl] + [OCl-]))을 나타낸 것이다. 모든 혼합 용액에서 [HOCl] + [OCl-] = 0.10 M이다. 25 ℃에서 이에 대한 설명으로 옳지 않은 것은?
⑴ 문제
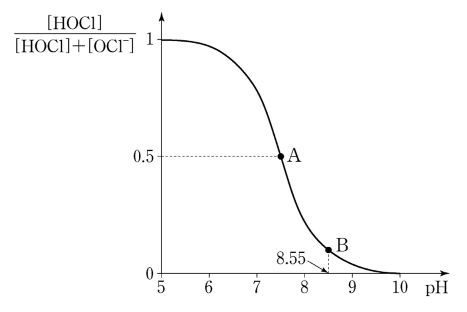

⑵ 풀이 : ⑤
① pKb = pKw - pKa = 14 - 7.55 = 6.45
② 완충 용량은 짝산과 짝염기가 1:1 비율로 존재할 때 가장 큼
③ 핸더슨-하셀바흐 방정식 : pH = 8.55 = pKa + log ([A-] / [HA]) = 7.55 + log ([OCl-] / [HOCl])
④ [OCl-] = 0.05 M × 1 L - 1.0 M × 1.0 mL = 49 mmol. [HOCl] = 0.05 M × 1 L + 1.0 M × 1.0 mL = 51 mmol
⑤ 핸더슨-하셀바흐 방정식을 보면, (너무 극단적으로 희석하는 게 아닌 이상) pH는 짝산과 짝염기의 비로 결정되므로 pH는 변하지 않음
8. 표는 반응 A(g) + B(g) → C(g)에 대하여 300 K와 400 K에서 A와 B의 초기 농도를 변화시켜 측정한 초기 반응 속도를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 기체 상수 R = 8.31 J/mol·K이다.)
⑴ 문제
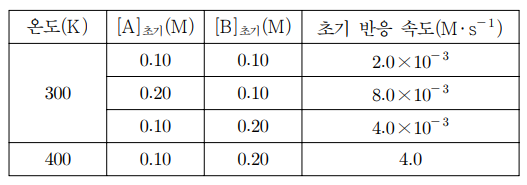

⑵ 풀이 : ⑤
ㄱ. 첫 두 개 데이터를 보면, A의 농도가 두 배가 되면 초기 반응 속도가 네 배가 되므로 A에 대한 반응 차수는 2 (제곱). 한편, B의 농도가 두 배가 되면 초기 반응 속도가 두 배가 되므로 B에 대한 반응 차수는 1.
ㄴ. v = k [A]2[B]이므로, 2.0 × 10-3 = k × 0.102 × 0.10 ⇔ k = 2.0 (M-2s-1)을 얻을 수 있음
ㄷ. 아레니우스 식 : k300K = 2.0, k400K = 2000이므로 활성화 에너지는 다음과 같이 계산할 수 있음
ln k300K = ln 2 = ln A - Ea / 300R
ln k400K = ln 2000 = ln A - Ea / 400R
∴ ln 1000 = Ea / 1200R ⇔ Ea = 1200 × 8.31 × ln 1000 (J/mol)
9. 다음은 어떤 반응의 제안된 메커니즘이며 사전평형(pre-equilibrium) 근사법을 적용한 전체 반응 속도 상수는 k이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
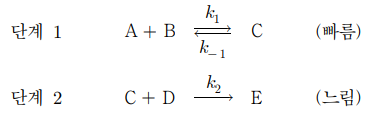

⑵ 풀이 : ①
ㄱ. C는 반응 중간체. 촉매가 되려면 반응물과 생성물로 나타나야 함
ㄴ. 단일 단계 반응
ㄷ. 계산 과정
k1[A][B] = k-1[C] ⇔ [C] = (k1 / k-1) [A][B]
v = k2[C][D] = (k1k2 / k-1) [A][B][D]
그런데, k[A][B][C][D] = k'[A]2[B]2[D]이므로 적절한 반응 속도 표현이 아님
10. 그림은 대기 중의 이산화 탄소(CO2)가 빗물에 녹아 pH에 영향을 주는 과정을 나타낸 것이다. 표는 이와 관련된 과정의 평형 반응식과 평형 상수를 나타낸 것이다. 용해된 CO2의 농도는 헨리의 법칙을 따르며 빗물에 대한 CO2의 헨리 상수(KH)는 3.0 × 10-2 M/atm이다. 대기 중 CO2의 분압은 5.0 × 10-4 atm이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 물의 자체 이온화에 의해서 생성된 H+(aq)의 양은 무시한다.)
⑴ 문제
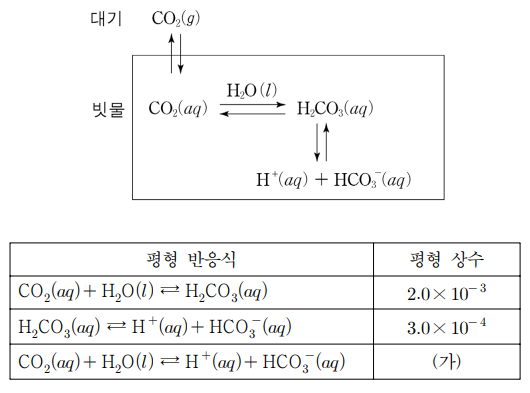

⑵ 풀이 : ⑤
ㄱ. KH = 3.0 × 10-2 M/atm = [CO2(aq)] / (5.0 × 10-4 atm) ⇔ [CO2(aq)] = 1.5 × 10-5 M
ㄴ. 화학평형식의 가감승제 : ㈎ = (2.0 × 10-3) × (3.0 × 10-4) = 6.0 × 10-7
ㄷ. 계산 과정
[H2CO3(aq)] = [CO2(aq)] × (2.0 × 10-3) = 3.0 × 10-8 M
3.0 × 10-4 = [H+(aq)][HCO3-(aq)] / [H2CO3(aq)] = [H+]2 / (3.0 × 10-8)
⇔ [H+] = 3.0 × 10-6 M
⇔ pH = 6 - log 3
11. 다음은 25 ℃에서 산 HA의 해리와 물의 자체 이온화 반응에 대한 열화학 반응식이다.
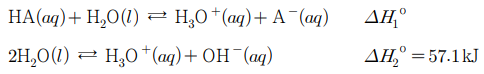
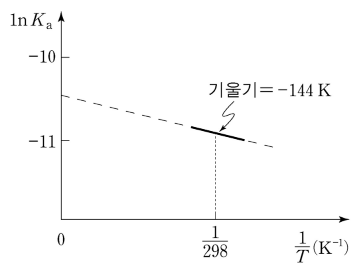
그림은 HA의 온도에 따른 산 해리 상수(Ka)를 나타낸 것이다. 25 ℃에서 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은? (단, 기체 상수 R = 8.31 J/mol·K이다.)
⑴ 문제

⑵ 풀이 : ①
ㄱ. 클라우지우스-클라페이론(Clausius-Clapeyron)
ΔGº = -RT ln Ka = ΔHº - TΔSº
⇔ ln Ka = -ΔHº / RT + ΔSº / R
⇔ ΔHº > 0
ㄴ. ΔSº / R ≒ -10.5
ㄷ. 중화반응 HA + OH- → H2O + A-에 대한 중화 엔탈피는 ΔH1º - ΔH2º = (144 × 8.31 × 10-3 - 57.1) kJ/mol
12. 표는 아인산(H3PO4)과 인산(H3PO4)의 구조식과 25 ℃ 수용액에서의 산 해리 상수(Ka)를 나타낸 것이다. 25 ℃에서 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
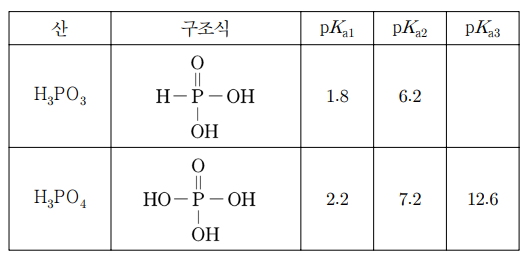

⑵ 풀이 : ②
ㄱ. 아인산은 이양성자 산
ㄴ. pKb2 = 14 - 6.2 = 7.8. [OH-]2 / [HPO32-] = Kb2 ⇔ pOH = 1/2 pKb2 = 3.9 ⇔ pH = 14 - 3.9 = 10.1
ㄷ. pH = 1/2 (2.2 + 7.2) = 4.7
13. 표는 착이온 ㈎~㈐의 화학식, 입체 구조, 자성, 착이온의 가시영역의 최대 흡수 파장(λ최대)을 나타낸 것이다. en은 에틸렌디아민(H2NCH2CH2NH2)이다. 이에 대한 설명으로 옳지 않은 것은?
⑴ 문제
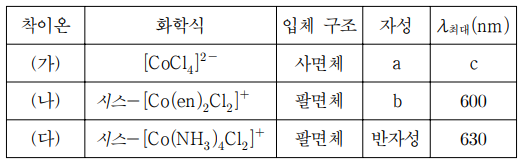

⑵ 풀이 : ③
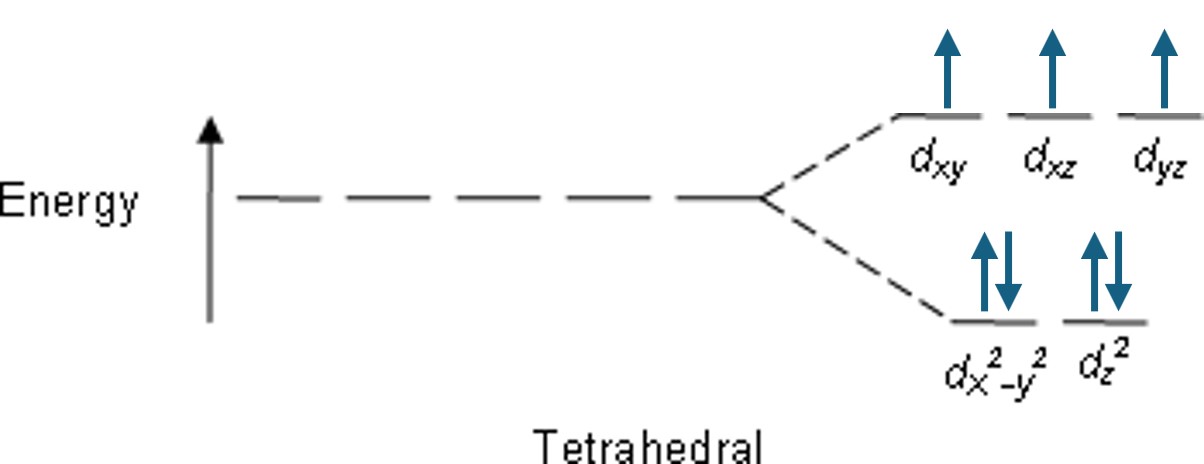
① ㈎의 경우, Co의 산화수는 +2이고 Cl-가 약한 장 리간드이므로 다음 전자 배치에 비추어 상자성
② ㈏의 경우, Co의 산화수는 +3이고 ㈐에서의 NH3보다 더 강한 en 리간드가 있으므로 ㈐처럼 low spin이 되어 반자성
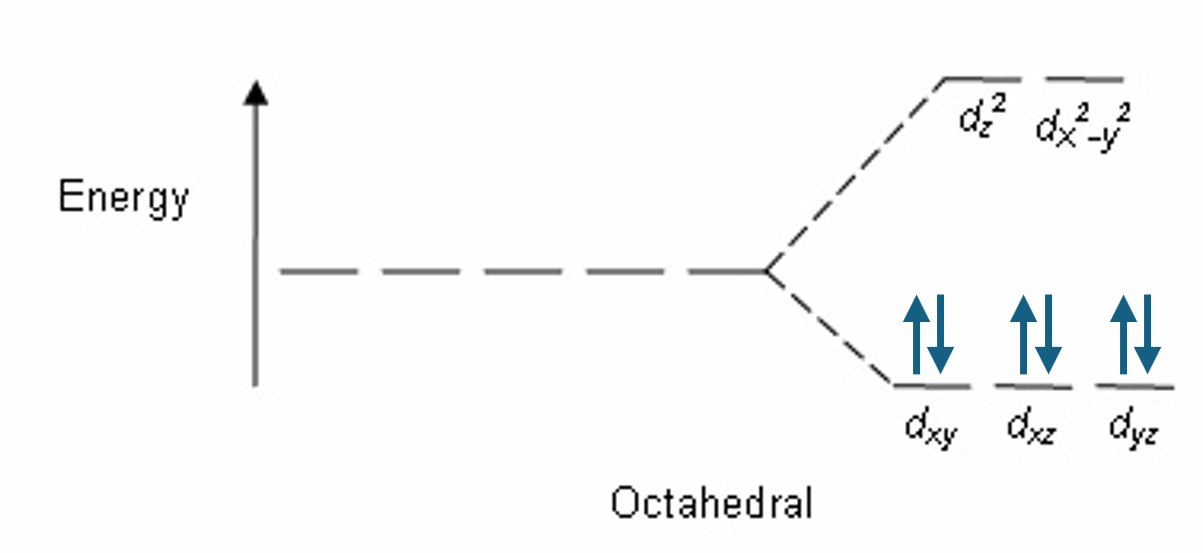
③ 팔면체 구조는 에너지가 큰 짧은 파장(가시광선, 자외선)을 흡수하는 반면, 사면체 구조는 에너지가 작은 비교적 긴 파장을 흡수. 그러므로 c는 600보다 큼 (ref)
④ cis-[Co(en)2Cl2]+
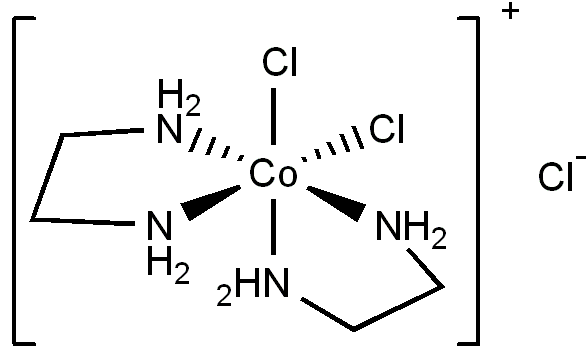
⑤ 암기사항. 다만, 최대 흡수 파장을 주어 eg와 t2g 간 에너지 준위 차이가 NH3일 때보다 en일 때 더 크다는 것을 알 수 있어, NH3보다 en이 더 강한 리간드임을 알 수 있음
14. 다음은 과황산 이온(S2O82-)이 포름산(HCOOH)을 분해하는 반응에 대한 균형 반응식이다. 이에 대한 설명으로 옳은 것만을 〈보기〉에서 있는 대로 고른 것은?
⑴ 문제
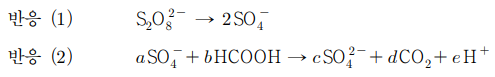

⑵ 풀이 : ④
ㄱ. S2O82-와 SO4- 모두에서 S의 산화수는 +7
ㄴ. HCOOH에서 C의 산화수는 +2, CO2에서 C의 산화수는 +4
ㄷ. SO4- → SO42-일 때 S의 산화수는 +7에서 +6으로 변함. S의 산화수 변화 = -1이고 C의 산화수 변화 = +2이므로 a : b = 2 : 1이 되어 전자 수를 맞추게 됨
15. 다음은 인공 뼈와 치아 소재로 이용되는 인회석(apatite)에 대한 내용이다. 25 ℃에서 이에 대한 설명으로 옳지 않은 것은?
⑴ 문제
인회석은 화학식이 Ca5(PO4)3X인 인산염 광물이다. 대표적인 인회석으로는 수산화 인회석(X = OH)과 플루오르화 인회석(X = F)이 있다. 인회석의 물에서의 용해 평형 반응식과 25 ℃에서의 용해도곱 상수(Ksp)는 다음과 같다.
Ca5(PO4)3OH(s) ⇄ 5Ca2+(aq) + 3PO43-(aq) + OH-(aq), Ksp = 2.3 × 10-59
Ca5(PO4)3F(s) ⇄ 5Ca2+(aq) + 3PO43-(aq) + F-(aq), Ksp = 3.2 × 10-60
치아의 바깥층은 치밀한 구조의 수산화 인회석으로 이루어져 있어 치아를 보호한다. 수산화 인회석은 불용성 화합물이지만 산성 용액에서는 용해도가 증가하여 치아가 손상된다. 이것을 예방하는 한 방법은 수산화 인회석의 OH- 이온을 F- 이온으로 치환시켜 플루오르화 인회석으로 변환시키는 것이다.

⑵ 풀이 : ④
① 플루오르화 인회석이 Ksp 값이 더 낮으므로 물에 대한 용해도가 더 낮음 (치약을 써서 치아를 보호하는 메커니즘)
②, ⑤ 산성 용액에서 PO43-보다 HPO42-, H2PO4-, H3PO4의 농도가 더 높아져, 화학 평형 방정식 [Ca2+]5[PO43-]3[F-] = 3.2 × 10-60 을 만족하려면 [Ca2+], [F-]의 농도를 높여야 함. 즉, 플루오르화 인회석의 용해도는 산성에서 더 큼
③ 쉽게 말하면, 산성 용액에서 OH-가 거의 없어서 수산화 인회석이 더 많이 용해됨
④ 반응식의 가감승제 : (2.3 × 10-59) / (3.2 × 10-60) = 23 / 3.2
16. 다음은 기체 발생 반응을 이용하여 기체 상수 R를 결정하는 실험이다. 이에 대한 설명으로 옳지 않은 것은? (단, 295 K에서 묽은 염산 수용액의 증기압은 20 mmHg이고 물에 대한 기체의 용해도는 무시한다.)
⑴ 문제
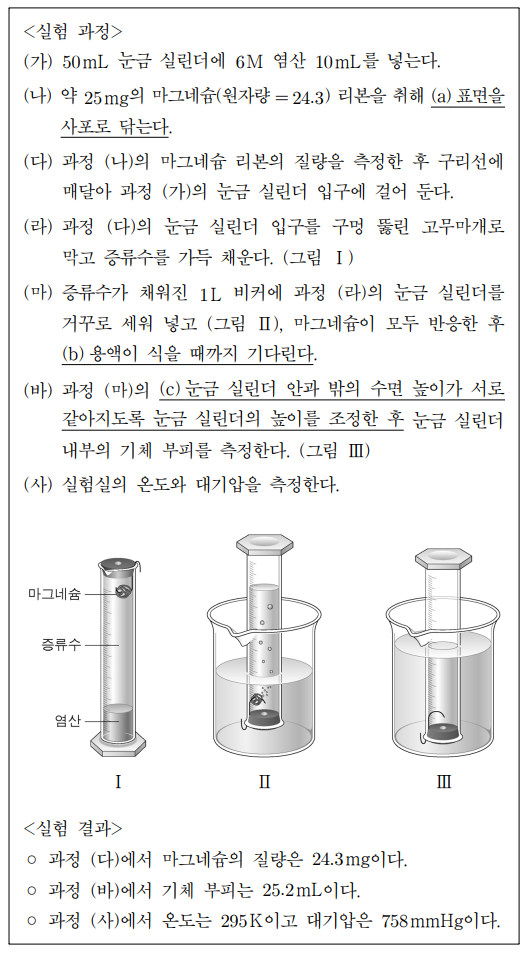

⑵ 풀이 : ⑤
① 2H+(aq) + Mg(s) → H2(g) + Mg2+(aq)
② 맞는 설명
③ 맞는 설명
④ 맞는 설명
⑤ 계산 과정
24.3 mg Mg × 1 mol Mg / 24.3 g × 1 mol H2 / 1 mol Mg = 1 mmol H2 = (758 - 20) mmHg × 25.2 mL / (R × 295 K)
⇔ R = 738 × 0.0252 / (0.00100 × 295) L·mmHg·mol-1K-1
입력: 2023.12.29 08:29
'▶ 자연과학 > ▷ MEET∙DEET∙PEET 풀이' 카테고리의 다른 글
| 【화학】 2017 MEET/DEET 화학 (예비검사) (0) | 2021.02.05 |
|---|---|
| 【유기화학】 2021 MEET/DEET 유기화학 (10) | 2020.08.26 |
| 【유기화학】 2004 MEET/DEET 유기화학 (0) | 2020.03.06 |
| 【유기화학】 2005 MEET/DEET 유기화학 (5) | 2020.03.06 |
| 【유기화학】 2006 MEET/DEET 유기화학 (0) | 2020.03.05 |




최근댓글